- Рекоммендации АФР online
- Тромбоз глубоких вен конечностей (ТГВ). АФР 1_2023
Рекомендации АФР online
Поиск по разделу
Рекомендации утратили силу
Общероссийская общественная организация "Ассоциация флебологов России" (АФР) информирует о том, что клинические рекомендации "Профилактика, диагностика и лечение тромбоза глубоких вен. Рекомендации российских экспертов", 2023 г. ID 1_2023 утратили свою силу.
Актуальные рекомендации размещены в начале раздела "Рекомендации АФР online" https://phlebounion.ru/recommendations и снабжены пометкой "Действующие рекомендации с навигацией"
Профилактика, диагностика и лечение тромбоза глубоких вен. Клинические рекомендации.
Официальное название в публикации: "Профилактика, диагностика и лечение тромбоза глубоких вен. Рекомендации российских экспертов".
Код версии (ID): 1_2023
Рекомендации утверждены голосованием Исполнительного Совета АФР (голосование ИС №62 28.01.2024). Текст рекомендаций направлен на утверждение в МЗ РФ и может быть обновлен по результатам рецензирования и утверждения.
ID минздрава: на утверждении
МКБ 10: I80.1; I80.2; I80.3; I80.8; I80.9; I82.2; I82.8; I82.9
Разработчик: Ассоциация флебологов России;
При участии: Ассоциации сердечно-сосудистых хирургов России, Российского общества хирургов, Российского общества ангиологов и сосудистых хирургов, Ассоциации травматологов-ортопедов России, Ассоциации онкологов России, Российского общества клинической онкологии, Российского общества онкогематологов, Российского кардиологического общества, Российского общества акушеров-гинекологов
Год издания: 2023
Текст в pdf
Скачать текст рекомендаций в формате pdf
Список сокращений
АВК – антагонисты витамина К (АТХ группа: антагонисты витамина К, B01AA)
АКТ – антикоагулянтная терапия
АПС – активированный протеин C
АСК – ацетилсалициловая кислота** (АТХ группа: антиагреганты, кроме гепарина, B01AC06)
АФР – Ассоциация флебологов России
АФС – антифосфолипидный синдром
АЧТВ – активированное частичное тромбопластиновое время
ВСУЗИ – внутрисосудистое ультразвуковое исследование
ВТЭО – венозные тромбоэмболические осложнения
ГИТ – гепарин-индуцированная тромбоцитопения
КлКр – клиренс креатинина
КОК - комбинированные оральные контрацептивы (АТХ группа: гормональные контрацептивы системного действия, G03AA, G03AB)
КПК – концентрат протромбинового комплекса** (Факторы свертывания крови II, VII, IX и X в комбинации) (АТХ группа: гемостатические средства, факторы свертывания крови, B02BD)
КС – коленный сустав
КТ-венография – компьютерно-томографическая ангиография сосудов нижних конечностей (A06.12.050)
КТЛ – катетерный тромболизис
ЛПЕ – липопротеинлипазные единицы
ЛЭ – легочная эмболия
МР-венография (МР-флебография) – магнитно-резонансная венография (A05.12.005)
МСКТ – мультиспиральная компьютерная томография
НКЗК – небольшое, но клинически значимое кровотечение
НМГ – низкомолекулярные гепарины (далтепарин натрия, АТХ: группа гепарина, B01AB04; надропарин кальция, АТХ: группа гепарина, B01AB06; эноксапарин натрия**, АТХ: группа гепарина, B01AB05; бемипарин натрия, АТХ: группа гепарина, B01AB12; парнапарин натрия**, АТХ: группа гепарина, B01AB07)
НФГ – нефракционированный гепарин** (АТХ группа: Группа гепарина, B01AB, гепарин натрия**)
ОДА – опорно-двигательный аппарат
ОНМК – острое нарушение мозгового кровообращения
ОРИТ – отделение реанимации, интенсивной терапии
ПНГ – пароксизмальная ночная гемоглобинурия
ПОАК – прямые оральные антикоагулянты (дабигатрана этексилат**, АТХ группа: ингибиторы тромбина прямые, B01AE07; апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03)
ППК – переменная пневматическая компрессия
ПТБ – посттромботическая болезнь
РВО – резидуальная венозная обструкция
РКИ – рандомизированное клиническое исследование
РТЛ – регионарный тромболизис
СВАГК – синдром верхней апертуры грудной клетки
СЗП – свежезамороженная плазма
ТБС – тазобедренный сустав
ТГВ – тромбоз глубоких вен
ТГВ ВК – тромбоз глубоких вен верхних конечностей
ТЭЛА – тромбоэмболия легочных артерий
УЗАС – ультразвуковое ангиосканирование
УЗДС – ультразвуковое дуплексное сканирование
ФМТ – фармакомеханическая тромбэктомия
ХБП – хроническая болезнь почек
ЦВК – центральный венозный катетер
ЧСС – частота сердечных сокращений
ЭМС – электрическая стимуляция мышц голени
ЭП – эндопротезирование
ACCP – American College of Chest Physicians
AFV – American Venous Forum
EPCR – эндотелиальный рецептор протеина С
ESVS – European Society for Vascular Surgery
MCP-1 – хемоаттрактант моноцитов 1
MMP – матриксные металлопротеиназы
NETs – экстрацеллюлярные нейтрофильные ловушки
SIR – Society of Interventional Radiology
tPA – тканевый активатор плазминогена** (АТХ группа: ферментные препараты, B01AD02)
uPA – плазминоген урокиназного типа
vWF – фактор von Willebrand
Термины и определения
Тромбоз глубоких вен – состояние, характеризующееся образованием тромба в глубоких венах.
Тромбоэмболия легочных артерий (легочная эмболия, легочная тромбоэмболия) –попадание в легочные артерии эмбола, источником которого являются вены большого круга кровообращения.
Венозные тромбоэмболические осложнения – собирательное понятие, объединяющее тромбоз поверхностных, глубоких вен и тромбоэмболию легочных артерий [1,2].
1. Краткая информация по заболеванию или состоянию (группе заболеваний или состояний)
1.1. Определение заболевания или состояния (группы заболеваний или состояний)
Тромбоз глубоких вен — наличие тромба в глубокой вене, который может вызвать ее окклюзию.
1.2. Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Этиология. Современные исследования патогенеза венозного тромбоза позволили изучить его механизмы, обобщенные принципы которых более ста лет назад сформулировал немецкий физиолог Рудольф Вирхов. Связующим звеном компонентов триады Вирхова активации свертывающей системы, повреждения венозной стенки и стаза крови являются последовательные процессы, в которых принимают участие клетки эндотелия, иммунной системы и факторов коагуляции [3]. Изучение патогенеза ТГВ в отсутствие возможности проведения экспериментальных исследований на человеке происходит на лабораторных животных, прежде всего, на грызунах. Наиболее приближенной к естественным условиям тромбообразования считается модель, индукцию тромбоза в которой осуществляют лигированием задней (нижней) полой вены (НПВ) мышей с сужением ее просвета до 80-90% [4]. Редукция кровотока с последующим стазом в подобных условиях влечет развитие тромбоза НПВ через 6-12 часов [5]. В течение 24-48 часов тромб в 60% случаев прогрессирует до окклюзивного [5]. Инициирующим тромбообразование фактором становится активация эндотелия венозной стенки. Изменение скорости венозного кровотока, системные воспалительные процессы, локальная и системная гипоксия, а также ряд других причин приводят к потере антитромботического и профибринолитического фенотипа эндотелия [6–8]. На его поверхности происходит экспрессия молекул адгезии, среди которых ICAM, фактор Виллебранда и Р-селектин [5,6]. Экспрессия последнего активирует лейкоциты и тромбоциты, имеющие на своей поверхности рецептор PSGL-1 [9]. В результате происходит адгезия этих клеток к эндотелию, который уже через 6 часов оказывается полностью покрыт лейкоцитами [5]. Ключевым для инициации коагуляции является тканевый фактор на поверхности моноцитов, составляющих порядка 30% всех лейкоцитов формирующегося тромба [5,10]. Усиление экспрессии тканевого фактора на моноцитах может происходить в условиях воспаления, химиотерапии, гипоксии [11]. Помимо клеток-эффекторов тромбообразования в растущем тромбе аккумулируются микрочастицы, также обладающие тромбогенностью за счет ТФ на их поверхности [9]. Активированные в образующемся тромбе нейтрофилы приобретают способность к формированию экстрацеллюлярных ловушек, NETs, которые обнаруживаются в тромбе уже через 3 часа с момента его индукции [5]. NETs характеризуются прокоагулянтной активностью, что обусловлено различными механизмами. В своем составе они содержат тканевой фактор, компоненты контактной системы, XII фактор, а также обладают способностью связываться с тромбином [5,12]. Тромбогенная активность присуща и гистонам, которые вызывают адсорбцию протеина С и тромбомодулина, способны подавлять фибринолиз и связывать фактор Виллебранда [13–15]. Тромбоциты появляются в тромбе через 6 часов, располагаются в виде изолированных клеток либо в виде небольших тромбоцитарных и нейтрофильных агрегатов [5]. Это обеспечивает обоюдную активацию тромбоцитов и нейтрофилов, а также возможность активации тромбоцитарного звена образующимися NETs [5,16]. В модели стеноза нейтрофилы, моноциты, тромбоциты и NETs являются равнозначными участниками венозного тромбоза, подавление функции каждого из которых в эксперименте приводит к уменьшению объема тромба или к угнетению его образования [5]. Экспериментальные исследования демонстрируют возможность образования в системе НПВ тромбов различных по своей морфологической структуре в зависимости от способа его индукции, что может определять особенности течения тромбоза и тромбоэмболии легочной артерии. В модели ТГВ с лигированием бедренной вены в сочетании с воздействием на её стенку лазерного излучения в течение 15 секунд образуется тромб, основу которого, в отличие от тромба предыдущей модели, составляют фибрин и эритроциты [17]. Тромбоциты располагаются широкими слоями, появляются на 30 секунде, но не играют ключевой роли в процессе образования тромба. Подавление активности тромбоцитов, нейтрофилов, NETs, как и элиминация свободных радикалов кислорода не приводят в данной модели ТГВ к угнетению тромбообразования. После снятия лигатуры с бедренной вены происходит постепенное исчезновение тромба вследствие его распада на мелкие эмболы. Повреждение стенки вены воздействием постоянного тока инициирует формирование тромба, богатого фибрином и тромбоцитами [18]. Последние оказываются фиксированными к поврежденной стенке сосуда в виде гомогенной массы. С поверхности тромба происходит фрагментация тромбоцитарных агрегатов в виде микроэмболов, при этом общая масса фиксированного к стенке венозного тромба не меняется. Индукция тромбоза аппликацией раствора FeCl3 с нарушением целостности венозной стенки инициирует появление тромбоцитарно-фибринового тромба [19,20]. При сохранении стабильной массы тромба с его поверхности происходит отрыв различных по величине и форме эмболов. В процессе развития тромбоза возникает фиброзная организация сгустка, его констрикция, фрагментация, реканализация и утолщение интимы, ремоделирование стенки вены [21,22]. Начиная со 2 недели тромбообразования стенку вены пенетрируют фибробласты, которые активно синтезируют коллаген [23]. В эксперименте через 2 недели с момента индукции тромбоза 35% его объема занимает коллаген, располагающийся по периферии тромба [24]. 80% всего образующегося коллагена приходится на коллаген I типа, 20% - на коллаген III типа [25]. При этом через 2 месяца с момента развития тромба, в нем практически отсутствуют клетки иммунной системы [23]. Помимо фибробластов источником коллагена становятся гладкомышечные клетки. Тромботические процессы в венозной стенке инициируют смену их фенотипа с сократительного на секреторный, что делает их одними из участников секреции экстрацеллюлярного матрикса, матриксных металлопротеиназ (ММР) и ингибиторов ММР [26]. Лизис тромботических масс начинается на этапе образования фибрина и продолжается на стадиях заполнения тромба коллагеном и, как и само тромбообразование, является клеточно-обусловленным процессом, реализуемым посредством фибринолиза и коллагенолиза [27]. Ферментативная основа тромболизиса заключается в деградации фибрина и коллагена. Ключевым ферментом фибринолиза является плазмин, который не только расщепляет фибрин и фибриноген, но и осуществляет протеолиз рецептора тромбоцитов GPIb к фактору Виллебранда [28]. Два основных фермента, регулирующих активность плазминогена, это tPA, фиксированный на эндотелиоцитах, и uPA, который секретируется эндотелиоцитами и проникающими в тромб моноцитами [29–31]. Их эффективность, в свою очередь, зависит от активности других протеинов, среди которых альфа-2-антиплазмин, TAFI и PAI-1 которые подавляют действие активаторов плазминогена, снижая эффективность фибринолиза [32,33]. Коллаген, как и фибрин, в процессе резорбции тромба подвергается разрушению. Коллагенолиз осуществляется за счет ММР и нейтрофильной эластазы [34]. В нем принимают участие большинство типов ММР, кроме ММР3, при этом лизис происходит в отношении преимущественно одного из двух типов коллагена [34,35]. В результате подавления активности ММР происходит повышение жесткости венозной стенки, ухудшение резорбции тромба [36]. Клеточными инициаторами тромболизиса можно считать нейтрофилы [37]. Инфильтрируя тромб, в первый день тромбоза они превышают по количеству моноциты в 7 раз, но спустя неделю их количество прогрессивно снижается на 50%, что отмечается на протяжении последующих недель [37]. Нейтрофилы обладают способностью к фибриногенолизу [38]. Макрофаги являются одними из главных участников тромболизиса. Они появляются с начала тромбообразования, МСР-1 и прогрессивно нарастают в течение 1-ой недели, со 2-ой недели преобладая среди клеток, инфильтрирующих тромб [37,39]. Макрофаги участвуют в резорбции тромба посредством нескольких механизмов. За счет фагоцитоза они элиминируют из тромба эритроциты, тромбоциты, детрит, части клеток, оставшиеся после апоптоза [13,40,41]. Макрофаги обеспечивают элиминацию NETs, секретируют фибринолитические и коллагенолитические ферменты, в числе которых uPA и ММР9, что способствует, в том числе, инвазии самих макрофагов в тромб [27,29,42,43]. Заполняя пространство лизированных структур, фибробласты взамен синтезируют коллаген [44,45]. Макрофаги, способствуют реканализации вены, за счет неоваскуляризации тромба [22]. Эндотелиоциты также являются не только участниками тромбообразования, но и его лизиса. Во время развития ТГВ эндотелиоциты претерпевают эндотелиально-мезенхимальную трансформацию, становятся подобными мезенхимальным клеткам [46]. Они начинают секретировать альфа-гладкомышечный актин и коллаген I и III типов [47]. Вместе с тем эндотелиоциты теряют способность к экспрессии молекулы адгезии РЕСАМ-1, которая является компонентом противоспалительного ответа, ассоциирована с подавлением формирования провоспалительного фенотипа макрофагов и секреции воспалительных цитокинов, с укреплением межклеточных контактов эндотелиоцитов, угнетением апоптоза эндотелиоцитов [48,49]. Эндотелиальные клетки, сохраняющие свой естественный фенотип, участвуют в эндотелизации тромба в процессе реканализации вены [50]. Кроме того, эти клетки сохраняют способность к паракринной регуляции процесса тромборезорбции, tPA и uPA, а также различные медиаторы, в числе которых оксид азота, ангиопоэтины 1 и 2, VEGF [50]. Определенный вклад в развитие тромба вносят аккумулированные в нём микрочастицы, которые способны секретировать PAI-1, тем самым подавляя фибринолиз и способствуя прогрессированию тромба [51]. Таким образом, изучение ключевых звеньев тромбоза является перспективным направлением с точки зрения разработки таргетных методов лечения ТГВ. Так в эксперименте было показано, что блокирование Р-селектина позволяет ускорить реканализацию тромба с сохранением венозных клапанов и уменьшить выраженность фиброза венозной стенки [52].
1.3. Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Венозные тромбоэмболические осложнения (ВТЭО) являются одной из наиболее значимых медико-социальных проблем, не уступая по некоторым оценкам частоте развития инсульта [53]. В Европе частота ВТЭО достигает 104-183 случая на 100000 человек в год, частота изолированного ТГВ - 45-117 на 100000 человек в год, а изолированной легочной эмболии - 29-78 на 100000 человек в год [53]. Если рассматривать ТГВ в сочетании с эмболией легочных артерий, то частота выявления увеличится на 25% [53]. В США частота ВТЭО соответствует 1-2 случаям на 1000 человек в год и колеблется на уровне 300000 – 600000 случаев ежегодно [54]. Частота развития ТГВ и ТЭЛА возрастает у людей старшего возраста, что в равной степени характерно для мужчин и женщин [55–57]. Вместе с тем в общей популяции частота ВТЭО у мужчин (130 на 100000 человек) превышает таковую у женщин (110 на 100000 человек) [230, 315]. Среди лиц в возрасте от 20 до 45 лет наибольшая распространенность ВТЭО отмечают у женщин, в возрасте 45-60 лет – у мужчин [56]. Исключение из оценки частоты факторов риска ВТЭО, типичных для женской популяции (прием оральных контрацептивов (АТХ группа: гормональные контрацептивы системного действия, G03AA, G03AB), беременность), демонстрирует преобладание ВТЭО у мужчин также и в первой возрастной группе [58]. У беременных женщин риск развития ВТЭО в 5 раз превышает таковой у небеременных и составляет 1-2 случая на 1000 женщин [59,60]. Вероятность развития ВТЭО у афроамериканцев выше, чем у американцев и европейцев и значительно превышает таковую у азиатов [61–64]. Частота рецидива ВТЭО достигает 30% в течение 10 лет, являясь при этом наиболее высокой в первые 6-12 месяцев, но никогда не снижается до нуля [53]. Результаты мета-анализа демонстрируют, что после завершения антикоагулянтной терапии при первом эпизоде неспровоцированного ВТЭО частота рецидива составляет 10,3, 6,3, 3,8 и 3,1 случаев на 100 человеко-лет в течение 1-го, 2-го, 3-5-го и 6-10-го года соответственно [65]. Это соответствует кумулятивной частоте 16%, 25,2% и 36,1% через 2, 5 и 10 лет. Для изолированных ТГВ и ТЭЛА, а также для их сочетания те же показатели представлены в таблице 1.
Таблица 1. Риск рецидива после завершения антикоагулянтной терапии по поводу первого эпизода клинически неспровоцированного ВТЭО [65].
|
Интервал после АКТ |
Частота событий на 100 человеко-лет |
|||
|
ТГВ |
ТЭЛА |
ТГВ+ТЭЛА |
Фатальная ТЭЛА |
|
|
1-й год |
6,2 (4,8-7,7) |
3,3 (2,4-4,2) |
0,3 (0,1-0,5) |
0,4 (0,2-0,7) |
|
2-й год |
3,7 (2,8-4,7) |
2,0 (1,4-2,6) |
0,2 (0,1-0,4) |
0,3 (0,2-0,6) |
|
2-летняя кумулятивная частота (%) |
9,7 (7,5-12,0) |
5,2 (3,7-6,7) |
0,5 (0,2-0,9) |
0,7 (0,4-1,3) |
|
3-5 годы |
2,5 (2,0-2,9) |
1,0 (0,4-1,8) |
0,1 (0,0-0,3) |
0,1 (0,0-0,3) |
|
5-тилетняя кумулятивная частота |
16,3 (12,9-19,5) |
8,0 (4,0-11,6) |
0,8 (0,2-1,8) |
1,0 (0,4-2,2) |
|
6-10 годы |
2,2 (1,0-3,8) |
0,7 (0,2-1,6) |
0,0 (0,0-0,1) |
0,1 (0,0-0,3) |
|
10-тилетняя кумулятивная частота (%) |
25,1 (17,2-33,7) |
11,2 (5,9-18,4) |
0,8 (0,2-2,3) |
1,5 (0,4-3,6) |
Адекватно проведенная антикоагулянтная терапия с отменой по истечении 3-6 месяцев не снижает рисков рецидива неспровоцированного ВТЭО в дальнейшем и не влияет на структуру рецидива [53,66,67]. Частота эпизодов ВТЭО в зависимости от локализации первичного тромботического эпизода представлена в таблице 2.
Таблица 2. Частота рецидива ВТЭО в зависимости от локализации первичного тромботического эпизода [65].
|
Срок после отмены АКТ |
Дистальный ТГВ |
Проксимальный ТГВ |
ТЭЛА |
ТГВ+ТЭЛА |
|
1 год: частота событий на 100 человек в год |
1,9 (0,5-4,3) |
10,6 (8,1-13,3) |
7,7 (5,6-10,2) |
10,2 (6,7-14,2) |
|
2-й год: частота событий на 100 человек в год |
Н/Д |
6,5 (5,2-7,8) |
4,5 (2,6 -6,8) |
7,6 (4,7-11,2) |
1.4. Факторы риска ТГВ
Венозный тромбоз является многофакторным заболеванием при отсутствии единой этиологии. Выделяют врожденные и приобретенные факторы риска, укладывающиеся в концепцию триады Вирхова, которые в той или иной степени повышают вероятность возникновения тромбоза. Они могут действовать одновременно и усиливать друг друга, повышая вероятность формирования тромба, которая никогда не достигает абсолютного значения. Из врожденных факторов риска значение имеют расовая принадлежность, мужской пол, возраст, генетически унаследованные состояния. Среди последних не-0 группа крови, в два раза повышающая риск развития ТГВ, гетерозиготный полиморфизм фактора свертывания V по типу Лейден, мутация гена протромбина 20210А, ассоциированные с 2-8 кратным риском ТГВ [68–73] . В десятки раз повышают вероятность развития ТГВ гомозиготная мутация в гене фактора Лейдена, дефицит протеина С и S, антитромбина [70,74]. Значимым является семейный анамнез ВТЭО, что увеличивает у последующего поколения) индивидуальный риск ТГВ в 3 раза [75]. К приобретенным факторам риска относят механическое повреждение эндотелия, которое может быть обусловлено установкой катетера, стента, кава-фильтра, протезированием вен, травмой или операцией [1]. Однако, наиболее значимыми являются факторы риска, воздействующие на функцию эндотелия, меняющие его исходный профибринолитический и антикоагулянтный фенотип. В основе механизма действия таких факторов лежат стаз крови, гипоксия, системные воспалительные реакции с повышением уровня провоспалительных медиаторов [6–8]. Хирургическое вмешательство увеличивает риск ТГВ в 4-6 раз, травма в 20 раз, иммобилизация в 2-4 раза, путешествия на большие расстояния в 2-3 раза, постановка центрального венозного катетера в 12 раз [75]. Ассоциированы с риском ТГВ также наличие варикозно расширенных вен, ожирение, острый инфаркт миокарда, гипертиреоидизм, воспалительные заболевания толстой кишки [75]. Значимыми факторами риска являются прием оральных контрацептивов (АТХ группа: гормональные контрацептивы системного действия, G03AA, G03AB), гормонозамещающая терапия, беременность, роды и послеродовый период, которые обусловливают 3-4-кратное повышение риска ТГВ [75]. Во время беременности риски ВТЭО прогрессивно возрастают от 1-го к 3-му триместру, а также в послеродовом периоде, увеличивая риск развития венозных тромбоэмболических осложнений в 4 раза [54]. Высокий риск ТГВ (повышение в 10-35 раз) характерен для женщин с наследственной тромбофилией при приеме оральных контрацептивов (АТХ группа: гормональные контрацептивы системного действия, G03AA, G03AB) [76]. Наиболее высокий риск отмечен в самом начале использования оральных контрацептивов, затем он постепенно снижается к концу первого года их применения [77]. Злокачественные новообразования рассматриваются как одни из наиболее значимых приобретенных факторов риска, которые в 4-7 раз повышают вероятность развития ТГВ в отсутствие химиотерапии и в 6,5-10 раз во время её проведения. Наибольший риск осложнений ассоциирован с раком поджелудочной железы, головного мозга, желудка, яичников, меньший с опухолями простаты, молочной железы, меланомой [78,79]. Из приобретенных состояний следует отдельно отметить антифосфолипидный синдром, при наличии которого риск развития ВТЭО увеличивается в 6-10 раз, что зависит от количества и характера лабораторных изменений [80]. Другим приобретенным тромбофилическим состоянием, при котором тромботические осложнения встречаются с частотой 30-45%, является пароксизмальная ночная гемоглобинурия [81].
1.4.1. Градация факторов риска ВТЭО
В настоящее время все факторы риска развития ТГВ принято разделять на большие и малые, транзиторные (временные) и персистирующие, что позволяет определить тактику лечения [82–86].
Воздействие большого транзиторного фактора ассоциируется с более, чем 10-кратным увеличением риска первичного тромбоза наряду с минимальной угрозой его рецидива (<3% в год) после завершения терапии антикоагулянтами (АТХ группа: антитромботические средства B01A) [84].
К большим провоцирующим факторам относят:
- операция под общей анестезией длительностью >30 минут [82,83]
- постельный режим в условиях стационара на протяжении ≥ 3 дней вследствие острого или обострения хронического заболевания [82,83]
- травму с переломами [83]
- кесарево сечение [82,84]
Малый транзиторный фактор риска увеличивает вероятность первичного тромбоза менее, чем в 10 раз, и ассоциируется с умеренной частотой рецидива после завершения антикоагулянтной терапии на уровне 3-8% в год [84].
Малыми транзиторными факторами служат [82–84]:
- операция под общей анестезией <30 минут;
- госпитализация в стационар <3 дней вследствие острого заболевания;
- терапия эстрогенами/контрацепция;
- беременность и послеродовый период;
- постельный режим в амбулаторных условиях ≥3 дней при остром заболевании;
- повреждение нижней конечности (без перелома) с ограничением активности на ≥ 3 дня;
- длительный авиаперелет.
Под малыми персистирующими факторами понимают хронические заболевания и состояния, повышающие вероятность развития первичного тромбоза менее, чем в 10 раз, и ассоциирующиеся с умеренной опасностью его повторного возникновения (3-8% в год) после завершения терапии антикоагулянтами: воспалительное заболевание толстой кишки, аутоиммунное заболевание, парезы и параличи нижних конечностей, застойная сердечная недостаточность, ожирение, нарушенная функция почек, семейная история ВТЭО, верифицированная наследственная тромбофилия [84,87].
Большим персистирующим фактором риска принято считать онкологические заболевания, а именно: отсутствие проведенного потенциально радикального лечения, наличие признаков рецидива или прогрессирования заболевания, в условиях продолжающегося лечения и антифосфолипидный синдром [82,88]. Риск рецидива ВТЭО при завершении терапии антикоагулянтами в таких случаях превышает 8% в год.
1.5. Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
1.5.1. МКБ-10
Болезни вен, лимфатических сосудов и лимфатических узлов, не классифицированные в других рубриках (I80-I89)
Флебит и тромбофлебит (I80):
I80.1 – флебит и тромбофлебит бедренной вены
I80.2 – флебит и тромбофлебит других глубоких сосудов нижних конечностей
I80.3 – флебит и тромбофлебит нижних конечностей неуточненный
I80.8 – флебит и тромбофлебит других локализаций
I80.9 – флебит и тромбофлебит неуточненной локализации
Эмболия и тромбоз других вен (I82):
I82.2 – эмболия и тромбоз полой вены
I82.8 – эмболия и тромбоз других уточненных вен
I82.9 – эмболия и тромбоз неуточненной вены
Исключены: эмболия и тромбоз вен: мозговых (I63.6; I67.6), коронарных (I21-I25), внутричерепных и спинномозговых, септические или БДУ (G08), внутричерепных, непиогенные (I67.6), спинномозговых, непиогенные (G95.1), нижних конечностей (I80), брыжеечных (K55.0), портальных (I81), легочных (I26), осложняющие: аборт, внематочную или молярную беременность (O00-O07, O08.8), беременность, роды и послеродовой период (O22., O87.)
1.5.2. МКБ-11:
BD71 Тромбоз глубоких вен
BD71.0 Тромбоз глубоких вен верхних конечностей
BD71.1 Тромбоз полой вены
BD71.3 Тромбоз подвздошной вены
BD71.4 Тромбоз глубоких вен нижней конечности
BD71.Y Другие уточненные тромбозы глубоких вен
BD72 Венозная тромбоэмболия
1.6. Классификация заболевания или состояния (группы заболеваний или состояний)
1.6.1. По уровню тромботической окклюзии
В зависимости от уровня тромботической окклюзии ТГВ характеризуется различной частотой эмболических осложнений, развития посттромботической болезни, риском рецидива, что обусловливает необходимость прицельной оценки распространенности тромбоза и причин его развития в соответствии с действующей классификацией. Наибольшее распространение в практике получила классификация по анатомическому принципу с определением уровня тромботической обструкции, в соответствии с которой ТГВ разделяют [85]:
- проксимальный, при котором тромботические массы локализованы в подколенной вене, бедренной или подвздошных венах, нижней полой вены вне зависимости от наличия тромбоза вен голени
- дистальный, к которому относят тромбоз глубоких вен голени без распространения на подколенную вену.
Для дальнейшей дифференцировки ТГВ по уровню поражения может быть использована классификация с указанием анатомических сегментов, на которые распространяется тромбоз: подвздошно-бедренный (илиофеморальный), бедренно-подколенный (феморопоплитеальный) или другие варианты [85].
1.6.2. По причине развития
В зависимости от провоцирующего фактора возможна следующая классификация тромбоза глубоких вен [85]:
- спровоцированный
- неспровоцированный
Неспровоцированный ТГВ развивается вне воздействия очевидных факторов риска и имеет умеренный риск рецидива уровне 8% в год [83,89]. Провоцирующие развитие ТГВ факторы разделяют на:
- большие и малые,
- персистирующие и транзиторные (временные) [83].
Подробная классификация факторов риска представлена выше.
1.6.3. По характеру проксимальной части
Исследования по оценке риска ТЭЛА, ассоциированного с наличием флотирующего тромба, не выявили значимой разницы в частоте эмболических событий при окклюзивном и неокклюзивном, в том числе и флотирующем тромбе [90,91]. Это говорит о невысокой значимости метрической оценки тромба при решении вопроса о его эмбологенности. В настоящее время в зарубежных клинических рекомендациях неокклюзивный ТГВ не рассматривается в качестве показания к механической профилактике ТЭЛА с установкой кава-фильтра [85,92]. Таким образом, классификация ТГВ по характеру проксимальной части и наличию флотации не является обязательной для принятия клинических решений, но может служить дополнительным параметром в рамках индивидуальной оценки показаний к хирургической профилактике ТЭЛА.
1.6.4. Формулировка диагноза
При формулировке диагноза рекомендуется отразить: локализация и распространенность тромба. По решению врача диагноз может быть дополнен деталями, касающимися предположительной длительности заболевания, возможных провоцирующих факторов, характеристик проксимальной границы тромботического поражения и морфологических особенностей тромбированных сегментов и наличия эмболического поражения легочного русла.
Примеры формулировки диагноза.
- Проксимальный тромбоз глубоких вен левой нижней конечности.
- Дистальный тромбоз глубоких вен правой нижней конечности от 02.02.22
- Спровоцированный, неокклюзивный, проксимальный тромбоз глубоких вен слева, начальная реканализация глубоких вен голени;
- Спровоцированный большим транзиторным фактором бедренно-подколенный тромбоз правой нижней конечности от марта 2021г, полная реканализация бедренной и подколенной вен;
- Неспровоцированный дистальный тромбоз левой нижней конечности (венозные синусы) от 10.01.2021; неполная реканализация
1.7. Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Выраженность клинических проявлений ТГВ обусловлена протяженностью тромба. Таким образом, наиболее тяжелое течение наблюдают при поражении подвздошных вен и подвздошно-бедренного сегмента [85]. Типичными симптомами служат выраженный отек нижней конечности, который может распространяться от лодыжки до паховой области или ограничиваться дистальными отделами голени, уменьшение объема движений, гиперемия, напряжение в мышцах, боль в нижней конечности [75,85]. При изолированном тромбозе подвздошных вен боль меняет свою локализацию и характеристики и приобретает ноющий характер в поясничной области. В ряде случаев ТГВ сопровождается лихорадкой. Распространенный тромбоз с практически полной обструкцией венозного кровотока, который получил название синяя флегмазия, сопровождается массивным отеком, цианозом кожных покровов, интенсивным болевым синдромом. В наиболее тяжелых случаях синей флегмазии при тромбозе всех коллатеральных путей оттока и сосудов микроциркуляторного русла развивается гангрена нижней конечности. Дистальный тромбоз, который составляет до 50% всех ТГВ [93], может протекать бессимптомно или иметь минимальные проявления в виде боли в голени. При физикальном обследовании у ряда пациентов можно выявить определенные симптомы, которые не являются патогномоничными, но позволяют заподозрить наличие ТГВ. Симптом Хоманса заключается в появлении резкой боли в икроножных мышцах при тыльном сгибании стопы; частота выявления симптом составляет 56%, чувствительность 57,5%, специфичность 30,4% [94,95]. О наличии симптома Мозеса говорят при болезненности при сдавлении голени в переднезаднем направлении; частота выявления его составляет 45%, чувствительность 45%, специфичность 91,3% [94,95]. Схож с последним симптом Ловенберга – появление боли в икроножных мышцах при нагнетании давления в наложенной манжете сфигмоманометра до 60-150 мм. рт. ст.; частота выявления 34%, чувствительность 33,8%, специфичность 56,5% [94,95]. Более редким является симптом Лискера – появление костных болей, вызываемых постукиванием пальцем по передней поверхности голени медиально от гребня большеберцовой кости; частота выявления составляет 14%, чувствительность 13,8%, специфичность 95,5% [94–96]. Большинство симптомов ТГВ неспецифичны. Так, для боли в голени чувствительность и специфичность составляют 75-91% и 3-87% соответственно, для отека голени – 35-97% и 8-88% соответственно [75]. Отдельного внимания заслуживает клиническая картина ТГВ у беременных, у которых нередко возникают сложности в диагностике данного заболевания. В 85% случаев ТГВ развивается на левой нижней конечности, что может быть обусловлено сдавлением левой общей подвздошной вены в месте ее пересечения с правой общей подвздошной артерией [97]. В 72% случаев развивается проксимальный тромбоз, который часто осложняется ТЭЛА [97]. Около 71% ТГВ у беременных начинается в подвздошных венах, зачастую ограничиваясь ими без распространения на вены голени [98]. Из них 64% случаев составляют тромбозы подвздошных и/или бедренных вен [98]. Подобная особенность локализации обусловливает нетипичность клинических проявлений.
2. Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
2.1. Критерии установления диагноза/состояния
Критерием диагноза служит сочетание симптомов тромботической окклюзии глубоких вен (отек голени, отек голени и бедра, с или без боли в нижней конечности, ощущением тяжести в ней), возникших внезапно, и инструментальных (ультразвуковых, рентгеновских) данных о наличии тромботических масс в просвете глубоких вен. При бессимптомном ТГВ критерием диагноза служит инструментально подтвержденное наличие тромботических масс в просвете глубоких вен у пациента из группы риска ВТЭО, направленного на исследование с целью скрининга.
2.2. Шкалы вероятности наличия ВТЭО
2.2.1. Вероятность наличия ТГВ: шкала Уэллса (Wells)
- Для оценки вероятности ТГВ нижних конечностей по клиническим данным у пациентов с подозрением на тромбоз рекомендуется использовать шкалу Уэллса (Wells) [99–102].
УДД 1 УУР C.
Комментарий: в клинической практике для оценки вероятности тромбоза глубоких вен (ТГВ) нижних конечностей используют шкалу Уэллса (Wells). Шкала Уэллса (Wells) включает ряд клинических признаков, каждому из которых присваивается один балл. Результаты оценивают по сумме набранных баллов, относящих больных к группам с низкой, средней и высокой вероятности ТГВ. Однако более широко в практике используют упрощенную оценку индекса Wells по вероятности (ТГВ вероятен, если оценка ≥ 2 либо ТГВ маловероятен, если оценка <2). Тем не менее, существуют ограничения в практическом применении шкалы Уэллса (Wells). Поскольку клинические данные не позволяют достоверно судить о наличии или отсутствии ТГВ, данная шкала не может использоваться в качестве самостоятельного теста для подтверждения или исключения ТГВ. Ее следует применять только в отношении пациентов, у которых заподозрен ТГВ, а последующий диагностический поиск должен включать лабораторные и инструментальные обследования. В сочетании с нормальным уровнем Д-димера и/или отрицательными результатами УЗИ глубоких вен нижних конечностей «низкая вероятность» по шкале Уэллса (Wells) может безопасно исключать наличие у пациента ТГВ. По данным мета-анализа, низкая вероятность по шкале Уэллса (Wells) совместно с отрицательным тестом на Д-димер позволяет исключить ТГВ у 29% пациентов без онкологического заболевания с вероятностью ложноотрицательного результата на уровне 1,2% (95% ДИ, 0,7-1,8%), и у 9% с онкологическим заболеванием с вероятностью ложно-отрицательного результата на уровне 2,2% (95% ДИ, 0,5-8,6%)[102]. Шкала Уэллса (Wells) представлена в приложении Г1.
2.2.2. Вероятность наличия ТЭЛА: шкала Уэллса (Wells)
- Для оценки вероятности ТЭЛА по клиническим данным у пациентов с подозрением на легочную эмболию рекомендуется использовать шкалу Уэллса (Wells) [103,104].
УДД 1 УУР А
Комментарий: для оценки вероятности ТЭЛА возможно использование шкалы Уэллса (Wells), которая включает ряд клинических признаков, каждому из которых присваивается от одного до трёх баллов. Результаты оценивают по сумме набранных баллов, относящих пациентов к группам с низкой, умеренной и высокой вероятностью наличия ТЭЛА. Возможно использование как оригинальной, так и упрощенной версии шкалы. Приложение Г2.
2.2.3. Вероятность наличия ТЭЛА: шкала Женева (Geneva)
- Для оценки вероятности ТЭЛА по клиническим данным у пациентов с подозрением на легочную эмболию рекомендуется использовать шкалу Женева (Geneva) [104,105].
УДД 1 УУР А
Комментарий: шкала Женева (Geneva) включает ряд клинических признаков, каждому из которых признаков присваивается определенное количество баллов. Результаты оценивают по сумме набранных баллов, относящих пациентов к группам с низкой, умеренной и высокой вероятностью наличия ТЭЛА. Аналогично шкале Уэллса (Wells) возможно использование как оригинальной, так и упрощенной версии шкалы. Приложение Г3.
2.3. Жалобы и анамнез
- Клиническая картина и степень выраженности симптомов зависит от объема поражения венозного русла. У части пациентов имеет место бессимптомное течение заболевания, венозный тромбоз выявляется случайно при скрининговом исследовании. Реже первыми признаками ТГВ служат проявления ТЭЛА. Типичными жалобами рекомендуется считать [1,85,106–112]:
- отек конечности
- цианоз кожного покрова пораженной конечности,
- усиление рисунка подкожных вен,
- боли распирающего характера в конечности или икроножных мышцах,
- снижение подвижности конечности за счет отека и болевого синдрома,
- болезненность по ходу сосудисто-нервного пучка.
УДД 1 УУР А
Комментарий: среди всех симптомов наибольшей диагностической ценностью в отношении подтверждения и исключения ТГВ обладают отек голени и разница в диаметре голеней [112].
- При подозрении на ТГВ рекомендуется проводить тщательный сбор анамнеза с уточнением [112,113]:
- ранее перенесенных эпизодов ВТЭО
- семейного анамнеза ВТЭО
- операций, травм и иммобилизаций в последние 3 месяца
- острого инфаркта миокарда или нарушения мозгового кровообращения в анамнезе, особенно развившихся в молодом возрасте, в т.ч. у родственников,
- наличия верифицированной тромбофилии, онкологического или системного заболевания
- приема противоопухолевых препаратов (АТХ группа: противоопухолевые препараты, L01, противоопухолевые гормональные препараты, L02) глюкокортикостероидов или половых стероидов
- акушерско-гинекологического анамнеза (невынашивания, прерывания беременности на ранних сроках).
УДД 1 УУР А
Комментарий: на основании данных мета-анализа, наличие или отсутствие таких факторов риска, как личный анамнез ВТЭО, онкологическое заболевание, недавняя иммобилизация или операция обладает большей положительной предсказательной ценностью в отношении диагностики ТГВ, чем наличие объективных симптомов [112].
2.4. Физикальное обследование
- При подозрении на ТГВ рекомендуется оценить наличие [111,112]:
- боли в конечности
- изменений цвета кожного покрова конечности (цианоз, гиперемия)
- отека конечности
- разницы периметра конечностей на симметричных участках
- болезненности при пальпации сосудисто-нервного пучка
УДД 1 УУР А
- При обследовании пациента с ТГВ рекомендуется целенаправленный поиск симптомов ТЭЛА, тщательный осмотр пациента и оценка состояния обеих нижних конечностей [111].
УДД 3 УУР C
2.5. Лабораторные диагностические исследования
- Не рекомендуется проведение лабораторных тестов для подтверждения диагноза ТГВ [114–117].
УДД 2 УУР А
Комментарий: маркёры тромбообразования (Д-димер, растворимые фибрин-мономерные комплексы, тромбин-антитромбиновый комплекс, фибринопептиды А и В) не позволяют в полной мере определить активность процесса и оценить вероятность наличия ТГВ. Определение уровня Д-димера с диагностической целью возможно при наличии клинических признаков ТГВ и невозможности выполнения УЗ-исследования. При нормальном значении диагноз ТГВ может быть исключен с высокой степенью вероятности, а при повышении показателя – необходимо направление пациента в другое учреждение для проведения УЗ-исследования [118,119].
- При низкой клинической вероятности ТГВ по шкале Уэллса (Wells) рекомендуется рассмотреть целесообразность определения концентрации Д-димера в крови (05.051.001) в качестве альтернативы УЗ-исследованию для исключения ТГВ[84,85,102].
УДД 1 УУР В
Комментарий: определение уровня Д-димера с диагностической целью возможно при наличии клинических признаков ТГВ. При нормальном значении диагноз ТГВ может быть исключен с высокой степенью вероятности, а при повышении показателя – необходимо направление пациента на УЗ-исследование [102].
- Рекомендуется контроль коагулограммы (ориентировочное исследование системы гемостаза) (B03.005.006) при использовании нефракционированного гепарина** (АТХ группа: Группа гепарина B01AB, гепарин натрия**) (АЧТВ), антагонистов витамина К (АВК) (АТХ B01AA - Антагонисты витамина K ) (МНО) [120–122].
УДД 5 УУР С
- Рекомендуется определение показателей крови (общий (клинический) анализ крови развернутый (B03.016.003), анализ крови биохимический общетерапевтический (B03.016.004)) расчет клиренса креатинина и их контроль в динамике при проведении антикоагулянтной терапии [122–125].
УДД 5 УУР С
- Рекомендуется при наличии технической возможности рассмотреть целесообразность измерения анти-Ха активности (B03.005.007 лабораторный контроль за терапией лекарственными препаратами (прямыми антикоагулянтами)) при использовании нефракционированного гепарина** и низкомолекулярных гепаринов (далтепарин натрия, АТХ: группа гепарина, B01AB04; надропарин кальция, АТХ: группа гепарина, B01AB06; эноксапарин натрия**, АТХ: группа гепарина, B01AB05; бемипарин натрия, АТХ: группа гепарина, B01AB12; парнапарин натрия**, АТХ: группа гепарина, B01AB07) с целью контроля за индивидуальным ответом на введение антикоагулянта [126–130].
УДД 2 УУР С
Комментарий: определение уровня анти-Ха активности на фоне введения профилактических доз НМГ (далтепарин натрия, АТХ: группа гепарина, B01AB04; надропарин кальция, АТХ: группа гепарина, B01AB06; эноксапарин натрия**, АТХ: группа гепарина, B01AB05; бемипарин натрия, АТХ: группа гепарина, B01AB12; парнапарин натрия**, АТХ: группа гепарина, B01AB07) обычно рекомендуется пациентам с чрезвычайно высоким риском ВТЭО, в частности при множественной травме. Проведенные мета-анализы демонстрируют, что недостижение целевого диапазона анти-Ха активности может повышать риск развития ВТЭО, но индивидуальный подбор дозы НМГ под контролем показателя не всегда ассоциируется со снижением тромботических рисков [127,131]. У пациентов с верифицированным ВТЭО коррекция дозы НМГ под контролем анти-Ха активности может быть целесообразна при беременности, при наличии очень низкой (<40 кг) или очень высокой (>144 кг) массы тела, при тяжелых нарушениях функции почек (КлКр от 15 до 30 мл/мин) [128]. Между тем, в рамках мета-анализа, выполненного Американским обществом гематологов при разработке соответствующих рекомендаций, не было выявлено достоверной пользы от индивидуального подбора дозы НМГ под контролем анти-Ха активности при ожирении и тяжелом нарушении функции почек [132].
2.6. Инструментальные диагностические исследования
- Для верификации ТГВ рекомендуется выполнить ультразвуковое исследование в виде дуплексного или триплексного сканирования нижней полой вены, подвздошных вен, вен верхних, вен нижних конечностей в зависимости от предполагаемой локализации тромбоза (12.015.001, A04.12.005.004, A04.12.006.002) [133–137].
УДД 1 УУР А
Комментарий: ультразвуковое исследование позволяет оценить состояние стенок и просвета вен, наличие в них тромботических масс, характер тромба (окклюзивный, пристеночный, флотирующий), его дистальную и проксимальную границы. Исследование может выполняться в В-режиме с компрессией сосуда датчиком (компрессионное ангиосканирование), а также в формате дуплексного или триплексного ангиосканирования). Термин «дуплексное сканирование вен нижних конечностей» обозначает ультразвуковое исследование вен нижних конечностей, проводимое с одновременным использованием двух режимов сканирования (это В-режим и цветовой или импульсно-волновой доплер), в то время как термин «триплексное сканирование вен нижних конечностей» обозначает сканирование с одновременным использованием трех режимов (это В-режим, цветовой и импульсноволновой доплер). Термины «дуплексное сканирование вен нижних конечностей» и «триплексное сканирование вен нижних конечностей» являются частными случаями, вариантами ультразвукового исследования вен нижних конечностей. Все термины, используемые для обозначения ультразвукового исследования вен нижних конечностей («ультразвуковое ангиосканирование», УЗАС; «ультразвуковое дуплексное сканирование», УЗДС; «ультразвуковое исследование вен нижних конечностей») подразумевают выполнение компрессионного ангиосканирования и дуплексного и/или триплексного сканирования.
Для проксимальной локализации тромба все три подхода обладают примерно одинаково высокой чувствительностью (94-96%) и специфичностью (94-98%)[137]. При дистальном тромбозе максимальную чувствительность демонстрирует ультразвуковое исследование с картированием кровотока (71-75%), в то время как чувствительность компрессионного ангиосканирования не превышает 57%. Наиболее высокую диагностическую ценность имеет исследование в -режиме с компрессией вен через каждые 2 см. При ультразвуковом исследовании обязательно точно следует указать проксимальную границу поражения и его характер. При наличии симптомов ТЭЛА и отрицательном результате УЗАС необходимо целесообразно осмотреть внутритазовые, гонадные, почечные и печеночные вен. Ультразвуковое исследование вен нижних конечностей для подтверждения диагноза и уточнения тактики лечения может выполнить любой специалист, занимающийся диагностикой и лечением заболеваний вен и имеющий практический опыт выполнения ультразвукового исследования.
- При выполнении ультразвукового исследования по поводу подозрения на тромбоз глубоких вен в бассейне нижней полой вены рекомендуется произвести дуплексное или триплексное сканирование поверхностных и глубоких вен обеих нижних конечностей [133–136].
УДД 3 УУР В
Комментарий. При подозрении на тромбоз илиокавального сегмента необходимо выполнить сканирование вен малого таза и нижней полой вены.
- Повторное дуплексное или триплексное сканирование вен конечностей рекомендуется проводить при наличии клинического подозрения на прогрессирование или рецидив ТГВ [85].
УДД 5 УУР С
Комментарий: на сегодняшний день отсутствуют сведения о том, что ультразвуковой мониторинг состояния проксимальной границы тромба влияет на эффективность лечения ТГВ и риск развития осложнений. Более того, до конца не описана ультразвуковая динамика естественного течения тромбоза в процессе его резолюции и реканализации сосуда, поэтому частое выполнение ультразвукового исследования может приводить к выявлению неожиданных находок (увеличение длины флотирующей верхушки в результате ретракции сгустка, появление факта флотации ранее фиксированного тромба), которые могут быть неверно трактованы в пользу неэффективности терапии антикоагулянтами и потребности в дополнительном вмешательстве. Эти вопросы обсуждают отдельно в разделе, посвященном рецидиву ТГВ.
- Рекомендуется рассмотреть целесообразность проведения дуплексного или триплексного сканирования вен нижних конечностей у пациентов высокого риска развития ВТЭО или больных онкологическими заболеваниями на 3-5 сутки после операции с целью раннего выявления ВТЭО [134].
УДД 5 УУР С
- У пациентов с ТГВ голени при невозможности антикоагулянтной терапии рекомендуется выполнить повторное дуплексное или триплексное сканирование вен нижних конечностей через 1 неделю или, при нарастании симптомов, ранее [134,138].
УДД 2 УУР С
Комментарий: проведенный систематический обзор различных подходов к диагностике и лечению дистального ТГВ демонстрирует, что риск его прогрессирования в проксимальном направлении составляет 0,9-5,7% при выполнении повторного УЗАС через 5-7 дней [138]. Таким образом, повторное обследование в указанный срок является целесообразным с целью исключения прогрессирования заболевания.
- При наличии высокой клинической вероятности ТГВ и/или повышенного уровня Д-димера и при отрицательных результатах первичного ультразвукового исследования рекомендуется повторить дуплексное или триплексное сканирование вен нижних конечностей через 7 дней [139].
УДД 1 УУР А
Комментарий: данная рекомендация является экстраполяцией тактики выполнения серийного УЗ-исследования с оценкой только проксимальных венозных сегментов при подозрении на ТГВ, которая характеризуется сопоставимой вероятностью получения ложно-отрицательного результата (1-2%) в сравнении с однократным осмотром проксимальных и дистальных вен [139]. В описанной ситуации отрицательный результат первичного исследования, вероятнее всего, связан с поражением вен голени. Выполнение повторного исследования через 1 неделю позволяет обнаружить проксимальный тромбоз в 1-6% случаев. При этом частота развития симптоматических ВТЭО в течение последующих 3 месяцев не превышает 2% среди больных с отрицательными результатами серии из двух ультразвуковых исследований [140,141].
- При выявлении илиокавального тромбоза и невозможности точного определения проксимальной границы тромба при ультразвуковом исследовании рекомендуется выполнение мультиспиральной компьютерной томографии с внутривенным болюсным усилением (компьютерно-томографическая ангиография сосудов нижних конечностей (A06.12.050), далее – КТ-венография) или магнитно-резонансной томографии нижней конечности с внутривенным контрастированием (магнитно-резонансная венография (A05.12.005), далее – МР-венография) [85,134].
УДД 5 УУР С
Комментарий: МСКТ с внутривенным усилением проводят дополнительно для верификации конкурирующих заболеваний. В ряде мета-анализов МР-венография обладает чувствительностью и специфичностью сравнительной с УЗ-исследованием [85,134].
- При планировании хирургической дезобструкции и/или имплантации кава-фильтра у пациентов с илиокавальным тромбозом рекомендуется выполнение флебографии нижней полой вены (A06.12.021) при невозможности выполнения КТ-венографии или МР-венографии (A06.12.021) [85].
УДД 5 УУР Сэ
Комментарий: в настоящее время не рекомендовано использование для рутинного выполнения с целью первичной верификации венозного тромбоза в связи с высокими дозами лучевой нагрузки и инвазивностью вмешательства [85].
2.7. Иные диагностические исследования
- Плетизмография не рекомендуется для рутинного применения для диагностики венозного тромбоза. Имеются данные о высокой информативности при подозрении на рецидив тромбоза [136,142].
УДД 3 УУР С
- Флебосцинтиграфия (A07.12.003) обладает меньшей чувствительностью по сравнению с триплексным сканированием нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное) (A04.12.015.001). Проведение исследование сопряжено с необходимостью специального оснащения клиники и дорогостоящим производством радиофармпрепарата. Для рутинного выполнения не рекомендуется [136].
УДД 3 УУР С
- Не рекомендуется проводить рутинную инструментальную диагностику ТЭЛА у пациентов с ТГВ при отсутствии симптомов легочной эмболии [85,143–146].
УДД 3 УУР С
Комментарий: частота выявления бессимптомной ТЭЛА при ТГВ варьирует от 13% при дистальной локализации тромбоза до 40-70% при проксимальном поражении [143,144,146,147]. Наличие бессимптомной ТЭЛА в момент диагностики ТГВ увеличивает вероятность симптоматического рецидива легочной эмболии в течение первых 2 недель терапии, но не оказывает влияния на 3-месячные исходы [143–146]. Между тем, современная антикоагулянтная терапия отличается высокой эффективностью и низким риском рецидива, как при ТГВ, так и при ТЭЛА [148], поэтому выявление бессимптомной легочной эмболии не должно оказывать влияния на тактику лечения. Следует иметь в виду, что наличие бессимптомной ТЭЛА может приводить к появлению легочных симптомов в течение первых недель лечения, что может восприниматься в качестве прогрессирования заболевания и обуславливать дополнительные нежелательные интервенции. К подобным клиническим симптомам следует относится настороженно, исходя из возможности наличия исходной субклинической легочной эмболии.
2.8. Шкалы риска развития/рецидива ВТЭО и геморрагических осложнений
В некоторых клинических ситуациях для оценки рисков развития/рецидива ВТЭО или геморрагических осложнений могут применяться различные инструменты (шкалы, предиктивные модели). В частности, для определения риска развития ВТЭО у госпитализированных нехирургических пациентов могут применяться шкалы Падуа (Padua) или IMPROVE VTE. Для оценки риска рецидива ВТЭО после завершения терапии антикоагулянтами могут применяться Венская предиктивная модель (Vienna prediction model), шкала DASH, HERDOO-2. Для оценки риска геморрагических осложнений на фоне антикоагулянтной терапии могут применяться шкалы HAS-BLED, VTE-BLEED, RIETE, шкала ACCP.
Выбор шкалы является прерогативой клинициста, оценивающего целесообразность проведения или продления антикоагулянтной терапии.
2.8.1. Шкалы риска развития/рецидива ВТЭО
2.8.1.1. Риск развития ВТЭО у госпитализированных нехирургических пациентов, шкала Падуа (Padua)
- Для оценки вероятности развития ВТЭО у госпитализированных нехирургических пациентов по клиническим данным рекомендуется использовать шкалу Падуа (Padua) или шкалу IMPROVE VTE [149–154].
УДД 2 УУР А
Комментарий: для оценки риска ТГВ и/или ТЭЛА у нехирургических больных в условиях стационара можно использовать прогностическую шкалу Padua, основанную на выявлении факторов риска венозного тромбоза и позволяющую разделить пациентов на группы низкого (≤ 4 баллов) и высокого риска (≥ 4 баллов) ВТЭО. При высоком риске ВТЭО (≥ 4 баллов по шкале Padua) у пациентов нехирургического профиля необходимо решить вопрос о возможной антикоагулянтной профилактике, но только после оценки риска кровотечения. Данная шкала была разработана на основе единственного когортного исследования, проведенного в Италии, и требует дополнительной валидации на других группах пациентов. Данная шкала представлена в приложении Г4. Шкала IMPROVE VTE (International Medical Prevention Registry on Venous Thromboembolism/Международный регистр медицинской профилактики венозных тромбоэмболических осложнений) используется для оценки риска ТГВ нижних конечностей и/или ТЭЛА у нехирургических больных в условиях стационара. Данная шкала учитывает факторы риска, возникающие у пациента до и во время пребывания в стационаре и наиболее сильно связанные с развитием ВТЭО факторы в течение первых трех месяцев после госпитализации. Пациенты с ≥ 2 баллами во время госпитализации относятся к группе повышенного риска ВТЭО и могут нуждаться в дополнительной профилактической антикоагулянтной терапии. По данным регистра пациенты с баллом ≥ 4 имели более высокую частоту симптоматического ВТЭО (5,7%) в течение 3 месяцев после выписки из стационара. Кроме того, оценка ≥ 2 была связана с более высоким уровнем общей и ассоциированной с ВТЭО смертности. Шкала IMPROVE VTE во время госпитализации может позволить выявить факторы, связанные с повышенным риском ВТЭО, однако необходимо подтверждать ее эффективность в будущих клинических исследованиях. В качестве модификации было предложено использование шкалы в комбинации с уровнем Д-димера [153]. Наличие 2-3 баллов по оригинальной шкале в комбинации с повышением уровня Д-димера в 2 раза и более выше верхней границы нормы позволяют отнести пациента к группе высокого риска, когда показана фармакологическая профилактика ВТЭО. Данная шкала представлена в приложении Г5.
2.8.1.2. Риск развития ВТЭО у госпитализированных хирургических пациентов, шкала Каприни (Caprini)
- Для стратификации риска ВТЭО у хирургических пациентов по группам риска развития рекомендуется использовать шкалу Каприни (Caprini) (Приложение Г6) [150,151,155].
УДД 2 УУР А
Комментарий: для стратификации риска ВТЭО у хирургических пациентов в рекомендациях Американской коллегии торакальных врачей (American College of Chest Physicians) в редакции 2012 г. была предложена шкала Каприни (Caprini) (Приложение Г6). На сегодняшний она является наиболее валидированной в мире моделью для индивидуального прогнозирования ВТЭО. Шкала была изучена у более, чем 5 миллионов пациентов хирургического и терапевтического профиля [155–158]. В 2014 году была опубликована русскоязычная версия шкалы, прошедшая проспективную валидацию у хирургических пациентов [159]. В зависимости от суммы баллов, полученных при сборе анамнеза и обследовании, пациента относят к группе c очень низким (0-1 балл), низким (2 балла), умеренным (3-4 балла) или высоким (5 и более баллов) риском ВТЭО. Вероятность развития ВТЭО при отсутствии профилактики в этих группах составляет менее 0,5, 1,5, 3 и 6%, соответственно. В отдельных исследованиях было продемонстрировано, что частота ВТЭО имеет тенденцию к дальнейшему повышению при баллах 8-10 и выше [160–163]. При наличии 11 и более баллов частота регистрации бессимптомных и симптоматических ВТЭО может достигать 50-60% [164,165] . В связи с отсутствием принципиальных различий в частоте ВТЭО и принципах лечения пациентов низкого и очень низкого рисков в клинической практике целесообразно объединить в одну группу низкой вероятности ВТЭО. Наряду со шкалой Каприни (Caprini) большое практическое значение имеет система оценки риска с использованием в качестве основных факторов объема, продолжительности оперативного лечения и возраста пациента.
- Для стратификации хирургических пациентов по группам риска развития ВТЭО рекомендуется рассмотреть использование пациент-ориентированного опросника на основе шкалы Каприни (Caprini) в качестве дополнения или альтернативы стандартной шкале, заполняемой врачом, в случае если последняя не может быть использована по объективным причинам (Приложение Г7) [166–169].
УДД 4 УУР С
Комментарий: пациент-ориентированный опросник на основе шкалы Каприни (Caprini) представляет собой набор вопросов в формулировках, понятных для пациента, которые отражают наличие основных факторов риска, используемых в оригинальной шкале. Англоязычная версия опросника была разработана и валидирована в 2017 году [167]. При разработке выяснилось, что пациенты испытывают определенные трудности с расчетом ИМТ, поэтому названный фактор риска был вынесен за пределы опросника и должен быть заполнен врачом. Позднее опросник был переведен на испанский, польский, арабский и китайский язык [166,168]. При конкурентной валидации была обнаружена высокая степень согласованности балла, полученного на основании анкетирования пациента и при заполнении стандартной шкалы врачом (каппа Коэна 0,76-0,93 в зависимости от языка). Русскоязычная версия опросника была опубликована и валидирована в 2022 году [169]. Была также выявлена высокая степень согласованности результатов (каппа Коэна – 0,84). Следует иметь в виду, что ни одна версия опросника не прошла проспективную валидацию с оценкой клинических исходов, поэтому самостоятельное применение в качестве альтернативы оригинальной шкале на сегодняшний день следует считать преждевременным.
2.8.1.3. Риск развития ВТЭО у амбулаторных пациентов, получающих противоопухолевое лечение, шкала Хорана (Khorana)
- Для стратификации риска ВТЭО у амбулаторных пациентов, получающих противоопухолевое лечение, рекомендуется использовать шкалу Хорана (Khorana) (Приложение Г8) [79,170–174].
УДД 1 УУР А
Комментарий: шкала Хорана (Khorana) – простая и эффективная модель прогнозирования вероятности развития ТГВ и ТЭЛА, ассоциированных с химиотерапией у амбулаторных больных со злокачественными новообразованиями с использованием исходных клинических и лабораторных признаков. Для улучшения показателей оценки шкалы Khorana ряд авторов предложил различные виды ее модификации путем добавления измерений биомаркеров (растворимого Р-селектина и Д-димера) – шкала Vienna CATS [79], типа химиотерапии – шкала PROTECHT [171] или замены индекса массы тела (ИМТ) на статус «эффективности» – шкала CONKO [172,173]. Статус «эффективности» по ВОЗ – количественная оценка общего самочувствия и повседневной активности больных с онкологическими заболеваниями. Вероятность развития тромбоза среди пациентов с низким риском (0 баллов) составляет 0.3–0.8%, с умеренным риском (1-2 балла) – 1.8–2%, а в группе высокого риска (3 балла) – 6.7–7%. Данная шкала может эффективно использоваться для своевременного выявления онкологических пациентов, получающих химиотерапию, с высоким риском ВТЭО и назначения фармакологической профилактики. По данным мета-анализа использование фармакологической профилактики на основании шкалы Khorana позволяет достоверно снизить риск развития ВТЭО (минус 60 эпизодов на 1000 пациентов) без увеличения угрозы кровотечения [174].
2.8.1.4. Риск рецидива ВТЭО после отмены АКТ: Венская предиктивная модель
- Для оценки риска рецидива клинически неспровоцированного ВТЭО после завершения терапии антикоагулянтами рекомендуется использовать Венскую предиктивную модель (Vienna prediction model) (Приложение Г9) [101,175,176].
УДД 3 УУР С
Комментарий: на сегодняшний день представлено несколько методов оценки риска рецидива ТГВ и ТЭЛА первого эпизода клинически неспровоцированного ВТЭО. Венская предиктивная модель (Vienna) разработана на базе проспективного когортного исследования и представлена в виде номограммы, с помощью которой можно рассчитать индивидуальный риск и кумулятивную вероятность рецидива ВТЭО в течение 12 и 60 месяцев. Номограмма Vienna оценивает риск рецидива ТГВ или ТЭЛА после перенесенного первичного ВТЭО на основе клинических (характер тромботического события и пол) и лабораторных данных (Д-димер, определяемый после прекращения антикоагулянтной терапии). Для оценки результатов должны быть построены перпендикулярные линии от каждого из параметров (пол, локализация тромба, уровень Д-димера) к верхнему ряду («Баллы») и определено количество баллов для каждого параметра. Затем по сумме полученных баллов всех трех параметров на линии «Сумма баллов» по перпендикуляру определяется кумулятивный риск рецидива тромбоза за 12 и 60 месяцев по нижним шкалам. Данная модель была подвергнута внутренней валидации (проверке правильности стратификации риска на той же популяции участников). Рассчитанный с помощью модели индивидуальный риск обладал высокой согласованностью с реальной частотой рецидива ВТЭО. Использование Венской предиктивной модели может улучшить прогнозирование рецидива ВТЭО у пациентов, перенесших первый эпизод неспровоцированных ТГВ или ТЭЛА и не имеющих тяжелых тромбофилий. Авторы предполагают, что пациентам с низким риском рецидива ВТЭО не требуется пролонгированная антикоагулянтная терапия. Однако для подтверждения выдвинутых тезисов шкала должна пройти внешнюю валидацию на других популяциях больных с перенесенным ВТЭО.
2.8.1.5. Риск рецидива ВТЭО после отмены АКТ: шкала DASH
- Для оценки риска рецидива неспровоцированного или спровоцированного приёмом половых стероидов ВТЭО после завершения терапии антикоагулянтами рекомендуется использовать шкалу DASH [101,176,177].
УДД 3 УУР В
Комментарий: итальянскими учеными была разработана балльная шкала DASH (D-dimer, Age, Sex, Hormones) для оценки вероятности рецидива ВТЭО на основе четырех индивидуальных данных пациентов: уровень Д-димера, возраст, пол и прием эстрогенов для женщин. Шкала DASH позволяет разделить риск рецидива ТГВ и/или ТЭЛА на низкий (≤1) и высокий (>1). Важным моментом является определение концентрации Д-димера в течение 3-5 недель после окончания антикоагулянтной терапии. При низком риске по шкале DASH (от 0 до 1 балла) ежегодная частота рецидива составляет 3,1%, тогда как при высоком (более 1 балла) – ежегодная частота повторного тромбоза увеличивается до 9%. Т.о., данный метод потенциально может быть полезен для принятия решения о продолжении или прекращении антикоагулянтной терапии у пациентов с впервые возникшим неспровоцированным и спровоцированным приемом половых стероидов эпизодом ВТЭО после трехмесячного курса антикоагулянтов. Пациенты с высоким риском по шкале DASH (≥ 2 баллов), вероятно, будут нуждаться в продлении антикоагулянтной терапии при отсутствии риска кровотечения. Шкала прошла внешнюю ретроспективную валидацию в рамках когортного исследования и подтвердила свою предсказательную ценность [178]. Приложение Г9.
2.8.1.6. Риск рецидива ВТЭО после отмены АКТ, шкала HERDOO-2
- Для оценки риска рецидива неспровоцированного ВТЭО после завершения терапии антикоагулянтами рекомендуется использовать шкалу HERDOO-2 [176,179,180].
УДД 3 УУР В
Комментарий: шкала (предиктивная модель, правило) HERDOO-2 разработана для оценки риска рецидива у пациентов с первым неспровоцированным ТГВ и/или ТЭЛА и для принятия решения об отмене или продлении антикоагулянтной терапии после основного курса лечения (3-6-12 месяцев). Оценивают совокупность индивидуальных (пол, возраст и вес) и лабораторных (уровень Д-димера до завершения антикоагулянтной терапии) данных, а также клинических проявлений посттромботической болезни (гиперпигментация, отек, покраснение). Каждой из четырех характеристик, кроме пола, присваивается по одному баллу. В соответствии с правилами данной шкалы, продленная терапия антикоагулянтами рекомендуется всем мужчинам и женщинам при наличии 2-х и более баллов. Для мужчин не было отмечено достоверного влияния каких-либо предикторов на величину риска рецидива, тогда как женщины с отсутствием или одним из критериев HERDOO-2 имели низкий ежегодный риск рецидива ВТЭО (1,6%), наличие двух факторов приводило к увеличению ежегодного риска рецидива до 14,1%. Предиктивная модель HERDOO-2 была валидирована в многоцентровом проспективном когортном исследовании [180] и может применяться для принятия решения о прекращении приема антикоагулянтов п, в особенности у женщин с первичным неспровоцированным ТГВ и/или ТЭЛА. Приложение Г9.
2.8.2. Шкалы риска геморрагических осложнений
Для оценки риска геморрагических осложнений на фоне антикоагулянтной терапии могут применяться шкалы HAS-BLED, VTE-BLEED, RIETE, шкала ACCP. Выбор шкалы является прерогативой клинициста, оценивающего целесообразность проведения или продления антикоагулянтной терапии.
2.8.2.1. Шкала HAS-BLED
- Для оценки риска геморрагических осложнений у пациентов с ВТЭО, получающих антикоагулянтную терапию, рекомендуется использовать шкалу HAS-BLED (Приложение Г10) [101,181–186].
УДД 1 УУР А
Комментарий: шкала HAS-BLED – это простой и надежный клинический инструмент для оценки индивидуального риска большого кровотечения в течение 1 года у пациентов с фибрилляцией предсердий, получающих оральные антикоагулянты (АТХ группа: антагонисты витамина К, B01AA; АТХ группа: прямые ингибиторы фактора Xa, B01AF; АТХ группа: ингибиторы тромбина прямые, B01AE). Шкала включает ряд признаков, каждому из которых присваивают один балл, результат оценивают по их сумме. Риск кровотечения считают высоким при наличии более трех баллов. Риск возрастает от 1,02% в год при одном балле до 12,5% при сумме баллов пять и более. Шкала обладает высокой предсказательной ценностью, была валидирована на различных независимых когортах и хорошо коррелирует с риском внутримозгового кровоизлияния. HAS-BLED может быть оптимальным выбором для оценки риска кровотечений в клинической практике не только у больных с фибрилляцией предсердий, но и при остром коронарном синдроме и кардиохирургических операциях. В нескольких когортных исследованиях шкалу HAS-BLED применяли для оценки риска кровотечений у пациентов с ВТЭО, принимающих антикоагулянты (АТХ группа: антитромботические средства, В01А), в том числе прямые оральные антикоагулянты ((ПОАК) (дабигатрана этексилат**, АТХ группа: ингибиторы тромбина прямые, B01AE07; апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03) [182,184–186]. В недавнем крупном когортном исследовании было показано, что HAS‐BLED имеет хорошую прогностическую значимость у пациентов с ВТЭО, где сумма HAS‐BLED ≥4 ассоциировалась с высоким риском больших кровотечений [182]. В то же время, в исследовании к группе высокого риска больших кровотечений относили пациентов с ВТЭО и суммой баллов ≥ 3 [183]. Результаты этих когортных исследований дают основание для оценки диапазона баллов HAS‐BLED и своевременной коррекции потенциально обратимых факторов риска больших кровотечений, таких как избыток алкоголя, прием нестероидных противовоспалительных препаратов (АТХ группа: нестероидные противовоспалительные и противоревматические препараты, М01А) или пероральных антитромбоцитарных препаратов (АТХ группа: антиагреганты кроме гепарина, В01АС), неконтролируемой артериальной гипертензии и тщательного мониторинга международного нормализованного соотношения у пациентов с острым ВТЭО с высоким баллом HAS-BLED.
2.8.2.2. Шкала VTE-BLEED
- Для оценки риска геморрагических осложнений у пациентов с ВТЭО, получающих антикоагулянтную терапию, рекомендуется использовать шкалу VTE-BLEED (Приложение Г10) [187–189].
УДД 3 УУР В
Комментарий: шкала VTE-BLED разработана для оценки риска кровотечений у пациентов с ТЭЛА на основе анализа результатов исследования RE-COVER и представлена в виде прогностических критериев, которым присваивается от 1 до 2 баллов. Высоким риск больших кровотечений считают при наличии 2 и более баллов. При меньших показателях, которые наблюдали у 74% пациентов в исследовании RE-COVER, риск кровотечений на фоне продленной антикоагулянтной терапии был минимальным (2,8%). Оценка VTE-BLED может быть полезна для принятия решения о возможном продлении антикоагулянтной терапии после первых 3-6 месяцев, при сопоставлении с индивидуальным риском ВТЭО.
2.8.2.3. Шкала RIETE
- Для оценки риска геморрагических осложнений у пациентов с ВТЭО, получающих антикоагулянтную терапию, рекомендуется использование шкалы RIETE (Приложение Г10) [190].
УДД 4 УУР С
Комментарий: шкала оценки риска кровотечений RIETE разработана на основе данных регистра пациентов с ВТЭО (Registry of Patients with Venous Thromboembolism) и может использоваться в клинической практике при необходимости назначения антикоагулянтной терапии. Риск большого кровотечения оценивают по шести переменным. При валидации шкалы RIETE частота больших кровотечений у пациентов с ВТЭО составила 0,1%, 2,8% и 6,2%, соответственно, в группах с низким (0 баллов), средним (1-3 балла) или высоким (>4 баллов) риском кровотечений в течение первых трех месяцев антикоагулянтной терапии.
2.8.2.4. Шкала ACCP
- Для прогнозирования риска кровотечений у пациентов с ВТЭО, принимающих оральные антикоагулянты, рекомендуется использование шкалы ACCP (Приложение Г10) [124,191].
УДД 3 УУР В
Комментарий: в рекомендациях Американской коллегии торакальных врачей в редакции 2012 г. была предложена модель прогнозирования риска больших кровотечений у пациентов с ВТЭО, принимающих оральные антикоагулянты (АТХ группа: антагонисты витамина К, B01AA; АТХ группа: прямые ингибиторы фактора Xa, B01AF; АТХ группа: ингибиторы тромбина прямые, B01AE). Данная модель включает достаточно широкий спектр факторов, отсутствие которых относит пациентов к низкому риску, наличие одного – к умеренному, а двух и более факторов – к высокому риску крупных кровотечений. Базовый годовой риск представлен в приложении Г.12. Следует отметить, что оценка риска кровотечений по ACCP была разработана путем анализа исследований, основанных только на использовании антагонистов витамина К, поэтому применять данную шкалу у пациентов с ВТЭО при длительном лечении ПОАК следует с осторожностью не является целесообразным. В рамках регистрового исследования START2 было показано, что риск больших кровотечений в реальной клинической практике на фоне применения АВК и ПОАК оказывается намного ниже прогностических значений по шкале: 1,7% в год для группы высокого риска и 1,3% в год для группы умеренного и низкого риска) [191].
2.9. Исследования на врожденные и приобретенные тромбофилии
2.9.1. Общая информация о тромбофилиях
Вероятность венозного тромбоза увеличивается, если у больного имеется наследственная или приобретенная тромбофилия. Термин «наследственная» тромбофилия чаще всего применяют, когда генетическая мутация влияет на количество или функцию белка в системе коагуляции и приводит к повышенной свёртываемости крови. Сегодня к общепринятым наследственным тромбофилическим маркерам, по которым рекомендуется проводить типирование, относят лишь дефицит естественных антикоагулянтов (антитромбина III, протеинов C и S) и мутации в генах факторов V по типу Лейден (FVL) и протромбина (FII) по типу замены G20210A, к приобретенным – антифосфолипидный синдром (антифосфолипидные антитела: волчаночный антикоагулянт, анти-b2-гликопротеин I и антикардиолипиновые IgG и IgM антитела).
Условно наследственные тромбофилии можно классифицировать, как тромбофилии с потерей функции естественных антикоагулянтов (т. е. дефицит антитромбина, протеинов С и S); или с усилением функций, связанных с мутациями в белках коагуляционной системы (т. е. мутации в генах фактора V Leiden и протромбина G20210A). Однако существует большое количество верифицированных на сегодняшний день наследственных и приобретенных состояний, также ассоциированных с риском ВТЭО (таблица 3). В недавнем крупном метаанализе данных полногеномного поиска ассоциаций (Genome-Wide Association Study, GWAS) по ВТЭО было идентифицировано 34 локуса, ассоциированных с тромбообразованием, связанных не только с системой коагуляции и фибринолиза, но также с тромбоцитами, эритроцитами и воспалением [192,193]. Тем не менее, венозные тромбозы чаще обусловлены мутациями в генах, кодирующих компоненты системы коагуляции и ее регуляции. К наиболее значимым приобретенным гиперкоагуляционным состояниям, приводящим к ВТЭО, помимо антифосфолипидного синдрома, относят приобретенный дефицит ингибиторов коагуляции (например, печеночная недостаточность, нефротический синдром и лечение L-аспарагиназой), миелопролиферативные расстройства и прочие факторы, представленные в таблице 3.
Таблица 3. Основные наследственные и приобретенные тромбофилии [85].
|
Наследственные тромбофилии |
|
Дефицит антитромбина III |
|
Дефицит протеина С |
|
Дефицит протеина S |
|
Фактор V Лейден |
|
Резистентность к активированному протеину С (без мутации в гене FV Leiden) |
|
Протромбин G20210A |
|
Дисфибриногенемия |
|
Фактор XIII 34val |
|
Фибриноген (G) С10034T |
|
А и/или B аллели групп крови ABO (не-0 группа крови) |
|
Протромбин Yukuhashi (II R596L) |
|
Приобретенные тромбофилии |
|
Антифосфолипидные антитела: антикардиолипиновые антитела (IgG и IgM) и/или волчаночный антикоагулянт и/или антитела к b2-гликопротеину I, определяемые в двух или более случаях исследования с интервалом не менее 12 недель |
|
Пароксизмальная ночная гемоглобинурия |
|
Миелопролиферативные синдромы с мутацией JAK2V617F |
|
Другие причины, ассоциированные с гиперкоагуляцией |
|
Гемолитические состояния, например, серповидноклеточные кризы |
|
Любые воспалительные заболевания (пневмония, ревматоидный артрит, воспалительные заболевания кишечника, системная красная волчанка, болезнь Бехчета, COVID-19). |
|
Нефротический синдром (определение антитромбина в моче) |
2.9.2. Распространенность тромбофилий и риск ВТЭО
Распространенность основных наследственных и приобретенных тромбофилий и относительный риск развития ВТЭО представлены в таблице 4.
Таблица 4. Распространенность наследственных и приобретенных тромбофилий и относительный риск развития ВТЭО [85].
|
Дефицит/мутация тромбофилии |
Распространенность в общей популяции, % |
Распространенность у пациентов с ВТЭО, % |
Относительный риск первого ВТЭО, по сравнению с контролем |
|
Дефицит антитромбина III (гетерозигота) |
0,02 |
1 |
10–30 |
|
Дефицит протеина С (гетерозигота) |
0,2–0,5 |
1–3 |
10 |
|
Дефицит протеина С (гомозигота) |
|
|
Очень высокий риск |
|
Дефицит протеина S (гетерозигота) |
0,1–0,7 |
1–2 |
8 |
|
Дефицит протеина S (гомозигота) |
|
|
Очень высокий риск |
|
FVL (гетерозигота) |
2–15 |
10–20 |
3–7 |
|
FVL (гомозигота) |
0,06–0,25 |
– |
80 |
|
FII G20210G/A (гетерозигота) |
1–2 |
3–5 |
3–7 |
|
FII G20210A/A (гомозигота) |
Редко |
Редко |
10–20 |
|
Комбинация гетерозигот по FVL и FII G20210A или другому генетическому фактору риска (≥2 дефектов) |
Редко |
Редко |
10–20 |
|
FVIII > 150% |
11 |
25 |
2 |
|
АФС |
2 |
4–15 |
7–10 |
|
Миелопролиферативные синдромы с мутацией JAK2 |
0,1–0,2 |
3,2 (тромбозы вен внутренних органов) |
2–3 |
|
Дисфибриногенемия |
Редко |
Редко |
5–7 |
|
Пароксизмальная ночная гемоглобинурия |
1–9/100 000 |
Редко |
3–5 |
В настоящее время обоснованно считают, что клинические факторы играют более важную роль в определении риска как заболевания, так и его рецидива. Семейный анамнез и подтвержденный перенесенный эпизод ВТЭО, а также наличие более одного родственника первой степени с ВТЭО позволяют обоснованно предполагать наличие у пациента наследственной тромбофилии. Есть еще целый ряд ситуаций, в которых можно предполагать, что у пациента имеется тромбофилия (таблица 5)[194].
Таблица 5. Клинические ситуации, которые могут указывать на наличие наследственной тромбофилии [194].
|
Первый эпизод неспровоцированного ВТЭО в молодом возрасте (до 45 лет) Рецидив ВТЭО Тромбоз «необычной» локализации ВТЭО (церебральные синусы, брыжеечные, печеночные вены и т.д.) ВТЭО во время беременности и в послеродовом периоде ВТЭО, связанный с использованием эстроген-содержащих оральных контрацептивов или заместительной гормональной терапии (ЗГТ) Первый эпизод ВТЭО в любом возрасте у пациента с семейным анамнезом ВТЭО у родственников 1-й степени родства с дебютом заболевания до 50 лет Варфарин-индуцированный некроз кожи Клинически неспровоцированный эпизод ВТЭО |
Отсутствие известных на сегодняшний день маркеров наследственной тромбофилии у пациентов с семейным анамнезом по ВТЭО при проведении тестирования не исключает генетического дефекта.
2.9.3. Наиболее значимые тромбофилические состояния
2.9.3.1. Наследственный дефицит естественных антикоагулянтов (антитромбина III, протеин C, протеин S)
Дефицит естественных антикоагулянтов (антитромбина III, протеинов C и S) наследуется по аутосомно-доминантному типу и составляет 10–15% семейных тромбофилий. Однако такие аномалии встречаются редко в общей популяции, и по разным оценкам их распространенность составляет примерно один случай на 5000 человек. Из-за своей генетической гетерогенности диагностика дефицита естественных антикоагулянтов осуществляется с помощью антигенных или функциональных анализов. Дефицит может быть 1-го типа, когда происходит одномоментное снижение биохимической активности и концентрации антигена в плазме, либо 2-го типа при функциональном дефекте, когда биохимическая активность снижается, несмотря на нормальную концентрацию антигена.
Антитромбин III является основным ингибитором тромбина. Связывание его с гепарином или гепарансульфатом резко усиливает ингибирующую активность. Гетерозиготное носительство дефицита антитромбина довольно редко встречается в общей популяции (~ 0,02%) и связано примерно с 5–20-кратным увеличением риска ВТЭО. При этом тромбоз, как правило, развивается в раннем возрасте. К настоящему времени идентифицировано более 250 различных мутаций в гене антитромбина. Большинство из них являются миссенс-мутациями, т.е. приводят к замене в аминокислотной последовательности белка и дефициту этого естественного антикоагулянта. До сих пор в литературе не было описано ни одного случая гомозиготного носительства дефицита антитромбина. За исключением мутаций, влияющих на сайт связывания гепарина, гомозиготный дефицит антитромбина считается несовместимым с жизнью.
Протеин С – это витамин К-зависимая протеазе, синтезируемая в печени, которая при активации тромбином оказывает антикоагулянтное действие путем протеолитической деградации активированных факторов V и VIII, участвующих в генерации тромбина. Важным неэнзиматическим кофактором этих реакций служит протеин S. Известно более 150 различных миссенс мутаций этого гена, приводящих к феномену дефицита протеина С. Установлено, что гомозиготное носительство дефицита протеина С приводит к массивным тромбозам микроциркуляторного русла, вызывающим фульминантные некрозы кожи у новорожденных. Таким образом, гомозиготные носители мутаций в гене протеина С часто погибают в неонатальном периоде. Гетерозиготное носительство дефицита протеина С наблюдается в популяции с частотой в среднем 0,2–0,5% и ассоциировано с 8-10-кратным риском развития ВТЭО. Пациенты с дефицитом протеина С подвергаются повышенному риску некроза кожи во время начала терапии антагонистом витамина К ((варфарина**, АТХ группа: антагонисты витамина К, B01AA03)) (известным также как варфарин-индуцированный некроз кожи).
Протеин S – витамина К - зависимая протеаза. Помимо участия в качестве неферментативного кофактора в процессе АПС-опосредованной протеолитической деградации активных форм факторов V и VIII, протеин S обладает самостоятельной антикоагулянтной функцией за счет его прямого взаимодействия с факторами Va и Xa. В нормальных физиологических условиях около 60% от всего количества протеина S в плазме находится в связанной форме, однако антикоагулянтными свойствами обладает лишь несвязанная форма протеина S («свободный протеин S»). Снижение концентрации свободного протеина S ассоциировано с повышением риска ВТЭО примерно в 2-10 раз и повышением риска варфарин-индуцированного некроза кожи.
2.9.3.2. Вариант гена фактора V Лейден G1691A
Фактор V (FV), или лабильный фактор, является гликопротеином плазмы крови. В отличие от большинства факторов свертывания крови FV не имеет ферментативной активности. Активированная форма фактора V (FVа) выступает в качестве кофактора для преобразования протромбина в тромбин активированным фактором Х. Активация FV осуществляется тромбином и FXa в присутствии ионов Са2+, а его инактивация происходит под действием активированного протеина С (АПС). Лейденская мутация (полиморфизм) в гене фактора V (FVL) представляет собой однонуклеотидный полиморфизм (Single Nucleotide Polymorphism, SNP) в гене фактора V и заключается в замене гуанина на аденин в позиции 1691 (G1691A), что приводит к замене аргинина на глутамин в позиции 506 (Arg506Gln) аминокислотной последовательности белка. Эта аминокислотная замена не позволяет АПС распознать место расщепления на факторе V, что приводит к устойчивости к антикоагулянтному действию АПС. Мутация фактора V Лейден является наиболее распространенной причиной резистентности к активированному протеину С. Этот вариант чаще встречается у белого населения, чем у других этнических групп, таких как азиаты или африканцы. Частота AПC-резистентности достаточно высока как у пациентов с ВТЭО (20–60%), так и в группе здорового населения (5–10%) [195]. Гетерозиготы по варианту FVL имеют состояние гиперкоагуляции, связанное примерно с 5-кратным увеличением риска венозного тромбоза. Еще более высоким риском развития ВТЭО (по разным данным, 20–80-кратным) характеризуются гомозиготные носители данной мутации.
2.9.3.3. Вариант гена протромбина G20210A
Активированный фермент тромбин играет важную роль в механизмах гемостаза и тромбоза: он преобразует фибриноген в фибрин с дальнейшим образованием кровяного сгустка, стимулирует агрегацию тромбоцитов и активирует факторы свертывания V, VII, VIII, XI и XIII. Мутация (полиморфизм) гена протромбина G20210A характеризуется заменой нуклеотида гуанин (G) на аденин (A) в позиции 20210 и, таким образом, не изменяет структуру молекулы протромбина. Однако мутация связана с увеличением уровня протромбина в плазме, который может быть в 1,5–2,0 раза выше, чем в норме, или его активности примерно на 30%. Это связано примерно с 3-4-кратным увеличением риска развития венозного тромбоза. Мутация G20210A в гене протромбина выявляется у 2–4% здоровых людей и у 6–8% больных с венозным тромбозом [196]. Гетерозиготное носительство варианта FII G20210A ассоциировано с повышенным риском развития «изолированной» ТЭЛА, т.е. при отсутствии клинико-инструментальных признаков ТГВ, а также с риском рецидива ВТЭО. Кроме того, сочетанное наследование мутаций в генах факторов II и V имеет синергичный эффект в отношении манифестации ВТЭО и приводит почти к пятикратному увеличению риска рецидива заболевания [197].
2.9.3.4. Другие наследственные ассоциации
Помимо классических наследственных тромбофилий, существует большое количество протромбогенных вариантов генов, кодирующих компоненты коагуляционной системы, отдельное носительство которых слабо связано с риском ВТЭО. Однако их сочетанное наследование способствует синергичному эффекту и манифестации заболевания при воздействии внешнего провоцирующего фактора. В связи с тем, что сегодня известны далеко не все варианты генетической предрасположенности к ВТЭО, объективно оценить частоту встречаемости «мультигенной» формы тромбофилии пока не представляется возможным.
К таким генетическим факторам риска относят дисфибриногенемию, повышение уровня факторов I, VIII, IX, XI, TAFI, PAI-1, низкий уровень TFPI, изменения функциональности из-за полиморфизма FXIII или эндотелиального рецептора протеина С (EPCR) и другие [198]. Дисфибриногенемии чрезвычайно редко встречаются в популяции и могут вызывать кровотечения и тромботические эпизоды иногда у одного и того же пациента. В последнее время разрабатываются множественные генетические модели риска тромбоза, которые включают от 5 до 15 основных генов, задействованных в риске ВТЭО [199]. Также у пациентов с первой группой крови риск возникновения ВТЭО гораздо ниже, чем у пациентов с со второй и третьей группами крови. Гиперкоагуляционный статус у пациентов с ненулевыми группами крови вызван носительством полиморфизма гена ABO rs8176719. Аллель insG, характерный для фенотипа ненулевых группы крови, приводит к увеличению риска развития ВТЭО в 1.5 раза, предположительно, из-за 25% повышения уровней факторов VIII и фактора Виллебранда (von Willebrand, vWF).
2.9.3.5. Антифосфолипидный синдром
Антифосфолипидный синдром (АФС) – симптомокомплекс, включающий рецидивирующие тромбозы (артериальные и/или венозные) и акушерскую патологию (чаще синдром потери плода), связанные с синтезом антифосфолипидных антител: антикардиолипиновых антител и/или волчаночного антикоагулянта, и/или антител к b2-гликопротеину I (анти-b2-ГП I). АФС относится к приобретенным тромбофилиям и может быть причиной не только ВТЭО, но и инсульта в молодом возрасте, тромботического инфаркта миокарда и плацентарной недостаточности. Для лабораторного подтверждения диагноза АФС необходимо исследовать три показателя (волчаночный антикоагулянт; антикардиолипиновые антитела; и анти-бета-2 гликопротеина I), каждый из которых может выявляться самостоятельно либо в комбинации с другим показателем. Тест необходимо повторить через 12 недель, поскольку могут возникать транзиторные антитела. АФС диагностируют при наличии одного клинического и одного серологического критерия. Риск развития тромботических осложнений классифицируют, как высокий при обнаружении: только волчаночного антикоагулянта; положительных всех трёх типов антифосфолипидных антител; либо изолированного постоянного повышения антикардиолипиновых антител до высокого и среднего уровней; низким риск тромбоза считают при изолированном периодическом повышении каждого из антифосфолипидных антител.
Катастрофический АФС – наиболее тяжелая быстро развивающаяся форма антифосфолипидного синдрома с формированием множественных микротромбозов микроциркуляторного русла жизненно важных органов и развитием полиорганной недостаточности на фоне высокого титра антифосфолипидных антител. Это жизнеугрожающее состояние с 50%-м уровнем смертности [200,201].
2.9.3.6. Пароксизмальная ночная гемоглобинурия
Пароксизмальная ночная гемоглобинурия (ПНГ) является редким приобретенным клональным гематологическим заболеванием, вызванным соматической мутацией гена фосфатидилинозитол гликана класса А (PIG-A) в стволовых кроветворных клетках. ПНГ характеризуется хроническим внутрисосудистым гемолизом, костномозговой недостаточностью, тромбозами, нарушением функции почек и другими тяжелыми клиническими синдромами. Действие комплемента на поверхности кроветворных клеток, включая тромбоциты и лейкоциты, индуцирует повышенный риск тромботических событий. Пациентам с ПНГ и венозными тромбозами в анамнезе, помимо традиционной поддерживающей терапии (моноклональное антитело к компоненту комплемента С5 – экулизумаб** (АТХ группа селективные иммунодепрессанты, L04AA)), показано назначение антикоагулянтной терапии на неопределенный срок [126,194,202,203].
2.9.4. В каких случаях выполнять тестирование на тромбофилии
- Пациентам со спровоцированным ТГВ и/или ТЭЛА тестирование на маркеры наследственной и/или приобретенной тромбофилии не рекомендуется [84,85,194].
УДД 5 УРР C
Комментарий: патогенез венозного тромбоза является сложным многофакторным процессом, основанным на взаимодействии генетических и эпигенетических факторов с факторами внешней среды (хирургия, травма, беременность, иммобилизация, острая медицинская болезнь, рак и т. д.) и индивидуальными особенностями образа жизни индивида (ожирение, курение, стресс, малоподвижный образ жизни и т. д.), наличие тромбофилического дефекта может быть лишь одним из многих компонентов, определяющих риск первичного венозного тромбоза или его рецидива. ТГВ, спровоцированный большим транзиторным фактором риска, характеризуется минимальной вероятностью рецидива после завершения терапии антикоагулянтами вне зависимости от наличия или отсутствия наследственной тромбофилии [204]. Вклад большого провоцирующего фактора в генез первичного тромбоза превышает возможный вклад генетических дефектов, наличие которых не должно оказывать влияние на характер и длительность терапии антикоагулянтами. Вероятность рецидива ТГВ, спровоцированного малым транзиторным фактором риска, оценивается на уровне 4% в год (умеренный риск) [204]. В подобных ситуациях комбинация внешнего фактора и наследственной предрасположенности может иметь решающее значение для развития первичного тромботического события, но оказывает минимальное влияние на риск рецидива [194].
- Тестирование на тромбофилии рекомендуется рассматривать в следующих ситуациях [194,205]:
- у молодых пациентов (в возрасте до 40-45 лет) с первым неспровоцированным ВТЭО. Однако отрицательные тесты на типичные тромбофилии не исключают наличия еще не идентифицированных маркеров тромбофилии либо полигенного наследования и не должны быть показанием для прекращения антикоагулянтной терапии после трех – шести месяцев лечения. В то же время, выявление тяжелой тромбофилии может являться дополнительным аргументом в пользу длительной антикоагулянтной терапии с периодической оценкой риска/пользы рецидива и кровотечения
- у пациентов с неспровоцированными тромбозами нетипичной локализации (например, в церебральных венах) с семейным анамнезом ВТЭО в первой линии родства
- у женщин с ВТЭО и с неблагоприятным акушерским анамнезом (повторяющиеся выкидыши, внутриутробная гибель плода, преэклампсия и другие поздние акушерские заболевания, вызванные ишемией плаценты) тестирование на антифосфолипидные антитела является обязательным. Ранняя диагностика АФС и своевременное назначение профилактической антикоагулянтной терапии может способствовать предотвращению акушерской заболеваемости.
УДД 5 УРР C
У пациентов с подтвержденной тромбофилией риск рецидива ВТЭО варьирует в зависимости от типа тромбофилии и увеличивается при их сочетанном наследовании. Наблюдательные исследования показывают, что антикоагулянты (АТХ группа: антитромботические средства, В01А) одинаково эффективны у пациентов с тромбофилией и без нее. Однако риск рецидива ВТЭО после прекращения антикоагулянтной терапии может быть выше у пациентов с разными типами тромбофилии. Так риск рецидива значительно выше у пациентов с тяжелой формой наследственной тромбофилии (при дефиците естественных антикоагулянтов, при гомозиготных или комбинированном гетерозиготных вариантах по FVL и FII G20210A, а также у пациентов с АФС) [194,206]. Тем не менее, эксперты ACCP относят тромбофилии к факторам, которые «могут предсказать риск рецидива, но не являются достаточным обоснованием для длительной антикоагулянтной терапии» [194,207].
Из-за отсутствия рандомизированных клинических исследований рекомендации по особенностям ведения пациентов с тромбофилией и ВТЭО основаны на доказательствах невысокого уровня. Наличие тромбофилии лишь один из многих факторов риска, поэтому польза от тестирования для обоснования решений о тактике лечения не доказана. При субанализе крупного популяционно-генетического исследования MEGA факт выполнения тестирования на наследственную тромбофилию не оказал влияния на риск рецидива ВТЭО [207].
- Пациентам с клинически неспровоцированным ТГВ и/или ТЭЛА рутинное тестирование на маркеры наследственной и/или приобретенной тромбофилии проводить не рекомендуется [194,208,209].
УДД 5 УРР C
- Для пациентов с неспровоцированным (идиопатическим) ТГВ и/или ТЭЛА и семейным анамнезом ВТЭО (родственники первой линии родства) рекомендуется рассмотреть целесообразность тестирования на маркеры наследственной и/или приобретенной тромбофилии [194,210].
УДД 5 УРР С
- Для молодых пациентов с клинически неспровоцированным ТГВ рекомендуется тестирование на антифосфолипидные антитела (определение содержания антител к фосфолипидам в крови (A12.06.030)), если предполагается решать вопрос о прекращении антикоагулянтной терапии [194,210,211].
УДД 2 УРР А
2.9.5. Когда (по срокам) выполнять тестирование на тромбофилии
- Не рекомендуется выполнять тестирование на наследственные тромбофилии в период острого тромбоза или в течение 3-месячного периода антикоагулянтной терапии [194,200].
УДД 5 УРР C
2.10. Онкопоиск
- Для пациентов с клинически неспровоцированным ТГВ и/или ТЭЛА рекомендуется клиническое обследование и скрининг на онкозаболевания с учетом пола, в отличие от расширенного скрининга на скрытые злокачественные новообразования [212–219].
УДД 1 УРР A
Комментарий: онкологические заболевания являются одним из ведущих факторов риска ТГВ и ТЭЛА. Пациенты с онкологической патологией подвергаются большему риску ВТЭО, по сравнению с общей популяцией (5–20%) [213,217,220]. Риск развития ВТЭО, кровотечения и ранней смертности среди пациентов, получающих системную противоопухолевую терапию, варьирует в зависимости от типа рака, метода лечения, а также от индивидуальных для пациента факторов. Риск ВТЭО особенно высок среди определенных онкологических подгрупп, нуждающихся в госпитализации для оперативного, медикаментозного либо для иных видов лечения. К другим факторам, связанным с повышенным риском ВТЭО, относят пожилой возраст, мужской пол, тип и стадию онкологического заболевания. Самую высокую частоту ВТЭО отмечают при раке поджелудочной железы, почек, яичников, легких и желудка. Венозные тромбозы могут быть первым признаком недиагностированного рака. У пациентов с неспровоцированным ВТЭО без злокачественных новообразований в анамнезе на догоспитальном этапе в 4–12% случаев выявляют рак различной локализации во время последующего лечения. ВТЭО у онкологических пациентов может препятствовать проведению химиотерапии, ухудшить качество жизни, увеличивать риск рецидива рака и ранней смертности [217]. Существует две стратегии скрининга: расширенный онкопоиск и ограниченный. В разных исследованиях к ограниченному скринингу относили анамнез, основные анализы крови, органоспецифические тесты (половые онкомаркеры, рентген органов грудной клетки и прочие). К расширенной диагностике относят комплекс лабораторно-инструментальных исследований, включающий ректальное обследование, анализ кала на скрытую кровь, МСКТ грудной летки или позитронно-эмиссионную томографию, а также маммографию и МСКТ брюшной полости у женщин и прочие [213]. Однако такая стратегия сопряжена с риском ложноположительных результатов, дополнительным облучением и реакцией на контрастные препараты (АТХ группа: контрастные средства, V08A), а также существенными финансовыми затратами. В то же время сравнительные исследования не показали клинически значимого преимущества расширенной стратегии скрининга, по сравнению с ограниченной. При расширенном онкопоиске у пациентов с ВТЭО частота верифицированных онкологических заболеваний оказалась выше, чем при ограниченном скрининге (7,5% против 6,1%; относительный риск [ОР] 1,22; 95% ДИ 0,90 – 1,65), однако достоверного снижения смертности ни от рака, ни от других причин в разных исследованиях не наблюдали [213,217]. Jara-Palomares L. et al. предложили прогностическую модель оценки риска скрытого рака у пациентов с ВТЭО, включенных в регистр RIETE [214]. В модель включили клинические и лабораторные признаки, независимо ассоциированные с онкологией: мужской пол, возраст> 70 лет, хронические заболевания легких, анемия, предшествующее ВТЭО, недавняя операция. Доля пациентов с онкологией, набравших ≤ 2 баллов, составила 5,8%, а ≥ 3 баллов – 12%. Пациентам с высокой суммой баллов рекомендован дальнейший развернутый диагностический поиск онкологических заболеваний. Тем не менее, данная шкала показала слабую прогностическую эффективность в ряде клинических исследованиях [214]. Аналогичным образом Кокрейновский обзор показал, что в настоящее время нет достаточных доказательств эффективности расширенного онкопоиска в снижении заболеваемости раком или ВТЭО-ассоциированной смертностью у пациентов с первым эпизодом неспровоцированного ВТЭО [212–217].
2.11. Диагностика тромбоза глубоких вен в системе верхней полой вены
- У пациентов, имеющих нижеперечисленные жалобы, рекомендуется заподозрить тромбоз глубоких вен верхних конечностей:
- отек всей конечности или ее части
- цианоз кожного покрова пораженной конечности
- усиление рисунка подкожных вен
- боли и быстрая утомляемость конечности
- снижение подвижности конечности за счет отека и болевого синдрома
- болезненность по ходу сосудисто-нервного пучка
- парастезии [221–225].
УДД 2 УУР В
Комментарий: в некоторых случаях тромбоз в системе верхней полой вены может быть бессимптомным [226]. Клинические признаки могут быть специфичны в 30-64%.
Первичный ТГВ верхних конечностей может развиться спонтанно или в результате анатомических особенностей (синдром верхней апертуры (грудного выхода), синдром Педжета-Шреттера, добавочное шейное ребро, экзостозы, перелом ключицы, синдром лестничной мышцы) [227,228]. Вторичный ТГВ верхних конечностей обусловлен наличием центрального или периферического венозного катетера или порт-системы (особенно при использовании катетеров из полиэтилена или покрытые тефлоном), онкологического заболевания (паранеопластический синдром, рак Панкоста, новообразования средостения). Реже причиной являются коагулопатии или генетические мутации (FVL или FII G20210A), а также состояние после имплантации кардиостимулятора [227–230].
- С целью диагностики ТГВ верхней конечности рекомендуется дуплексное сканирование вен верхних конечностей (A04.12.005.004) [227,228,231].
УДД 2 УУР А
Комментарий: компрессионная проба позволяет установить проходимость венозного сегмента, в тех зонах, где это невозможно наличие венозного тромбоза подтверждают с использованием различных методов определения кровотока (доплеровское цветовое кодирование, импульсно-волновой, постоянно-волновой или энергетический допплер). По данным систематического обзора, ультразвуковое исследование в В-режиме, в режиме картирования кровотока и картирования кровотока с компрессионными пробами при верификации ТГВ верхних конечностей обладает чувствительность и специфичностью на уровне 97% и 96%, 84% и 94%, 91% и 93% соответственно [232].
- Антеградная флебография (флебография верхней конечности прямая (A06.12.036) рекомендуется в случае трудности диагностики сегментарного тромбоза с локализацией в проксимальных отделах. Данное вмешательство целесообразно при планировании лечебного этапа (тромболизис, стентирование) [227,228].
УДД 5 УУР С
- Компьютерная (компьютерно-томографическая ангиография сосудов верхних конечностей (A06.12.054) или магнитно-резонансная томография (магнитно-резонансная венография (A05.12.005)) рекомендованы для диагностики ТГВ верхних конечностей при наличии центральной обструкции и диагностики заболеваний, ставших причиной заболевания [227,228].
УДД 5 УУР С
2.12. Верификация ТЭЛА
2.12.1. Жалобы и клиническая картина ТЭЛА
- Диагностическую тактику ТЭЛА рекомендовано основывать на оценке клинической вероятности соответственно клиническим данным и прогностическим шкалам [105,233–238].
УДД 1 УУР А
Комментарий: симптомы ТЭЛА неспецифичны. Наиболее часто ТЭЛА подозревают при наличии у пациента одышки, боли за грудиной, предсинкопального состояния или обморока, кровохарканья, нестабильности гемодинамики. В ряде случаев ТЭЛА может быть бессимптомной. У пациентов с подозрением на ТЭЛА ее вероятность оценивают при помощи валидированных модифицированного индекса Женева (Geneva) и индекса Уэллса (Wells). Соответствие всем критериям позволяет исключить тромбоэмболию легочной артерии у лиц с ее низкой вероятностью.
- У пациентов с ТГВ при отсутствии клинических признаков ТЭЛА рутинное обследование с целью верификации ТЭЛА не рекомендуется [146].
УДД 3 УУР С
2.12.2. Лабораторные диагностические исследования при подозрении на ТЭЛА
- У пациентов с отсутствием клинических и инструментальных признаков ТГВ, при подозрении на ТЭЛА (низкой или промежуточной вероятностью) рекомендуется определение концентрации Д-димера в крови (A09.05.051.001), что поможет избавиться от дополнительных визуализирующих методов исключения ТЭЛА [234,237,239–243].
УДД 2 УУР А
Комментарий: отрицательная прогностическая ценность определения уровня Д-димера высока. Положительная же прогностическая ценность повышенного уровня Д-димера крайне низкая, определение уровня Д-димера для верификации ТЭЛА может быть бесполезно.
- У пациентов с высокой вероятностью ТЭЛА определение концентрации Д-димера в крови (A09.05.051.001) не рекомендуется [244–246].
УДД 3 УУР C
2.12.3. Инструментальная диагностика ТЭЛА
- Рекомендуется выполнение компьютерной томографии легких с контрастным усилением (спиральная компьютерная томография легких (A06.09.008.001) или КТ-ангиографии (компьютерно-томографическая ангиография легочных сосудов (A06.12.057)) для визуализации легочного русла у пациентов с подозрением на ТЭЛА [247–250].
УДД 1 УРР А
- Рекомендуется выполнение ангиопульмонографии (ангиография легочной артерии поперечно-грудная (A06.12.011) для верификации ТЭЛА [251–253].
УДД 3 УРР В
Комментарий: ангиопульмонография имеет аналогичную диагностическую ценность, что и КТ-ангиопульмонография, но сопровождается рядом осложнений. В настоящее время ангиопульмонографию выполняют реже, но она рекомендована при проведении эндоваскулярной реперфузии легочных артерий.
- Не рекомендуется выполнение перфузионной сцинтиграфии (сцинтиграфия легких перфузионная легких (A07.09.003)) с целью исключения ТЭЛА [240,250,254–256].
УДД 1 УРР А
Комментарий: перфузионная сцинтиграфия легких не исключает ТЭЛА, т.к. она имеет меньшую чувствительность, чем КТ-ангиопульмонография. Тем не менее, с учетом низкой лучевой нагрузки и отсутствием необходимости использования контрастных веществ рекомендовано у амбулаторных пациентов с низкой вероятностью ТЭЛА, при этом отрицательный результат исключает ТЭЛА.
- У пациентов с высокой вероятностью ТЭЛА и нестабильной гемодинамикой рекомендуется экстренное выполнение эхокардиографии (A04.10.002) (ЭХО-КГ) при невозможности экстренного выполнения КТ-ангиопульмонографии [257].
УДД 4 УРР С
Комментарий: эхокардиография позволяет выявить перегрузку давлением правого желудочка и его дисфункцию. Отсутствие легочной гипертензии и дисфункции правого желудочка не исключают ТЭЛА. Эхокардиография позволяет оценить клиническую значимость верифицированной ТЭЛА. При выявлении ТЭЛА при КТ-ангиопульмонографии результат ЭХО-КГ помогает получить информацию, влияющую на дальнейшую тактику лечения. Поэтому, при отсутствии возможности выполнения КТ-ангиопульмонографии или сцинтиграфии, рекомендовано ЭХО-КГ что позволяет исключить массивную ТЭЛА с нарушением гемодинамики.
2.12.4. Иные диагностические исследования при ТЭЛА
- Не рекомендуется выполнение рентгенографии легких (A06.09.007) с целью верификации ТЭЛА [258].
УДД 3 УУР В
Комментарий: изменения при рентгенологическом исследовании являются неспецифичными. Рентгенография легких позволяет исключить другие причины симптомов ТЭЛА.
- Не рекомендуется выполнение электрокардиографического исследования (регистрация электрокардиограммы (A05.10.006) для верификации ТЭЛА [259].
УДД 1 УУР А
Комментарий: электрокардиографическое исследование позволяет выявить нагрузку на правый желудочек в тяжелых случаях ТЭЛА, но не саму ТЭЛА. При этом отмечаются инверсия зубцов Т в отведениях V1-V4, QR-паттерн в отведении V1.
- Не рекомендуется выполнение магнитно-резонансной томографии легких (A05.09.001) для верификации ТЭЛА [260,261].
УДД 2 УУР А
Комментарий: магнитно-резонансная томография не может использоваться для верификации ТЭЛА ввиду ее низкой чувствительности.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Общие положения и тактика лечения ТГВ
Основными задачами при лечении ТГВ является предотвращение прогрессирования тромботического процесса и развития симптоматической, включая фатальную, ТЭЛА в остром периоде заболевания, а также снижение риска развития ПТБ и рецидива ВТЭО в отдаленном периоде. Базовыми методами лечения ТГВ являются антикоагулянтная терапия и эластичная компрессия. Дополнительно могут быть использованы хирургические методы дезобструкции венозного русла.
3.1.1. Показания к госпитализации
- Рекомендуется госпитализация пациентов с ТГВ, имеющих высокий риск развития осложнений и/или показания к хирургическому вмешательству для лечения ТГВ [85,262].
УДД 4 УУР С
Комментарий: состояния, исключенные из РКИ по амбулаторному лечению ТГВ, и которые клиницист может рассматривать как дополнительные факторы риска амбулаторного лечения ТГВ: рецидив ТГВ, наличие или высокая вероятность развития ТЭЛА, беременность, наличие противопоказаний к введению антикоагулянтов, сопутствующие заболевания, являющиеся показанием к госпитализации сами по себе, низкая доступность медицинской помощи (невозможность динамического наблюдения и экстренной госпитализации в случае возникновения осложнений), социальные факторы, затрудняющие амбулаторное лечение (например, одинокое проживание, отсутствие семейной поддержки, вероятная низкая комплаентность и пр.) [85]. Существуют специальные шкалы для оценки риска развития осложнений при амбулаторном лечении ТГВ (Приложение Г11) [262].
- Рекомендуется лечение в амбулаторных условиях для пациентов с низким риском осложнений и отсутствием необходимости в хирургическом лечении ТГВ [85,263].
УДД 1 УУР А
Комментарий: ранние РКИ по сравнению амбулаторного лечения с помощью НМГ и стационарного лечения с помощью НФГ** (АТХ группа: Группа гепарина B01AB, гепарин натрия**) с последующим переходом на АВК (АТХ B01AA - Антагонисты витамина K) продемонстрировали снижение риска рецидива ВТЭО на 48% при отсутствии влияния на риск больших и малых кровотечений или общую летальность при амбулаторном использовании НМГ [263]. Подобный подход был признан эффективным и безопасным, а также способным дополнительно улучшить качество жизни больных. Полученные результаты РКИ были подтверждены данными реальной клинической практики: по сведениям регистра RIETE 90-дневная частота развития ТЭЛА при амбулаторном лечении ТГВ составляет 0,83%, а больших кровотечений – 0,88% [264]. Более поздние исследования показали возможность применения ПОАК в амбулаторных условиях для лечения ТГВ и ТЭЛА [265,266].
3.1.2. Выбор стратегии: ранняя дезобструкция (раннее удаление тромбов) или консервативная терапия
Консервативное лечение, включающее адекватный режим антикоагулянтной терапии и эластичную компрессию, является базовым для пациентов с ТГВ. Стратегия ранней хирургической дезобструкции может быть использована у отдельных пациентов с целью быстрого купирования симптомов при протяженном ТГВ и снижения риска развития посттромботической болезни (ПТБ) в отдаленном периоде. Ранняя хирургическая дезобструкция не должна рассматриваться в качестве альтернативы стандартной антикоагулянтной терапии или в качестве метода профилактики ТЭЛА.
- Пациентам с подвздошно-бедренным ТГВ и давностью симптомов до 28 дней (в зависимости от метода пособия) рекомендуется выполнение ранней хирургической дезобструкции с целью снижения риска развития ПТБ в отдаленном периоде [85,267–270].
УДД 1 УУР А
Комментарий: в рамках последнего мета-анализа, объединяющего результаты применения системного, локального и регионарного тромболизиса при ТГВ было показано, что стратегия ранней дезобструкция ассоциируется со снижением риска формирования ПТБ на 22% через 5 лет и на 44% при длительности наблюдения более 5 лет ценой увеличения риска развития геморрагических осложнений в 2,5 раза [267]. При анализе исследований, включавших катетер-управляемый (локальный) тромболизис, механическую и фармако-механическую дезобструкцию отмечено снижение риска формирования любой формы ПТБ на 33-35% и тяжелой формы ПТБ на 34-41% ценой увеличения риска развития больших кровотечений в 2,4-5,7 раз [85,268]. Среди возможных предикторов эффективности катетер-управляемого тромболизиса максимальную предсказательную ценность демонстрирует давность симптомов ТГВ не более 14 дней, увеличивая шанс на благоприятный исход вмешательства в 2,8 раз [269]. С учетом наличия взаимосвязи между техническим успехом дезобструкции и тяжестью последующей ПТБ [271] целесообразно выполнять раннюю хирургическую дезобструкцию на базе клинических центров, имеющих достаточный опыт ее проведения, а также дополнять вмешательство венозным стентированием при обнаружении признаков резидуальной обструкции [272,273].
- Пациентам с бедренно-подколенным ТГВ не рекомендуется выполнение хирургической дезобструкции в связи с отсутствием влияния на риск развития ПТБ [85,267,274,275].
УДД 2 УРР А
Комментарий: в рамках мета-анализа, объединяющего результаты применения системного, локального и регионарного тромболизиса при ТГВ не выявлено различий по эффективности вмешательства между подколенно-бедренным и подвздошно-бедренным тромбозом [267]. Между тем в рамках крупного исследования ATTRACT выполнение хирургической дезобструкции ассоциировалось со снижением риска развития среднетяжелых форм ПТБ только в подгруппе пациентов с подвздошно-бедренным ТГВ [274], но не среди больных с подколенно-бедренным ТГВ [275].
- Пациентам с ТГВ в случае выполнения ранней хирургической дезобструкции в сочетании с имплантацией венозного стента или без него рекомендуется проводить антикоагулянтную терапию в стандартном режиме, определяемом характеристиками первичного эпизода тромбоза [85].
УДД 5 УРР С
Комментарий: на сегодняшний день отсутствуют исследования по сравнению режимов антикоагулянтной терапии после ранней дезобструкции венозного русла. При выполнении венозного стентирования описаны разнообразные схемы использования антитромботических препаратов без достоверного влияния на исходы [276]. По данным одного регистрового исследования длительность терапии антикоагулянтами не влияет на проходимость вен после хирургической дезобструкции со стентированием [277].
3.2. Медикаментозная (антикоагулянтная) терапия
3.2.1. Цели медикаментозной (антикоагулянтной) терапии
Основными целями антикоагулянтной терапии ТГВ являются остановка процесса патологического тромбообразования, что ассоциируется со снижением риска прогрессирования и раннего рецидива венозного тромбоза, риска развития ТЭЛА, в том числе фатальной, а также создание благоприятных условий для реализации эндогенных возможностей по восстановлению проходимости сосуда (плазминовый лизис, фиброз, контракция и ретракция, неоангиогенез), что ассоциируется со снижением вероятности развития ПТБ. При этом важно сохранение возможности физиологического тромбообразования с целью остановки кровотечения. Следует иметь в виду, что современные антикоагулянты напрямую не влияют на процесс реканализации сосуда, поэтому оценка эффективности лечения не должна строиться на изменении характеристик тромба (проксимальная граница, протяженность, флотация, эхогенность и пр.), полученных при инструментальных методах исследования.
3.2.2. Фазы антикоагулянтной терапии
Фазы антикоагулянтной терапии выделяют, основываясь на риске прогрессирования и рецидива ТГВ в разные временные промежутки.
- У пациента с ТГВ с целью систематизации АКТ рекомендуется выделять три фазы: 1. начальная фаза/терапия (до 21 дня от начала лечения); 2. основная фаза/терапия (до 3-6 месяцев от начала лечения в зависимости от клинической ситуации); 3. продленная фаза/терапия или вторичная профилактика (после окончания основной фазы, т.е., спустя 6 мес от начала лечения) [92].
УДД 5 УРР С
Комментарий: фазы антикоагулянтной терапии следует отсчитывать от момента начала лечения (введение первой дозы препарата), но не от момента появления первых симптомов или верификации диагноза. Фазы антикоагулянтной терапии в большей степени коррелируют с риском прогрессирования тромбоза и в меньшей степени с морфологическими изменениями в тромбе, хронология которых у человека изучена недостаточно. Известно, что риск прогрессирования тромбоза максимален в течение первой недели заболевания (29 случаев на 100 пациенто-лет), сохраняется высоким в течение первого месяца заболевания (19 случаев на 100 пациенто-лет) и снижается на втором (5 случаев на 100 пациенто-лет) и третьем (2 случая на 100 пациенто-лет) месяце заболевания [278]. Также известно, что в течение первой недели заболевания тромб у человека содержит преимущественно эритроциты и тромбоциты, которые к 7-й неделе замещаются фибрином, нейтрофилами и макрофагами, а к 54-й неделе – коллагеном, макрофагами, фибробластами и гладкомышечными клетками [27]. Таким образом, первая неделя заболевания несет в себе не только максимальную угрозу прогрессирования тромботического процесса, но и предоставляет широкие возможности по восстановлению проходимости сосуда.
3.2.3. Тактика лечения и длительность антикоагулянтной терапии
3.2.3.1. Общие положения, по индивидуальной оценке, баланса между риском рецидива ВТЭО и риском кровотечения.
Длительность антикоагулянтной терапии следует определять на основании расчета индивидуального баланса пользы (снижение вероятности рецидива ВТЭО) и риска (повышение вероятности больших, в особенности фатальных, геморрагических осложнений) продолжения терапии антикоагулянтами. Продленная терапия должна использоваться в тех случаях, когда индивидуальная польза достоверно превышает риск.
- При проведении антикоагулянтной терапии у пациента с ТГВ по завершении минимально необходимого 3-месячного курса лечения рекомендуется осуществлять регулярную, каждые 6-12 месяцев, оценку пользы и риска от продолжающегося лечения [84,85,279].
УДД 5 УРР С
3.2.3.2. Оценка риска рецидива ВТЭО после завершения антикоагулянтной терапии
Вероятность рецидива ВТЭО после завершения терапии антикоагулянтами определяется тем, что спровоцировало ТГВ, а также наличием у пациента дополнительных факторов риска. Относительный риск рецидива ВТЭО в зависимости от различных дополнительных факторов представлен в таблице 6. На сегодняшний день принято выделять тромбозы, спровоцированные большим транзиторным фактором риска, спровоцированные малым транзиторным фактором риска; спровоцированные малым персистирующим фактором риска, персистирующим фактором риска, неспровоцированные тромбозы [83]. Комбинации различных факторов риска рецидива ВТЭО входят в состав различных прогностических моделей: HERDOO-2 [180], Vienna, DASH [177] (Приложение Г9).
Таблица 6. Влияние различных факторов риска на вероятность рецидива ВТЭО после завершения терапии антикоагулянтами [280].
|
Фактор риска |
Относительный риск рецидива ВТЭО |
|
Большой транзиторный фактор / неспровоцированный эпизод |
0,2 |
|
Малый транзиторный фактор / неспровоцированный эпизод |
0,5 |
|
Онко-ассоциированный тромбоз / неспровоцированный эпизод |
1,5-3,0 |
|
Малый персистирующий фактор/ неспровоцированный эпизод |
1,5-2,0 |
|
Дистальный ТГВ / проксимальный ТГВ |
0,2-0,5 |
|
Проксимальный ТГВ / изолированная ТЭЛА без проксимального ТГВ |
1,4 |
|
Личный анамнез ВТЭО /отсутствие анамнеза |
1,5 |
|
Мужской пол / женский пол (неспровоцированное ВТЭО) |
1,75 |
|
Повышенный уровень Д-димер (неспровоцированное ВТЭО) / нормальный уровень Д-димера |
1,5-2,5 |
|
АФС/ его отсутствие |
1,5-3,0 |
|
Наследственная тромбофилия |
1,2-2,0 |
|
Азиатская раса / белые и чернокожие |
0,8 |
|
Резидуальная венозная обструкция (РВО)/реканализация |
1,4 |
- Индивидуальную оценку риска рецидива ВТЭО у пациента с ТГВ после завершения терапии антикоагулянтами рекомендуется проводить на основании оценки клинической провокации первичного эпизода ТГВ [65,84,85,89,279,280].
УДД 1 УРР А
Комментарий: по данным мета-анализа, тромбоз, спровоцированный большим транзиторным фактором риска, характеризуется минимальной вероятностью рецидива после завершения антикоагулянтной терапии (<1% в год); тромбоз, спровоцированный малым транзиторным фактором риска, характеризуется умеренной вероятностью рецидива после завершения антикоагулянтной терапии (4,2% в год); неспровоцированный тромбоз характеризуется высокой вероятностью рецидива после завершения антикоагулянтной терапии (7,4% в год) [89]. По данным другого мета-анализа, риск рецидива ВТЭО после завершения антикоагулянтной терапии при неспровоцированном ТГВ достигает 10,3% в год в течение первого года наблюдения, 6,3% в год в течение второго года наблюдения, 3,8% в год в течение 3-5 лет наблюдения и 3,1% в год в течение 6-10 лет наблюдения [65]. В рамках объединенного анализа исследований, изучавших эффективность и безопасность применения ПОАК в составе продленной терапии ВТЭО, было показано, что риск рецидива после завершения терапии первичного эпизода, спровоцированного малым персистирующим фактором, не отличается от такового при неспровоцированном тромбозе, и достигает 10,7% в год [87]. Риск рецидива ВТЭО при онкоассоциированном тромбозе может достигать 20% в год, вне зависимости от того продлена или завершена антикоагулянтная терапия [281].
- При оценке риска рецидива ВТЭО после завершения терапии антикоагулянтами у пациента с клинически неспровоцированным ТГВ рекомендуется учитывать уровень Д-димера [85,282].
УДД 2 УРР В
Комментарий: ассоциация между уровнем Д-димера и вероятностью рецидива была изучена только для первичных эпизодов клинически неспровоцированного ВТЭО. По данным мета-анализа повышение Д-димера, зарегистрированное в момент завершения или в любой срок после завершения антикоагулянтной терапии клинически неспровоцированного ВТЭО, ассоциируется с увеличением риска рецидива в 2,6 (95% ДИ, 1,9-3,5) раз [282]. В то же время нормальные значения показателя не гарантируют низкий риск рецидива ВТЭО. По данным одного когортного исследования частота рецидива у пациентов с клинически неспровоцированным ВТЭО, которые завершили терапию антикоагулянтами при условии негативного Д-димера, зарегистрированного в момент и через 1 месяц после прекращения лечения, достигала 6,7% в год [283]. Таким образом, уровень Д-димера имеет высокую положительную предсказательную способность (повышенный уровень ассоциируется с увеличенным риском рецидива), но низкую отрицательную предсказательную способность (нормальный уровень не всегда ассоциируется с низким риском рецидива). Определение Д-димера целесообразно для индивидуальной оценки риска рецидива ВТЭО при решении вопроса о завершении терапии антикоагулянтами. Показатель может измеряться как до прекращения лечения, так и через 1-3-6-9-12 мес. после его завершения. Повышенный уровень Д-димера, в особенности при серийном измерении, является дополнительным аргументом в пользу продолжения или возобновления лечения. Измерение уровня Д-димера нецелесообразно в том случае, когда польза продленной терапии объективно превышает риски на основании клинической оценки факторов риска. Показатель входит в состав всех известных шкал для индивидуальной оценки риска рецидива ВТЭО.
- При оценке риска рецидива ВТЭО после завершения терапии антикоагулянтами у пациента с клинически неспровоцированным ТГВ рекомендуется учитывать наличие резидуальной венозной обструкции (РВО) [284].
УДД 2 УРР В
Комментарий: ассоциация между наличием РВО и вероятностью рецидива была изучена только для первичных эпизодов неспровоцированного ВТЭО. Было предложено считать неполностью реканализированными такие вены, толщина стенки которых при максимальной компрессии УЗ-датчиком превышает 2,0 мм при однократном измерении или 3,0 мм при двух последовательных измерениях [285], толщина стенки которых при максимальной компрессии УЗ-датчиком превышает 4,0 мм [286], резидуальные тромботические массы, которые занимают 40% и более от поперечного диаметра сосуда [287], резидуальные тромботические массы, которые занимают 20% и более от поперечного диаметра сосуда [288]. По данным мета-анализа наличие резидуальной венозной обструкции, выявленной через 3 месяца от начала терапии антикоагулянтами, повышает риск рецидива ВТЭО после завершения терапии в 2,2 (95% ДИ, 1,1-4,3) раза [284]. Названный эффект теряет свою достоверность, если РВО оценивается через 3-6 месяцев (ОР, 1,5; 95% ДИ, 1,0-2,2) и спустя более 6 месяцев (ОР, 1,2; 95% ДИ, 0,9-1,6). Следует отметить, что данные характеризуются высокой гетерогенностью вследствие отсутствия общепринятых критериев для диагностики РВО. В исследовании DACUS наличие РВО, определяемой, как тромботические массы, занимающие более 40% от поперечного диаметра сосуда, повышало риск рецидива ВТЭО в 25 раз [287].
- При оценке риска рецидива ВТЭО после завершения терапии антикоагулянтами у пациента с ТГВ рекомендуется учитывать наличие дополнительных индивидуальных факторов риска рецидива [84,85,280].
УДД 5 УУР С
Комментарий: к дополнительным факторам риска рецидива ВТЭО после завершения терапии антикоагулянтами следует относить: мужской пол, проксимальную локализацию ТГВ, наличие ТЭЛА в комбинации с ТГВ, антифосфолипидный синдром, активный рак, ожирение, хроническую сердечную недостаточность, хроническую болезнь почек, хроническую обструктивную болезнь легких [85,280,289,290]. Часть из перечисленных факторов позволяют отнести первичный тромбоз в категорию, спровоцированного малым персистирующим фактором риска.
- При оценке риска рецидива ВТЭО после завершения терапии антикоагулянтами у пациента с ТГВ не рекомендуется учитывать наличие наследственной тромбофилии [194,289,291–293].
УДД 2 УУР В
Комментарий: наследственная тромбофилия существенным образом увеличивает риск развития первичного эпизода ВТЭО, в особенности на фоне гормональной контрацепции и во время беременности [194,294,295]. По данным систематических обзоров и мета-анализов вероятность повторного тромбоза у носителей наследственной тромбофилии увеличена в 1,5-2,0 раза, что соответствует таковой у носителей не-0-группы крови и требует реализации сходных подходов [194,293,296]. Следует иметь в виду, что наиболее важным фактором, определяющим риск рецидива ВТЭО вне зависимости от наличия известной наследственной тромбофилии, служит то, является эпизод спровоцированным или нет.
- При оценке риска рецидива ВТЭО после завершения терапии антикоагулянтами у пациента с неспровоцированным ТГВ рекомендуется использовать шкалы HERDOO-2, Vienna, DASH (Приложение Г9) [85,176].
УДД 2 УУР В
Комментарий: подробно предложенные шкалы представлены в разделе «2.8. Шкалы риска развития/рецидива ВТЭО и геморрагических осложнений», пункты 2.8.1.5 – 2.8.1.7. Все предложенные модели были разработаны для оценки риска рецидива после завершения антикоагулянтной терапии неспровоцированного эпизода ВТЭО. В то же время между исследованиями имеются разногласия по оценке тромбозов, спровоцированных оральными контрацептивами и беременностью. Так, при создании модели Vienna названные тромбозы не включали в исследование, при разработке модели HERDOO-2 эпизоды, ассоциированные с оральными контрацептивами, считали неспровоцированными и включали, а шкала DASH содержит упоминание тромбозов, спровоцированных приемом оральными контрацептивов, но исключает осложнения беременности. Все шкалы прошли внешнюю ретроспективную (Vienna) [297] и (DASH) [178] или проспективную (HERDOO-2) [180]) валидацию и продемонстрировали умеренную предсказательную ценность. Среди работ наибольшей методологической силой обладает исследование RIVERSE II, подтвердившее валидность применения шкалы HERDOO-2. Риск рецидива ВТЭО после завершения терапии в группе высокого риска (мужчины и женщины с наличием ≥2 баллов) составил 8,1% в год против 3,0% в год в группе низкого риска (женщины ≤1 балла) [180].
3.2.3.3. Оценка риска геморрагических осложнений при продолжении антикоагулянтной терапии
Геморрагические осложнения возникают вследствие угнетения физиологического тромбообразования и являются типичным осложнением терапии антикоагулянтами. Наибольшее значение имеют большие кровотечения, которые включают в себя фатальные случаи. Именно их следует принимать в расчет при оценке пользы и риска продленной терапии антикоагулянтами. Небольшие, но клинически значимые кровотечения (НКЗК), как правило, не несут непосредственной угрозы жизни, но могут вызывать долгосрочные последствия (анемия), снижать качество жизни (повторные обращения за медицинской помощью) и влиять на приверженность лечению. При оценке риска продленной терапии антикоагулянтами вклад НКЗК следует оценивать индивидуально на основании частоты их возникновения, влияния на качество жизни больного и наличия долгосрочных последствий. В большинстве случаев такие кровотечения связаны с контролируемыми факторами риска, которые необходимо выявлять и корригировать.
Индивидуальный риск кровотечения определяется наличием сопутствующих заболеваний и приемом других лекарственных средств, в особенности дезагрегантов (АТХ группа: антиагреганты кроме гепарина, В01АС) и нестероидных противовоспалительных препаратов (АТХ группа: нестероидные противовоспалительные и противоревматические препараты, М01А). Для его оценки было предложено несколько шкал, среди которых при ВТЭО чаще всего используются ACCP [279], VTE-BLED [188], RIETE [190], HAS-BLED [181]. (Приложение Г10).
- Рекомендуется учитывать индивидуальный риск развития больших кровотечений у пациентов с ТГВ, получающих продленную терапию антикоагулянтами [85,279].
УДД 5 УУР С
- При оценке индивидуального риска развития больших кровотечений у пациентов с ТГВ, получающих продленную терапию антикоагулянтами, рекомендуется использовать шкалы ACCP, VTE-BLED, RIETE, HAS-BLED [279,298,299].
УДД 1 УУР С
Комментарий: на сегодняшний день ни одна из названных шкал не прошла валидацию в рамках специально спланированных исследований. Все они использовались в работах, основной целью которых была оценка эффективности и безопасности применения отдельных антикоагулянтов, в большинстве случаев, АВК (АТХ B01AA - Антагонисты витамина K). При этом наиболее изученной в разных клинических ситуациях считается шкала VTE-BLED [298]. Следует иметь в виду, что риск больших кровотечений был рассчитан преимущественно при использовании АВК. Согласно шкале АССР частота больших кровотечений при низком, умеренном и высоком риске составляет 1,6%, 3,2% и 12,8% в год в течение первых 3 мес. терапии и 0,8%, 1,6% и ≥6,5% в год спустя 3 мес. и более [279]. Между тем при анализе данных реальной клинической практики частота больших кровотечений в группе низкого и умеренного риска по АССР составила 1,3% в год, а в группе высокого риска – 1,7% в год. При этом в течение первых 3 мес. лечения не было отмечено существенных различий между ПОАК и АВК (3,3% в год и 2,9% в год), но при продленной терапии ПОАК оказались безопаснее АВК (0,5% в год против 1,4% в год) [191].
- У пациента с ТГВ, получающего продленную терапию антикоагулянтами, рекомендуется своевременно выявлять и корригировать факторы риска кровотечения [300,301].
УДД 5 УУР С
3.2.3.4. Градация степени тяжести геморрагических осложнений
На сегодняшний день все геморрагические осложнения, возникающие на фоне лечебных или профилактических доз антикоагулянтов, принято разделять на большие кровотечения, небольшие, но клинически значимые кровотечения и малые кровотечения. Также принято выделять отдельно кровотечения, связанные с хирургическим вмешательством.
Под большим кровотечением, не связанным с хирургическим вмешательством, понимают фатальное кровотечение; и/или симптоматическое кровотечение в критическую анатомическую область или орган (внутричерепное, интраспинальное, внутриглазное, ретроперитонеальное, внутрисуставное, перикардиальное, внутримышечное с развитием компартмент-синдрома); и/или кровотечение, ассоциированное с падением уровня гемоглобина на 20 г/л и более или с потребностью в трансфузии 2 и более доз эритроцит-содержащих сред [302].
Под большим кровотечением, связанным с хирургическим вмешательством, понимают фатальное кровотечение; и/или симптоматическое кровотечение в критическую анатомическую область или орган (внутричерепное, интраспинальное, внутриглазное, ретроперитонеальное, внутрисуставное, перикардиальное, внутримышечное с развитием компартмент-синдрома); и/или кровотечение вне зоны хирургического вмешательства, ассоциированное с падением уровня гемоглобина на 20 г/л и более или с потребностью в трансфузии 2 и более доз эритроцит-содержащих сред в течение 24-48 часов от момента манифестации; и/или кровотечение в зоне хирургического вмешательства, требующее повторной открытой, эндоскопической или эндоваскулярной интервенции, или гемартроз достаточного объема, чтобы повлиять на процесс мобилизации и реабилитации, или задерживающее заживление раны, что ассоциируется с удлинением времени пребывания в стационаре или развитием глубокой хирургической инфекции; и/или кровотечение в зоне хирургического вмешательства, которое возникает неожиданно и длится долго или приводит к развитию гемодинамической нестабильности (по оценке хирурга), а также ассоциируется с падением уровня гемоглобина на 20 г/л и более или с потребностью в трансфузии 2 и более доз эритроцит-содержащих сред в течение 24 часов от момента манифестации [303].
Под небольшим, но клинически значимым кровотечением (НКЗК) понимают кровотечение, не подпадающее под критерии большого, но требующее медицинского вмешательства, и/или госпитализации или увеличения уровня оказания медицинской помощи (например, перевод из профильного отделения в ОРИТ), и/или очной консультации врача [304].
Под малым кровотечением понимают любое другое кровотечение, не попадающее под критерии большого или НКЗК кровотечения.
- При оценке кровотечения, возникшего на фоне антикоагулянтной терапии у пациента с ТГВ рекомендуется соотносить его с критериями большого кровотечения, небольшого, но клинически значимого кровотечения и малого кровотечения [302–304].
УДД 5 УУР С
3.2.3.5. Баланс пользы и риска при начальной и длительной антикоагулянтной терапии
Начальная и длительная терапия на протяжении 3 месяцев является базовой для всех пациентов с ТГВ вне зависимости от, того спровоцирован тромбоз или нет, наличия факторов риска рецидива ВТЭО и опасности развития больших кровотечения. При наличии противопоказаний к антикоагулянтам или прогрессировании тромботического процесса вопреки адекватной терапии обсуждается вопрос хирургической профилактики ТЭЛА. Тактика лечения дистального ТГВ может отличаться и обсуждается отдельно.
- Всем пациентам с ТГВ, которым показана терапия антикоагулянтами, рекомендуется проводить лечение на протяжении 3 месяцев [84,85,279,305].
УДД 1 УУР А
Комментарий: в рамках мета-анализа было показано, что более короткие курсы антикоагулянтной терапии ассоциируются с увеличением риска рецидива ВТЭО после окончания лечения в 1,5 (95% ДИ, 1,1-2,0) раза [305]. Преждевременное завершение терапии проксимального ТГВ даже при наличии объективных причин ассоциируется с 8-кратным увеличением риска неблагоприятного исхода (фатальная ТЭЛА, внезапная смерть, рецидив ВТЭО) в течение последующих 30 дней наблюдения [306].
3.2.3.6. Баланс пользы и риска при продленной терапии
Продление терапии свыше 3 мес. (вторичная профилактика ВТЭО) показана в тех случаях, когда польза от снижения вероятности рецидива ВТЭО превышает опасность, связанную с большими кровотечениями. При этом в расчет берутся преимущественно фатальные осложнения. Так, продленная терапия АВК ассоциируется с 5-кратным снижением риска рецидива ВТЭО ценой 3-кратного увеличения опасности больших кровотечений [307]. В то же время летальность при кровотечениях на АВК колеблется в пределах 9-11% и достигает 45% при внутричерепных кровоизлияниях [308,309]. Было рассчитано, что на фоне продленной до 1 года терапии АВК от фатальных кровотечений погибает 23 из 1000 пациентов, при том, что отказ от продленной терапии приводит к гибели от рецидива ВТЭО только 11 из 1000 пациентов [310]. ПОАК обладают лучшим профилем безопасности и при продленной терапии не увеличивают угрозу больших кровотечений в сравнении с плацебо, что позволяет отдавать им предпочтение в большинстве случаев [311,312]. Также для отдельных ПОАК (апиксабан**, ривароксабан**) была показана эффективность применения редуцированной (профилактической) дозировки при рамках продленной терапии (Таблица 12) [313,314]. Расчетные цифры для определения баланса пользы и риска продленной антикоагулянтной терапии приведены в Таблице 7.
Таблица 7. Расчетные величины по снижению риска рецидива ВТЭО и развитию большого кровотечения (с ассоциированными летальными исходами) в течение 5 лет продленной терапии антикоагулянтами [280].
|
Характер ВТЭО |
Исход |
Риск кровотечения |
|||||
|
Низкий |
Умеренный |
Высокий |
|||||
|
Спровоцированное большим транзиторным фактором |
ВТЭО |
↓2,6 (0,1) |
+0,2* |
↓2,6 (0,1) |
+0,4* |
↓2,6 (0,1) |
+2,1* |
|
БК |
↑2,4 (0,3) |
↑4,9 (0,5) |
↑19,6 (2,2) |
||||
|
Спровоцированное малым транзиторным фактором |
ВТЭО |
↓13,2 (0,5) |
-0,2* |
↓13,2 (0,5) |
+0,0* |
↓13,2 (0,5) |
+1,7* |
|
БК |
↑2,4 (0,3) |
↑4,9 (0,5) |
↑19,6 (2,2) |
||||
|
Неспровоцированное |
ВТЭО |
↓26,4 (1,0) |
-0,7* |
↓26,4 (1,0) |
-0,5* |
↓26,4 (1,0) |
+1,2* |
|
БК |
↑2,4 (0,3) |
↑4,9 (0,5) |
↑19,6 (2,2) |
||||
|
Рецидив без клинической провокации |
ВТЭО |
↓39,6 (1,4) |
-1,1* |
↓39,6 (1,4) |
-0,9* |
↓39,6 (1,4) |
+0,6* |
|
БК |
↑2,4 (0,3) |
↑4,9 (0,5) |
↑19,6 (2,2) |
||||
Примечания. БК – большое кровотечение; величины представляют число предотвращенных (↓) или спровоцированных (↑) случаев на 100 пациентов за 5 лет терапии; в скобках указано число фатальных эпизодов; *звездочкой обозначено число спровоцированных (знак «+») или предотвращенных (знак «-») летальных исходов в течение 5 лет антикоагулянтной терапии (чистая клиническая выгода)
Помимо антикоагулянтов при продленной терапии ВТЭО изучена возможность применения прочих антитромботических средств, в частности #ацетилсалициловой кислоты** (АСК) (АТХ группа: антиагреганты, кроме гепарина, B01AC06) в дозе 100 мг. и сулодексида (АТХ группа: группа гепарина, B01AB11) (Таблица 14). Расчетные данные о снижении риска рецидива ВТЭО и повышения угрозы большого кровотечения могут быть использованы для выбора препарата на основании индивидуальной оценки пользы и риска.
- При решении в пользу продленной антикоагулянтной терапии у пациента с ТГВ рекомендуется проводить ее на бессрочной основе с регулярной оценкой пользы и риска [84,85,279,305,315–317].
УДД 1 УУР А
Комментарий: ранее существовали рекомендации о целесообразности проведения продленной, но ограниченной по времени терапии антикоагулянтами (6, 12, 24 мес.). Проведенный мета-анализ продемонстрировал, что риск рецидива ВТЭО после завершения лечения не зависит от длительности, предшествующей антикоагуляции, если она превышает стандартные 3 мес. [305]. В период приема препарата вероятность рецидива минимальна, но после завершения лечения она увеличивается и достигает определенного уровня, определяемого характеристиками первичного эпизода и наличием дополнительных факторов риска. Т.о., при высоком риске рецидива ВТЭО терапию следует продолжать неопределенно долго до тех пор, пока польза превышает риск.
- При решении в пользу продленной антикоагулянтной терапии у пациента с ТГВ рекомендуется отдавать предпочтение ПОАК вместо АВК [84,85,311].
УДД 1 УУР А
Комментарий: в отличие от терапии АВК продленная терапия ПОАК не только не повышает риск больших кровотечений, но снижает общую смертность на 61% [311,318]. АВК остаются препаратами выбора при наличии противопоказаний к ПОАК или их недоступности. В частности, ПОАК противопоказаны при клапанной фибрилляции предсердий, наличии механического сердечного клапана, тяжелых нарушениях функции почек (КлКр<15 мл/мин), во время лактации, при наличии подтвержденного тройно-позитивного АФС и/или АФС с анамнезом артериальных и микроциркуляторных тромбозов [84,85,301]. В названных случаях рекомендуется применение АВК.
- При решении в пользу продленной антикоагулянтной терапии у пациента с ТГВ без высокого риска рецидива ВТЭО рекомендуется отдавать предпочтение редуцированным дозам ПОАК (апиксабан** 2,5 мг 2 раза в сутки, ривароксабан** 10 мг 1 раз в сутки) [84,85,319].
УДД 1 УУР А
Комментарий: в рамках проведенных исследований эффективность и безопасность редуцированных и полных лечебных доз ПОАК достоверно не отличались, но абсолютное число кровотечений было ниже при использовании профилактической дозы, что определяет целесообразность ее применения в большинстве случаев [313,314]. Следует иметь в виду, что пациенты с высоким риском рецидива ВТЭО не включались в названные исследования, поэтому данная рекомендация не может быть распространена на них. К высокому риску рецидива ВТЭО следует относить наличие активного злокачественного новообразования, повторный тромбоз, возникший на фоне применения редуцированной дозы антикоагулянта, а также другие факторы на усмотрение клинициста. Следует обратить внимание на официальную инструкцию к препарату, где указаны сроки, возможность и необходимость снижения дозы в рамках продленной терапии.
- При решении в пользу вторичной профилактики ВТЭО у пациента с ТГВ и высоким риском кровотечения или при отказе от использования оральных антикоагулянтов рекомендуется применение #сулодексида (АТХ группа: группа гепарина, B01AB11) в дозе 500 ЛЕ 2 раза в сутки [84,85,320].
УДД 2 УУР В
Комментарий: вторичная профилактика ВТЭО сулодексидом характеризуется максимальной безопасностью. В рамках мета-анализа не было зарегистрировано ни одного большого кровотечения, при этом риск рецидива ВТЭО был снижен на 49% [320]. Следует иметь в виду, что эффективность и безопасность сулодексида в рамках вторичной профилактики ВТЭО не изучена у больных с высоким риском рецидива ВТЭО, которых не включали в соответствующие исследования.
- Для вторичной профилактики ВТЭО у пациента с ТГВ рутинное применение ацетилсалициловой кислоты** не рекомендуется [85,319].
УДД 1 УУР А
Комментарий: объединенный анализ данных исследований WARFASA и ASPIRE (INSPIRE) показал, что использование ацетилсалициловой кислоты** для вторичной профилактики позволяет снизить риск рецидива ВТЭО на 32% ценой недостоверной тенденции к увеличению опасности кровотечения (ОР, 1,50; 95% ДИ, 0,72-3,14) [317]. Между тем в исследовании EINSTEIN Choice было продемонстрировано, что полная лечебная и редуцированная дозировки ривароксабана** по сравнению с ацетилсалициловой кислотой** обладают сходной безопасностью при значительном преимуществе по эффективности [314]. Т.о., при наличии более эффективных средств следует признать нецелесообразным использование ацетилсалициловой кислоты** для вторичной профилактики ВТЭО. Исключением могут являться случаи недоступности прочих препаратов или категорического отказа пациента от их использования при наличии объективных показаний к продленной терапии.
3.2.3.7. Тактика лечения и длительность антикоагулянтной терапии в зависимости от индивидуального баланса пользы и риска
Длительность терапии антикоагулянтами в зависимости от риска рецидива ВТЭО после ее завершения обобщена в таблице 8. Большинство рекомендаций относятся к проксимальной локализации ТГВ. Традиционно в России не принято разделять тактику лечения проксимальных и дистальных тромбозов. Между тем, существует доказательная база об эффективности и безопасности динамического наблюдения и выполнения повторного УЗАС через 5-7 дней при дистальной локализации тромбоза. При этом антикоагулянтную терапию назначают в случае выявления признаков прогрессирования тромботического процесса при контрольном осмотре [93]. Названный подход может быть использован у отдельных пациентов с низким риском ВТЭО. Между тем, проведение антикоагулянтной терапии при дистальном ТГВ ассоциируется со снижением риска ВТЭО на 50%, снижением риска ТЭЛА на 52% без увеличения опасности кровотечений [321].
Таблица 8. Длительность антикоагулянтной терапии в зависимости от фактора риска первичного эпизода ТГВ
|
Риск рецидива ВТЭО |
Факторы риска |
Длительность терапии |
|
|
Низкий (<3% в год) |
Большой транзиторный фактор |
Хирургическое вмешательство под наркозом >30 мин Госпитализация по поводу острого терапевтического заболевания с постельным режимом ≥3 дней Травма с переломом |
Завершить через 3 мес. |
|
Малый транзиторный фактор |
Терапия эстрогенами, прием комбинированными оральными контрацептивами (КОК) (АТХ группа: гормональные контрацептивы системного действия, G03AA, G03AB) Беременность, роды и послеродовый период |
||
|
Умеренный (3-8% в год) |
Малый транзиторный фактор |
Хирургическое вмешательство под наркозом <30 минут Госпитализация по поводу острого терапевтического заболевания с постельным режимом <3 дней, Острое терапевтическое заболевание с постельным режимом ≥3 дней вне стационара Травма конечности с ограничением подвижности в течение ≥3 дней, Длительный авиаперелет |
Рассмотреть продленную терапию при невысоком риске кровотечения |
|
Малый персистирующий фактор |
Воспалительное заболевание толстой кишки Активное аутоиммунное заболевание |
||
|
Неспровоцированный |
|||
|
Высокий риск (>8% в год) |
|
Активный рак Рецидив ТГВ в отсутствие большого транзиторного фактора риска АФС |
Продлить терапию |
- Рекомендуется завершить антикоагулянтную терапию у пациента с ТГВ, спровоцированным большим транзиторным фактором риска через 3 месяца [84,85,89,279,305].
УДД 1 УУР В
Комментарий: при высокой настороженности в отношении исхода ТГВ при условии низкого риска кровотечения антикоагулянтная терапия может быть продлена до 6 месяцев. Следует иметь в виду, что такой подход не влияет на риск рецидива ВТЭО после завершения лечения. Также нет оснований полагать, что продлённая антикоагуляция способна повлиять на реканализацию сосуда и риск развития ПТБ [322].
- Рекомендуется рассмотреть возможность завершения антикоагулянтной терапии у пациента с ТГВ, спровоцированным беременностью, родами, послеродовым периодом, приемом комбинированных оральных контрацептивов (АТХ группа: гормональные контрацептивы системного действия, G03AA, G03AB) и других средств, содержащих половые стероиды (АТХ группа: андрогены, G03B; эстрогены G03C; гестагены G03D) через 3 месяца [85,279,323,324].
УДД 3 УУР С
Комментарий: риск рецидива ВТЭО, спровоцированного беременностью, на 40% ниже такового при неспровоцированном тромбозе, и преимущественно связан с повторной беременностью [324]. Риск рецидива ВТЭО, спровоцированного гормонозависимыми состояниями, в частности приемом комбинированных оральных контрацептивов, в ранних исследованиях был расценен, как эквивалентный таковому при неспровоцированном эпизоде [325]. Более поздние работы показали, что искомый риск ниже такового при клинически неспровоцированном тромбозе на 60% и составляет 1,1% в год (0,4% в год при балле HERDOO-2 <2 и 3,5% при балле HERDOO-2 ≥2), что позволяет отнести названные тромбозы к группе низкого риска рецидива [323]. Возобновление приема комбинированных оральных контрацептивов после перенесенного ВТЭО, спровоцированного названным фактором, увеличивает риск рецидива тромбоза в 8,2 (95% ДИ, 2,1-32,2) раза [326]. При наличии показаний к продолжению или возобновлению лечения гормональным препаратами целесообразно продлить антикоагулянтную терапию свыше 3 месяцев на весь период приема гормональных средств. Показано, что сочетание АВК и ривароксабана** с половыми стероидами не увеличивает риск рецидива ВТЭО в период антикоагулянтной терапии [327].
- Антикоагулянтную терапию у пациента с ТГВ, спровоцированным малым транзиторным фактором риска за исключением беременности, родов, приема комбинированных оральных контрацептивов рекомендуется продлить сверх 3 месяцев при условии невысокого риска кровотечения [84,85,87,328].
УДД 2 УУР А
Комментарий: по отдельным сведениям, риск рецидива ВТЭО, спровоцированного малым транзиторным фактором риска, не отличается от такового при неспровоцированном ТГВ и достигает 7,1% в год. При этом продленная терапия с помощью ПОАК позволяет существенным образом уменьшить этот риск [87,328].
- Антикоагулянтную терапию у пациента с ТГВ, спровоцированным малым персистирующим фактором риска, рекомендуется продлить сверх 3 месяцев при условии невысокого риска кровотечения [84,85,87].
УДД 2 УУР А
Комментарий: по отдельным сведениям, риск рецидива ВТЭО, спровоцированного малым персистирующим фактором риска, не отличается от такового при неспровоцированном тромбозе и достигает 10,7% в год. При этом продленная терапия с помощью ПОАК позволяет существенным образом уменьшить этот риск [87].
- Антикоагулянтную терапию у пациента с неспровоцированным ТГВ рекомендуется продлить сверх 3 месяцев при условии невысокого риска кровотечения [84,85,279,311,329–331].
УДД 1 УУР А
Комментарий: несмотря на то, что мета-анализ не обнаружил достоверного влияния продленной антикоагулянтной терапии на риск фатального рецидива ВТЭО (ОР, 0,98; 95% ДИ, 0,14-6,98), любого рецидива ВТЭО (ОР, 0,63; 95% ДИ, 0,38-1,03), большого кровотечения (ОР, 1,84; 95% ДИ, 0,87-3,85), НКЗК (ОР, 1,78; 95% ДИ, 0,59-5,33) и общей смертности (ОР, 1,00; 95% ДИ, 0,63-1,57) [331], расчетные величины чистой клинической выгоды предполагают спасение 7 и 5 жизней на 1000 человек в группе низкого и умеренного риска кровотечения соответственно в течение 5 лет продленной терапии антикоагулянтами (Таблица 2) [280]. С учетом улучшенного профиля безопасности ПОАК, который определяет снижение общей смертности на фоне продленной терапии, чистую клиническую выгоду следует считать более очевидной при использовании последних [311].
- Лечение пациента с рецидивом ТГВ, возникшим в отсутствие большого транзиторного фактора риска, рекомендуется продлить сверх 3 месяцев [84,85,279,332].
УУД 2 УУР А
Комментарий: неопределённо долгая терапия антикоагулянтами в сравнении с лечением в течение 6 месяцев при повторном эпизоде ВТЭО ассоциируется со снижением шанса на рецидив на 88% ценой недостоверного тренда к увеличению риска большого кровотечения в 3,3 раза (95% ДИ, 0,90-10,0) [332].
- Антикоагулянтную терапию у пациента с ТГВ, возникшим на фоне злокачественного новообразования, рекомендуется проводить в течение 6 месяцев и продлевать до момента излечения рака [84,85,88,279,333,334].
УУД 1 УУР А
Комментарий: сведения о продленной терапии онкоассоциированных ТГВ на сегодняшний день ограничены. По данным мета-анализа, частота рецидива ВТЭО за год наблюдения колеблется от 2,7% до 8,0% при использовании ПОАК, составляет 4,0% при использовании АВК и достигает 11,6% на фоне НМГ. Риск больших кровотечений при составляет 2,7-7,0% ПОАК, 3,5% АВК (АТХ группа: антагонисты витамина К, B01AA), 4,1% НМГ [333]. Под излечением рака следует понимать отсутствие отдаленных метастазов, прогрессирования или рецидива опухоли, а также потребности в специфическом лечении [334].
- Антикоагулянтную терапию у пациента с ТГВ, возникшим на фоне верифицированного АФС, следует проводить в течение неопределённо долгого времени с помощью АВК (АТХ группа: антагонисты витамина К, B01AA) [84,85,211,335,336].
УДД 1 УУР А
Комментарий: по данным мета-анализа применение ПОАК при верифицированном АФС ассоциируется с 5-кратным увеличением риска развития артериальных тромботических событий преимущественно у лиц с анамнезом артериальных тромбозов, микроциркуляторных нарушением и тройно-позитивным АФС [335].
- При дистальном ТГВ рекомендуется терапия антикоагулянтами на протяжении 3 мес. [85,321,336,337].
УДД 1 УУР А
Комментарий: длительность терапии антикоагулянтами может быть увеличена у пациентов с высоким риском рецидива ВТЭО и низким риском кровотечения на основании индивидуальной оценки [337]. У отдельных больных с низким риском ВТЭО возможно динамическое наблюдение с выполнением повторного УЗАС и назначением антикоагулянтов в случае прогрессирования тромбоза [93]. К повышенному риску ВТЭО при дистальном ТГВ следует относить: положительный Д-димер, протяженность тромба >5 см, вовлечение в патологический процесс нескольких вен, диаметр пораженной вены >7 мм, близость тромба к проксимальным венам, отсутствие обратимого провоцирующего фактора, активный рак, ВТЭО в анамнезе, диагностика ТГВ в период стационарного лечения [279].
3.2.4. Лекарственные препараты для антикоагулянтной (антитромботической) терапии при ТГВ (общие положения)
В качестве антитромботических средств при ВТЭО в зависимости от фазы терапии могут быть использованы различные препараты (гепарин натрия** (АТХ группа: Группа гепарина B01AB), НМГ (далтепарин натрия, АТХ: группа гепарина, B01AB04; надропарин кальция, АТХ: группа гепарина, B01AB06; эноксапарин натрия**, АТХ: группа гепарина, B01AB05; бемипарин натрия, АТХ: группа гепарина, B01AB12; парнапарин натрия**, АТХ: группа гепарина, B01AB07), фондапаринукс натрия (АТХ группа: прочие антикоагулянты, B01AX05), антагонисты витамина К (АТХ группа: антагонисты витамина К, B01AA), ПОАК, ацетилсалициловая кислота**, сулодексид, относящиеся к АТХ группе B01 «Антикоагулянты». Для описания лечения применимы термины «антикоагулянтная терапия», «антитромботическая терапия». В зарубежной и отечественной литературе принято использовать термин «антикоагулянтная терапия» при выборе препаратов: гепарин натрия** (АТХ группа: Группа гепарина B01AB), НМГ, фондапаринукс натрия (АТХ группа: прочие антикоагулянты, B01AX05), антагонисты витамина К, ПОАК, и термин «антитромботическая терапия» при использовании дезагрегантов (АТХ группа: антиагреганты кроме гепарина, В01АС) (ацетилсалициловая кислота**) и сулодексида. Ниже представлены рекомендации по использованию отдельных препаратов при ТГВ с целью профилактики прогрессирования ТГВ и/или развития ТЭЛА с учетом фазы антитромботической терапии.
3.2.5. Лекарственные препараты для начальной и длительной антикоагулянтной (антитромботической) терапии
3.2.5.1. Рекомендуемые лекарственные препараты для начальной и длительной терапии
- У пациентов с ТГВ для начальной и длительной терапии рекомендуется использование лечебных доз НФГ**, НМГ, #фондапаринукса натрия (АТХ группа: прочие антикоагулянты, B01AX05), АВК (АТХ группа: антагонисты витамина К, B01AA), ПОАК (дабигатрана этексилат**, АТХ группа: ингибиторы тромбина прямые, B01AE07; апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03) [84,85,279,338,339].
УДД 5 УУР С
Комментарий: НФГ**, НМГ, #фондапаринукс натрия, АВК, ПОАК (дабигатрана этексилат**, АТХ группа: ингибиторы тромбина прямые, B01AE07; апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03) разрешены и рекомендованы для терапии ТГВ. При этом формулировки показаний к применению антикоагулянтов имеют различия. Поэтому при выборе лекарственного средства необходимо убедиться, что препарат рекомендован производителем к применению у данной категории больных. При назначении антикоагулянта следует придерживаться дозировок и методики использования, изложенных в официальной инструкции.
3.2.5.2. Сравнение лекарственных препаратов для начальной и длительной терапии
При выборе антикоагулянта необходимо учитывать множество факторов: тяжесть состояния пациента и особенности коморбидного фона, путь введения препарата и биодоступность, скорость достижения эффекта, соотношение эффективности и безопасности, возможность и необходимость лабораторного мониторинга, фармакодинамическое и фармакокинетическое взаимодействие препаратов, опыт и результаты применения того или иного препарата у определенных групп пациентов и в особых клинических ситуациях, стоимость лечения. Прямые сравнительные исследования лекарственных средств, применяемых для лечения ВТЭО, по каждому из этих параметров не проводились, однако тех данных, которые опубликованы к настоящему времени достаточно для общих рекомендаций.
- У пациентов с ТГВ в рамках начальной и длительной терапии рекомендуется применение ПОАК [85,148,279,310,340].
УДД 1 УУР А
Комментарий: эта рекомендация не применяется в следующих случаях: при оказании экстренной помощи пациентам с ТГВ, осложненным ТЭЛА высокого риска смерти; при лечении пациентов в критическом состоянии; пациентов с почечной недостаточностью (КлКр <15 мл/мин - для апиксабана**, ривароксабана** и эдоксабана <30 мл/мин – для дабигатрана этексилата**), умеренным или тяжелым заболеванием печени, антифосфолипидным синдромом; пациентов, которым требуются препараты, являющиеся ингибиторами или индукторами Р-гликопротеина, или сильными ингибиторами или индукторами ферментов цитохрома Р450 3А4 (CYP3A4), а также при других заболеваниях и состояниях, которые могут влиять на всасывание и метаболизм ПОАК. Согласно фармакокинетическим данным, пероральный прием апиксабана** и ривароксабана** обеспечивает столь же быстрый антикоагулянтный эффект, как и подкожное введение НФГ** или НМГ, поэтому ингибиторы Ха-фактора (апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03) могут быть рекомендованы для начальной терапии ТГВ с момента подтверждения диагноза. В то же время, назначение дабигатрана этексилата** и эдоксабана предполагает предварительное введение НМГ или НФГ** в течение не менее чем 5 дней. При длительной терапии превосходство над НМГ с переходом на АВК по безопасности доказано для всех ПОАК (апиксабана**, дабигатрана этексилата**, ривароксабана**, эдоксабана). В РКИ, мета-анализах и регистрах показано, что назначение ПОАК в сравнении с НМГ и АВК при лечении ВТЭО не влияет на общую смертность (ОР, 0,99; 95% ДИ, 0,85-0,15), риск ТЭЛА (ОР, 0,97; 95% ДИ, 0,77-1,23; ОР) и ТГВ (ОР, 0,80; 95% ДИ, 0,59-1,09), но снижает риск развития больших кровотечений на 37% (ОР, 0,63; 95% ДИ, 0,47-0,84) [148,302,310,340–344]. Кроме того, ПОАК не требуют частой корректировки дозы, мониторинга МНО или диетических ограничений, что повышает приверженность пациентов терапии, особенно на начальных этапах приема антикоагулянтов. При назначении антикоагулянтов следует учитывать стоимость лечения для пациентов. В большинстве опубликованных к настоящему времени исследований, сравнивающих стоимость лечения ВТЭО с помощью ПОАК и АВК показано, что лечение ПОАК в целом является менее затратным или аналогичным по цене в сравнении с АВК, однако, если принимать в расчет только цену препарата, то для ряда пациентов разница в цене может оказаться основной причиной досрочного прекращения терапии [345–347].
- При выборе ПОАК для начальной и длительной терапии у пациентов с ТГВ рекомендуется считать все препараты эквивалентными по эффективности и безопасности [280,348].
УДД 5 УУР С
Комментарий: отсутствие данных о преимуществах того или иного препарата не исключает отличий между ними, важных при выборе лекарственного средства в конкретных ситуациях. Такие факторы, как необходимость введения парентеральных антикоагулянтов, функция почек, онкологическое заболевание, сопутствующая лекарственная терапия (например, потребность в лекарственном средстве, изменяющем активность ферментов CYP3A4 или Р-гликопротеина), сроки госпитализации, однократный или двукратный режим приема и стоимость могут повлиять на выбор конкретного ПОАК. Для пациентов, которым планируется назначить дабигатрана этексилат** или эдоксабан начальная терапия должна включать НФГ** или НМГ в течение не менее 5 дней. Для получающих апиксабан** или ривароксабан** нет необходимости в предварительном лечении парентеральными антикоагулянтами. При этом начальную более высокую суточную дозу ривароксабана** пациент должен принимать в течение первых 3 трех недель терапии, апиксабана** – в течение первой недели. Эти различия могут быть особенно важны при определении сроков госпитализации и оценке возможности продолжения лечения в амбулаторных условиях [348].
- При лечении ТГВ у пациента с наличием ТЭЛА высокого риска смерти, при которой показано выполнение реперфузионного вмешательства, для начальной антикоагулянтной терапии рекомендуется использовать внутривенную инфузию НФГ** в подобранной по массе тела дозе [84].
УДД 5 УУР С
Комментарий: при лечении пациента с ТГВ, осложненным ТЭЛА высокого риска смерти с нестабильной гемодинамикой, быстрая и эффективная гипокоагуляция может быть достигнута только при внутривенном введении препарата. Единственным антикоагулянтом, предназначенным для внутривенного введения при начальной терапии ТЭЛА высокого риска смерти, является НФГ**. Внутривенное введение ассоциируется со снижением 30-дневной смертности от ТЭЛА [122,349]. Выполненные мета-анализы указывают на отсутствие преимуществ внутривенного введения НФГ перед подкожным введением НМГ в рамках инициальной терапии ТЭЛА, а также на повышенную эффективность и безопасность подкожных инъекций НМГ в сравнении с внутривенным и подкожным введением НФГ** в рамках начальной терапии ВТЭО [350–352]. Между тем, большинство включенных в мета-анализы исследований исключали массивную ТЭЛА, требующую активной реперфузии. С учетом фармакокинетических особенностей, возможности быстрой инактивации, совместимости с тактикой активной реперфузии внутривенная инфузия НФГ** в подобранной по массе тела дозе остается методом выбора при лечении ТЭЛА высокого риска смерти [84].
- При лечении пациента с ТГВ и ТЭЛА высокого и промежуточного риска смерти при стабильных показателях гемодинамики, когда не показано реперфузионное вмешательство, для начальной терапии рекомендуются подкожные инъекции НМГ или фондапаринукса натрия в подобранных по массе тела дозах [84,350,351].
УДД 5 УУР С
Комментарий: НМГ и фондапаринукс натрия предпочтительнее НФГ** для начальной антикоагулянтной терапии при ТЭЛА промежуточного и высокого риска смерти, поскольку они ассоциированы с более низким риском кровотечения, гепарин-индуцированной тромбоцитопении и не требуют регулярного мониторинга показателей коагулограммы и уровня анти-Ха активности [350,351,353,354] . Следует иметь в виду, что эффективность и безопасность реперфузионных вмешательств на фоне продолжающегося приема ПОАК не изучена, поэтому при наличии признаков ТЭЛА промежуточного и высокого риска смерти, когда есть вероятность ухудшения состояния и возникновения потребности в реперфузии, следует избегать применения ПОАК до окончательной стабилизации состояния больного (обычно 2-3 дня) [355].
- При лечении пациента с ТГВ в случае наличия показаний и возможностей для хирургической дезобструкции венозного русла для начальной антикоагулянтной терапии рекомендуется использовать внутривенную инфузию НФГ** или подкожные инъекции НМГ** в подобранных по массе тела дозах [356–358].
УДД 5 УУР С
Комментарий: при наличии показаний и возможностей для хирургической дезобструкции целесообразно использовать наиболее управляемый и совместимый с вмешательством вид антикоагулянтной терапии, к которой относится внутривенная инфузия НФГ** и подкожные инъекции НМГ [356–358]. На сегодняшний день отсутствуют исследования, позволяющие выбрать оптимальную тактику антикоагулянтной терапии у пациентов, подвергающихся хирургической дезобструкции.
3.2.5.3. Начальная и длительная терапия - режим применения антитромботических препаратов
В разделах 3.2.5.4 – 3.2.5.9 рассмотрены режимы применения антитромботических средств при проведении начальной и длительной антитромботической терапии
3.2.5.4. Гепарин натрия
Гепарин натрия** (АТХ группа: Группа гепарина B01AB, гепарин натрия**), вводимый подкожно или внутривенно в течение многих лет оставался основным средством лечения ВТЭО. В последние годы, однако, отношение к этому препарату, как к средству лечения ВТЭО существенно изменилось. Установлено, в частности, что при подкожном введении целевые значения времени свертывания крови или АЧТВ удается поддерживать не более, чем у 30% больных. В остальных случаях эффект введения гепарина оказывается недостаточным, что увеличивает относительный риск рецидива ВТЭО в 4-5 раз [359] и вероятность летального исхода в ближайшие 30 дней в 2,6 раз [349].
Оптимальным режимом использования НФГ** служит внутривенная инфузия первичным болюсом в подобранной по массе тела дозе с последующей постоянной инфузией со скоростью, обеспечивающей поддержание АЧТВ на уровне, превышающем верхнюю границу нормы в 1,5-2,3 раза (таблицы 9,10). Такой вариант антитромботической терапии позволяет поддерживать состояние гипокоагуляции на необходимом для лечения уровне у 70% больных. У остальных пациентов отмечают значительные колебания АЧТВ от нормо- до чрезмерной гипокоагуляции. Поэтому назначение НФГ** предполагает обязательное многократное определение АЧТВ. Кроме АЧТВ, до начала терапии НФГ** и через 1, 3, 5, 7, 9, 11-14 дней ее проведения необходимо контролировать содержание тромбоцитов; а при появлении признаков несоответствия изменений АЧТВ дозе вводимого препарата определять уровень антитромбина, тромбиновое время плазмы до и после сорбции из нее гепарина сорбентом, тромбин-гепариновое время в бедной тромбоцитами плазме, анти-Ха активность [128].
Таблица 9. Рекомендуемая начальная дозировка НФГ** при ТГВ
|
Введение |
Начальная доза |
Поддерживающая доза |
|
Внутривенно |
||
|
Без коррекции по массе тела |
5000 ЕД |
1250-1280 ЕД/ч |
|
Скорректированная по массе тела |
80 ЕД/кг |
18 ЕД/кг/ч |
|
Подкожно |
||
|
Фиксированная доза |
333 ЕД/кг |
250 ЕД/кг каждые 12 ч |
|
Доза, подбираемая по АЧТВ |
5000 ЕД |
17500 ЕД каждые 12 ч с коррекцией по АЧТВ |
Таблица 10. Протокол (номограмма) подбора дозы при внутривенной инфузии НФГ**
|
АЧТВ во время внутривенной инфузии гепарина натрия |
Изменение дозы (ЕД/кг/ч) |
Дополнительные действия |
Следующее определение АЧТВ |
|
Увеличение менее чем в 1,2 раза от контрольной величины |
+4 |
Болюс 80 ЕД/кг |
Через 6 ч |
|
Увеличение в 1,2-1,5 раза от контрольной величины |
+2 |
Болюс 40 ЕД/кг |
Через 6 ч |
|
Увеличение в 1,5-2,3 раза от контрольной величины |
0 |
0 |
Через 6 ч |
|
Увеличение в 2,3-3,0 раза от контрольной величины |
–2 |
0 |
Через 6 ч |
|
Увеличение более чем в 3,0 раза от контрольной величины |
–3 |
Прекращение на 1 ч |
Через 6 ч |
Примечание. АЧТВ - активированное частичное тромбопластиновое время; контрольная величина - верхняя граница нормы для конкретной лаборатории.
Большое число противопоказаний, высокая вероятность геморрагических осложнений и обязательный лабораторный мониторинг при использовании лечебных доз НФГ** привели к тому, что этот препарат постепенно вытесняется другими антикоагулянтами. Подкожные инъекции НФГ** с лечебной целью целесообразно ограничить случаями, когда внутривенное введение невозможно, а другие антикоагулянты противопоказаны или недоступны. Внутривенное введение (болюс с последующей инфузией) НФГ** целесообразно применять только при лечении больных, находящихся в критическом состоянии, а также пациентов, которым может потребоваться экстренное оперативное вмешательство, травматичная процедура, тромболизис. В таких случаях, короткий период полувыведения, возможность оценки степени гипокоагуляции по АЧТВ и возможность нейтрализации протамина сульфатом** (АТХ группа: антидоты, V03AB14) делают НФГ** средством выбора. Кроме того, инфузия НФГ** в качестве начальной терапии ТГВ и ТЭЛА может применяться у больных с недавно перенесенным кровотечением и высоким риском рецидива, у пациентов с высокой вероятностью дефицита антитромбина (например, в случае, если ТГВ развился на фоне специфической профилактики НМГ, а также у больных, перенесших массивную, более 50% ОЦК, кровопотерю) и у пациентов с олиго- и анурией. У остальных пациентов более безопасным и эффективным следует считать использование НМГ или ПОАК.
3.2.5.5. Гепарины низкомолекулярные
Гепарины низкомолекулярные: далтепарин натрия, АТХ: группа гепарина, B01AB04; надропарин кальция, АТХ: группа гепарина, B01AB06; эноксапарин натрия**, АТХ: группа гепарина, B01AB05; бемипарин натрия, АТХ: группа гепарина, B01AB12; парнапарин натрия**, АТХ: группа гепарина, B01AB07.
В сравнении с НФГ**, низкомолекулярные гепарины имеют высокую биодоступность (более 90%) при подкожном введении, более длительный период полувыведения (190-270 мин против 40-90 мин) и продолжительность антитромботической активности (17-24 ч против 8-12 ч), в меньшей степени связываются с белками плазмы крови, что позволяет им сохранять свой эффект на фоне эндогенной интоксикации, обладают более предсказуемым дозозависимым антикоагулянтным эффектом, не стимулируют, а ослабляют агрегацию тромбоцитов, реже (менее 0,5%) вызывают тромбоцитопению. Эти свойства обусловлены химическим составом препаратов. Короткоцепочечные молекулы гепарина, содержащие специфическую пентасахаридную последовательность и менее 18 олигомеров (с молекулярной массой менее 5400 Да), не способны образовывать тройной комплекс тромбин-антитромбин-гепарин и подавлять активность тромбина, но сохраняют способность к антитромбин-зависимой инактивации Xa фактора. Поскольку состав каждого из коммерческих НМГ различен, они отличаются друг от друга по физико-химическим, биологическим и фармакокинетическим свойствам и не являются взаимозаменяемыми. Рекомендуемые для лечения ВТЭО дозы НМГ представлены в Таблице 11. В большинстве случаев назначение рекомендуемых доз НМГ не требует рутинного лабораторного мониторинга.
Мониторирование анти-Ха активности при подкожном введении антикоагулянтов целесообразно использовать для подбора дозы у больных с очень низкой или очень высокой массой тела, выраженным нарушением функции почек, высоким риском кровотечения, при беременности. Целевые значения для лечебных доз составляют 0,6-1,0 ЕД/мл при двукратном режиме введения или 0,8-1,3 МЕ/мл при однократном режиме введения и зависят от наименования препарата [122]. При использовании НМГ кровь для определения анти-Ха активности берут через 4-6 ч после введения препарата (оптимально после 3-4-х инъекций).
Таблица 11. Рекомендуемые дозы НМГ при начальной и длительной терапии ВТЭО
|
Препарат |
Доза при двукратном введении |
Доза при однократном введении |
|
Далтепарин натрия (АТХ: Группа гепарина, B01AB04) |
100 МЕ/кг |
200 МЕ/кг |
|
Надропарин кальция (АТХ: Группа гепарина, B01AB06) |
86 МЕ/кг |
172 МЕ/кг |
|
Эноксапарин натрия** (АТХ: Группа гепарина, B01AB05) |
100 МЕ/кг |
150 МЕ/кг |
|
Бемипарин натрия* (АТХ: Группа гепарина, B01AB12) |
нет |
3500 МЕ |
|
Парнапарин натрия** (АТХ: Группа гепарина, B01AB07) |
6,400 МЕ 2 раза в сутки в течение 7-10 дней, далее 6,400 МЕ или 4,250 МЕ 1 раз в сутки |
|
Примечание. *Бемипарин натрия может применяться только для длительной терапии ТГВ с ТЭЛА или без нее на протяжении не более 3 месяцев.
3.2.5.6. Фондапаринукс натрия
Фондапаринукс натрия (АТХ группа: прочие антикоагулянты, B01AX05) представляет собой синтетический пентасахарид, обладающий антитромбин-зависимой способностью к селективной инактивации Ха фактора свертывания. Препарат вводят под кожу живота один раз в сутки без контроля показателей системы гемостаза. Является предпочтительным в сравнении с НФГ** при начальной антикоагулянтной терапии ВТЭО из-за низкого риска больших кровотечений и гепарин-индуцированной тромбоцитопении [353,354,360–363]. Фондапаринукс натрия при лечении ВТЭО вводят в стандартной лечебной дозе 7,5 мг 1 раз в сутки, пациенты с массой тела <50 кг получают 5 мг, а пациенты с массой тела> 100 кг - 10 мг. Из-за своей низкой молекулярной массы фондапаринукс натрия может накапливаться при почечной недостаточности, поэтому его не следует применять у пациентов с КлКр <30 мл/мин [153]. В связи с отсутствием потенциального вовлечения в иммунные механизмы формирования ГИТ II типа, фондапаринукс натрия может использоваться при развитии указанного осложнения [361,364–371] .
3.2.5.7. Прямые ингибиторы фактора Xa
Прямые ингибиторы фактора Xa (апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03).
Апиксабан** (АТХ группа: прямые ингибиторы фактора Xa, B01AF02) - прямой ингибитор Xa фактора, обратимо и селективно блокирующий активный центр фермента. Характеризуется высокой биодоступностью при приеме внутрь, не зависящей от приема пищи. Метаболизируется в печени, частично (27%) выводится почками в неизменном виде. Не требует лабораторного мониторинга активности, хотя это возможно с помощью специальных калиброванных тестов на анти-Ха активность. В рамках начальной и длительной терапии ВТЭО препарат используется в дозе 10 мг два раза в сутки в течение 7 дней, затем 5 мг 2 раза в сутки. Лечение начинают без предварительной парентеральной терапии (Таблица 12). В отличие от лечения фибрилляции предсердий, при ТГВ у пациента с почечной недостаточностью коррекцию дозы не проводят. Тем не менее, при КлКр 15-29 мл/мин апиксабан** следует применять с осторожностью, а при КлКр <15 мл/мин – препарат не рекомендуется.
Ривароксабан** (АТХ группа: прямые ингибиторы фактора Xa, B01AF01) - прямой ингибитор фактора Ха, обладающий высокой биодоступностью при приеме внутрь, которая зависит от приема пищи при дозировке более 10 мг. Метаболизируется в печени, частично (36%) выводится почками в неизменном виде. Не требует лабораторного мониторинга активности, хотя это возможно с помощью калиброванного протромбинового времени Neoplastin и с помощью калиброванных тестов на анти-Ха активность. Для начальной и длительной терапии ВТЭО применяют в дозе 15 мг 2 раза в сутки в течение первых 3 недель с последующим переходом на 20 мг 1 раз в сутки. Лечение начинают без предварительной парентеральной терапии (Таблица 12). В отличие от лечения фибрилляции предсердий, не требует обязательной корректировки дозы у пациентов с КлКр <50 мл/мин, но инструкцией предусмотрено снижение дозы с 20 мг до 15 мг 1 раз в сутки при индивидуально высоком риске кровотечения. Следует отметить, что рекомендации даны на основании фармакокинетического моделирования, а дозировка не изучалась в рамках клинических исследований у пациентов с ВТЭО. Между тем, данные реальной клинической практики показывают, что необоснованное снижение дозы ПОАК может увеличивать риск рецидива ВТЭО [343]. Ривароксабан** не рекомендуется использовать при КлКр <15 мл/мин.
Эдоксабан (АТХ группа: прямые ингибиторы фактора Xa B01AF03) ингибирует свободный фактор Xa и характеризуется быстрым развитием фармакодинамических эффектов - в течение 1-2 часов после приема. Прием пищи минимально влияет на общую экспозицию. Метаболизируется в печени путем гидролиза, а также с участием CYP3A45 (<10%). Около 50% препарата выводится почками. Рекомендуемая доза эдоксабана составляет 60 мг один раз в сутки после первоначального введения парентеральных антикоагулянтов в течение по крайней мере 5 дней. Доза эдоксабана может быть снижена до 30 мг 1 раз в сутки у отдельных групп пациентов (Таблица 12). Эдоксабан и первоначальный парентеральный антикоагулянт не следует применять одновременно. Эдоксабан не рекомендуется при клиренсе креатинина (КлКр) <15 мл/мин.
3.2.5.8. Прямые ингибиторы тромбина
Дабигатрана этексилат** (АТХ группа: ингибиторы тромбина прямые B01AE07) является низкомолекулярным, не обладающим фармакологической активностью предшественником активной формы дабигатрана. После приема внутрь быстро всасывается и путем гидролиза печеночными и плазменными эстеразами превращается в дабигатран. Дабигатран является мощным конкурентным обратимым прямым ингибитором тромбина (фактора IIa). Около 85% активного вещества выводится почками. Не требует лабораторного мониторинга активности, но оно возможно с помощью специально калиброванных экаринового времени свертывания и разведенного тромбинового времени. При начальной и длительной терапии ВТЭО используют в дозе 150 мг два раза в сутки, которую начинают принимать после не ранее, чем через 5 дней начальной парентеральной антикоагуляции с использованием НМГ или НФГ. Для больных старше 80 лет или при сопутствующем приеме верапамила** (АТХ группа: блокаторы кальциевых каналов, C08DA01) доза должна быть уменьшена до 110 мг два раза в день. Такое же уменьшение дозы может быть рассмотрено у больных в возрасте 75-80 лет, при КлКР 30-50 мл/мин, при наличии эзофагита, гастрита, ГЭРБ, а также при наличии других факторов риска кровотечения. При КлКр <30 мл/мин применение дабигатрана этексилата** не рекомендуется (Таблица 12). Следует отметить, что рекомендации даны на основании фармакокинетического моделирования, а дозировка не изучалась в рамках клинических исследований у пациентов с ВТЭО.
Таблица 12. Режимы применения ПОАК в рамках инициальной, длительной и продленной терапии ВТЭО
|
Препарат |
Инициальная терапия |
Длительная терапия |
Продленная терапия |
Снижение дозы у отдельных групп пациентов |
|
Апиксабан** (АТХ группа: прямые ингибиторы фактора Xa, B01AF02) |
10 мг 2 раза в сутки в течение 7 дней |
5 мг 2 раза в сутки |
2,5 мг 2 раза в сутки через 6 мес. |
Не требуется; не рекомендуется использование при КлКр <15 мл/мин |
|
Ривароксабан** (АТХ группа: прямые ингибиторы фактора Xa, B01AF01) |
15 мг 2 раза в сутки в течение 21 дня |
20 мг 1 раз в сутки |
20 мг или 10 мг 1 раз в сутки через 6 мес. |
Возможно снижение с 20 мг до 15 мг 1 раз в сутки при КлКр <50 мл/мин; не рекомендуется использование при КлКр <15 мл/мин |
|
Эдоксабан (АТХ группа: прямые ингибиторы фактора Xa, B01AF03) |
Не используется, требуется введение НМГ в течение 5 дней |
60 мг 1 раз в сутки
|
60 мг 1 раз в сутки
|
30 мг 1 раз в сутки при умеренном или тяжелом нарушении функции почек (КлКр 15-50 мл/мин), низкой массе тела (≤60 кг), сопутствующей терапии следующими ингибиторами Р-гликопротеина: циклоспорином, дронедароном, эритромицином или кетоконазолом. Не рекомендуется использование при КлКр<15 мл/мин |
|
Дабигатрана этексилат ** (АТХ группа: ингибиторы тромбина прямые, B01AE07) |
Не используется, требуется введение НМГ в течение 5 дней |
150 мг 2 раза в сутки |
150 мг 2 раза в сутки |
Рекомендовано снижение дозы до 110 мг 2 раза в сутки у пациентов старше 80 лет, при сопутствующем приёме верапамила**; возможно снижение доза до 110 мг 2 раза в сутки у пациентов 75-80 лет, при КлКр 30-50 мл/мин, при наличии эзофагита, гастрита, ГЭРБ, при наличии других факторов риска кровотечения; не рекомендуется использование при КлКр <30 мл/мин. |
3.2.5.9. Антагонисты витамина К
Антагонисты витамина К (АТХ группа: антагонисты витамина К, B01AA).
Антагонисты витамина К (АВК) - антикоагулянты непрямого действия, которые подавляют синтез активных форм витамин К-зависимых факторам свертывания крови (II, VII, IX и X) и антикоагулянтных протеинов C и S в печени. Эффект АВК проявляется медленно (в течение нескольких суток), поэтому они не подходят для раннего лечения ВТЭО, а также в случаях, когда необходимо быстрое антикоагулянтное действие. Кроме того, из-за медленного прекращения антитромботического эффекта препараты этой группы не следует использовать для краткосрочной дооперационной профилактики венозного тромбоза. Предпочтение следует отдавать варфарину** (АТХ группа: антагонисты витамина К, B01AA03). При недоступности варфарина** следует использовать другие антагонисты витамина К (в частности, аценокумарол). Подбор дозы варфарина** начинают одновременно с парентеральным введением антикоагулянтов. Эффективную дозу АВК подбирают таким образом, чтобы поддерживать значения МНО (в пределах от 2,0 до 3,0 (лабораторный контроль за терапией лекарственными препаратами (непрямыми антикоагулянтами) (B03.005.008)). Чувствительность больных к АВК не одинакова, зависит от множества врожденных и приобретенных факторов и может меняться со временем. Поэтому эффективная доза колеблется в широких пределах.
Чтобы поддерживать терапевтический уровень гипокоагуляции во время перехода с парентеральных антикоагулянтов на варфарин**, необходимо строго соблюдать два условия:
- Длительность одновременного парентерального введения лечебных доз антикоагулянтов НФГ**, НМГ, фондапаринукс натрия и приема варфарина** должна составлять не менее 5 сут.
- Парентеральное введение антикоагулянтов можно прекратить не ранее, чем после двух последовательных анализов, взятых с интервалом примерно в сутки (два последовательных дня), демонстрирующих значение МНО в терапевтическом диапазоне 2,0-3,0.
В 1-2-е сутки у большинства пациентов следует использовать дозы варфарина** от 5 до 10 мг. У лиц пожилого возраста, истощенных, с хронической сердечной недостаточностью, заболеванием печени, недавней большой операцией или принимающих препараты, повышающие чувствительность к варфарину**, начальная доза не должна превышать 5 мг. Аналогичного подхода разумно придерживаться у больных с неизвестной врожденной чувствительностью к варфарину** (полиморфизмы генов цитохрома Р450 2С9 и VCORK1), особенно при повышенном риске кровотечений. В дальнейшем дозу варфарина** подбирают в зависимости от МНО, которое следует определить после приема двух или трех начальных доз препарата. В последующем МНО необходимо определять ежедневно или один раз в несколько дней до получения стабильных терапевтических значений показателя, затем 2-3 раза в неделю на протяжении 1-2 нед. После достижения стабильных терапевтических значений МНО следует определять каждые 4 нед, а в последующем при отсутствии существенных изменений состояния пациента, характера питания и сопутствующего лечения - каждые 3 мес. Более частая оценка целесообразна у больных со значительными колебаниями показателя. Если требуется коррекция (увеличение или уменьшение) дозы препарата, следует повторить цикл более частого определения МНО, пока снова не будут достигнуты стабильные значения показателя. Общие принципы подбора дозы варфарина** приведены в Таблице 13.
Таблица 13. Алгоритм подбора дозы АВК на примере #варфарина**[1,372–374]
|
Первые 2 дня: 5-10 мг однократно |
||
|
3-й день |
Определить МНО |
|
|
МНО <1,5 |
Увеличить суточную дозу на ½ таблетки, определить МНО через 1-2 дня |
|
|
МНО 1,5-2,0 |
Увеличить суточную дозу на ¼ таблетки, определить МНО через 1-2 дня |
|
|
МНО 2,0-3,0 |
Оставить суточную дозу без изменений, определить МНО через 1-2 дня |
|
|
МНО 3,0-4,0 |
Уменьшить суточную дозу на ¼ таблетки, определить МНО через 1-2 дня |
|
|
МНО >4,0 |
Пропустить 1 прием, далее суточную дозу уменьшить на ½ таблетки, определить МНО через 1-2 дня |
|
|
4-5-й день |
Определить МНО, действовать по алгоритму 3-го дня. Если подбор дозы занимает более 5 дней, то следует определять МНО 1 раз в 2 дня и следовать алгоритму 3-го дня. |
|
Важнейший показатель, характеризующий эффективность и безопасность длительного использования АВК - время нахождения МНО в границах целевого диапазона, которое должно превышать 60-70%. Для более успешного поддержания стабильного уровня антикоагуляции при длительном использовании АВК рекомендуются: определение МНО самим пациентом (при наличии у него портативного прибора), контроль МНО в антикоагулянтном кабинете или клинике, внедрение компьютерных систем централизованного мониторинга пациентов, принимающих АВК, а также формирование приверженности пациентов к терапии АВК в виде обучения в Школах варфаринотерапии [372–374]. Если у больных с подобранной дозой АВК МНО выходит за границы терапевтического диапазона, необходимо выявить и по возможности устранить возможные причины (неточность определения МНО, интеркуррентные заболевания, выраженные изменения в диете, употребление алкоголя, прием препаратов, влияющих на эффективность варфарина**, недостаточная приверженность к лечению). Если при регулярном приеме варфарина** МНО не достигает нижней границы терапевтического диапазона, обычно достаточно увеличить совокупную недельную дозу на 10–20% и чаще контролировать МНО, пока оно не стабилизируется. В отдельных случаях более высокая доза варфарина** может быть дана однократно с последующими более частыми определениями МНО и изменением общей недельной дозы или без него.
3.2.6. Лекарственные препараты для продленной антикоагулянтной терапии
3.2.6.1. Рекомендуемые лекарственные препараты для продленной антитромботической терапии
- В качестве лекарственных средств для продленной антикоагулянтной терапии предпочтение рекомендуется отдавать прямым оральным антикоагулянтам [319].
УДД 1 УУР А
Комментарий: для продленного лечения (вторичной профилактики) ТГВ могут быть использованы АВК, дабигатрана этексилат**, ривароксабан**, апиксабан**. В качестве альтернативы пероральным антикоагулянтам может применяться #сулодексид и #ацетилсалициловая кислота** в дозе 100 мг. [315–317,319].
3.2.6.2. Сравнение лекарственных препаратов для продленной антитромботической терапии
Предложенные для продленной терапии ВТЭО антитромботические препараты (АТХ группа: антитромботические средства, В01А) в рамках проведенных клинических исследований сравнивали преимущественно с отсутствием терапии или плацебо: АВК против плацебо [375,376], апиксабан** против плацебо [313], ривароксабан** против плацебо [342], эдоксабан против плацебо [377], дабигатрана этексилат** против плацебо [378], ацетилсалициловой кислоты** против плацебо [316], сулодексид против плацебо [379] или между собой: различные режимы. По результатам исследований были опубликованы мета-анализы, демонстрирующие, что использование оральных антикоагулянтов (АВК и ПОАК) снижает риск рецидива ВТЭО в среднем на 80%, в тоже время применение сулодексида ассоциируется со снижением риска только на 50%, ацетилсалициловой кислоты** – на 30% (Таблица 14) [319]. Важно отметить, что применение АВК с заниженным целевым диапазоном МНО (1,5-2,0) ассоциируется с умеренным снижением риска рецидива ВТЭО на 60% наряду с увеличением угрозы большого кровотечения в 3 раза, что соответствует таковой при использовании полной лечебной дозы с достижением целевого диапазона МНО 2,0-3,0. Эти данные можно использовать с целью индивидуального подбора препарата для продленной терапии на основании личной оценки пользы и риска.
Таблица 14. Риск развития рецидива ВТЭО и большого кровотечения при использовании антикоагулянтов и прочих антиттромботических препаратов при сравнении с плацебо (отсутствием лечения) в рамках продленной терапии [319].
|
Препарат |
Риск рецидива ВТЭО (95% ДИ) |
Риск большого кровотечения (95% ДИ) |
|
АВК при МНО 2,0-3,0 |
0,16 (0,10-0,26) |
3,13 (1,37-7,16) |
|
АВК при МНО 1,5-2,0 |
0,39 (0,23-0,65) |
3,23 (1,16-8,99) |
|
Апиксабан** 5 мг |
0,20 (0,11-0,34) |
0,25 (0,03-2,27) |
|
Апиксабан** 2,5 мг |
0,19 (0,11-0,34) |
0,50 (0,09-2,72) |
|
Дабигатрана этексилат ** 150 мг |
0,18 (0,09-0,35) |
1,71 (0,61-4,75) |
|
Ривароксабан** 20 мг |
0,22 (0,14-0,36) |
1,77 (0,27-11,44) |
|
Ривароксабан** 10 мг |
0,18 (0,10-0,34) |
1,29 (0,17-9,78) |
|
Сулодексид |
0,50 (0,28-0,91) |
н/д |
|
Ацетилсалициловая кислота** |
0,71 (0,55-0,91) |
0,61 (0,11-3,31) |
Примечания. н/д – риск не рассчитан, т.к. в исследованиях по изучению сулодексида не было зарегистрировано больших кровотечений
3.2.6.3. Продленная терапия - режим применения антитромботических препаратов
3.2.6.4. Нефракционированный гепарин
Нефракционированный гепарин** (АТХ группа: группа гепарина B01AB, гепарин натрия**) является наиболее непредсказуемым среди всех антикоагулянтов, поэтому назначается в терапевтической дозе только при возможности регулярного лабораторного мониторинга свертываемости крови (через 4-6 часов после каждой инъекции) при начальной и длительной терапии, но не используется на этапе продленного лечения. При внутривенном применении оптимальная длительность лечения НФГ** не установлена, так как пациентов с ТГВ, осложненным ТЭЛА высокого риска смерти или находящиеся в критическом состоянии, исключали из большинства исследований. В исследовании PEITHO в группе пациентов с ТЭЛА промежуточного и высокого риска смерти, получавших только НФГ**, среднее время между рандомизацией и летальным исходом или декомпенсацией кровообращения составило 1,79±1,60 дня [355]. Поэтому представляется разумным использовать у таких пациентов инфузии НФГ** до стабилизации состояния, но не менее, чем на 2-3 дня, после чего они могут быть переведены на оральные антикоагулянты (АТХ группа: антагонисты витамина К, B01AA; АТХ группа: прямые ингибиторы фактора Xa, B01AF; АТХ группа: ингибиторы тромбина прямые, B01AE). Если планируется перевод на АВК, то оральный антикоагулянт назначают сразу после стабилизации состояния, а введение гепарина прекращают после достижения устойчивого значения МНО в пределах целевого диапазона 2,0- 3,0 (т.е. когда при определении МНО с периодичностью 1 раз в сутки будут получены подряд два одинаковых результата).
3.2.6.5. Гепарины низкомолекулярные
Гепарины низкомолекулярные (далтепарин натрия, АТХ: группа гепарина, B01AB04; надропарин кальция, АТХ: группа гепарина, B01AB06; эноксапарин натрия**, АТХ: группа гепарина, B01AB05; бемипарин натрия, АТХ: группа гепарина, B01AB12; парнапарин натрия**, АТХ: группа гепарина, B01AB07).
- Низкомолекулярные гепарины рекомендуется рассмотреть в качестве основных лекарственных препаратов для продленной антикоагулянтной терапии у пациентов с ограничениями к применению прямых оральных антикоагулянтов [92,215,380–382].
УДД 1 УУР А
Комментарий: до настоящего времени назначение НМГ остается приемлемым вариантом продленной антикоагулянтной терапии ВТЭО [92,215]. Препараты вводят в полных лечебных или редуцированных (50-75% от полной лечебной) дозах (Таблица 11), лечение ими не требует рутинного лабораторного мониторинга, что позволяет продолжать использование после выписки из стационара. По данным мета-анализов, продленное применение НМГ в сравнении с АВК ассоциируется c тенденцией к снижению риска рецидива ВТЭО и развития большого кровотечения [381], а также позволяет улучшить реканализацию пораженных вен и уменьшить вероятность развития ПТБ, в том числе венозной трофической язвы [382]. Следует учитывать, что при длительном применении НМГ увеличивается вероятность развития таких осложнений как остеопороз и ГИТ [383,384]. Поэтому общепринятой тактикой является перевод пациентов, нуждающихся в длительной терапии, на оральные антикоагулянты. НМГ остаются предпочтительными при лечении пациентов с ТГВ и онкологическими заболеваниями желудочно-кишечного тракта, внутрипросветными опухолями мочеполовой системы, при наличии тромбоцитопении, клинически значимой печеночной или почечной недостаточности, при использовании химиотерапевтических препаратов, влияющих на активность Р-гликопротеина и/или ферментов цитохрома Р450 3А4 (CYP3A4), а также при других заболеваниях и состояниях, которые могут влиять на всасывание и метаболизм ПОАК. В таких ситуациях НМГ могут применяться в качестве основного средства для продленной терапии или в качестве временной альтернативы оральным антикоагулянтам на период, когда использование последних ограничено.
3.2.6.6. Прямые ингибиторы фактора Xa
Прямые ингибиторы фактора Xa (апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03) и прямые ингибиторы тромбина (дабигатрана этексилат**, АТХ группа: ингибиторы тромбина прямые, B01AE07).
- Прямые оральные антикоагулянты рекомендуется в качестве основных лекарственных препаратов для продленной антикоагулянтной терапии [148,313,314,342,378].
УДД 1 УУР А
Комментарий: для продленной антикоагулянтной терапии апиксабан** применяется в редуцированной дозе 2,5 мг 2 раза в день спустя 6 мес. от момента начала лечения. Исследование AMPLIFY Extension показало, что использование апиксабана** в редуцированной дозировке снижает вероятность рецидива ВТЭО на 81% без увеличения опасности развития больших кровотечений и НКЗК в сравнении с плацебо [313].
Для продленной терапии ривароксабан** может применяться в дозе 20 мг или 10 мг 1 раз в сутки спустя 6 мес. от момента начала лечения. Исследование EINSTEIN Extension показало, что ривароксабан** в дозировке 20 мг снижает вероятность рецидива ВТЭО на 82% без увеличения опасности развития больших кровотечений в сравнении с плацебо [342]. В исследовании EINSTEIN Choice обе дозировки ривароксабана**, 20 мг и 10 мг, снизили риск рецидива ВТЭО на 66% и 74% соответственно без увеличения опасности развития больших кровотечений и НКЗК в сравнении с ацетилсалициловой кислотой** в дозе 100 мг [314].
Для продленной терапии эдоксабан может применяться в дозе 60 мг 1 раз в сутки с возможностью ее снижения до 30 мг 1 раз в сутки у отдельных групп пациентов (Таблица 12). В исследовании Hokusai VTE у пациентов с ТГВ и/или ТЭЛА (n=8292) эдоксабан продемонстрировал «не меньшую эффективность» по сравнению с варфарином в качестве препарата для профилактики рецидивов венозных тромбоэмболических осложнений при значимо меньшей частоте больших и клинически значимых кровотечений на 55% [338].
Следует иметь в виду, что пациентов с высоким риском кровотечения и рецидива ВТЭО не включали в исследования продленной антикоагулянтной терапии.
Для продленной терапии оральный ингибитор тромбина дабигатрана этексилат** применяется в полной лечебной дозировке 150 мг 2 раза в сутки с возможностью ее снижения до 110 мг 2 раза в сутки у отдельных подгрупп пациентов (Таблица 12). Исследования RE-MEDY и RE-SONATE показали, что дабигатрана этексилат** обладает не меньшей эффективностью в сравнении с АВК, но характеризуется улучшенным профилем безопасности, снижая риск развития комбинации больших кровотечений и НКЗК на 46% [378]. В сравнении с плацебо дабигатрана этексилат** снизил риск рецидива ВТЭО на 92% без увеличения угрозы развития больших кровотечений.
3.2.6.7. Антагонисты витамина К
Антагонисты витамина К (АТХ группа: антагонисты витамина К, B01AA).
- При выборе лекарственных препаратов для продленной антикоагулянтной терапии рекомендуется отдавать предпочтение прямым оральным антикоагулянтам (дабигатрана этексилат**, АТХ группа: ингибиторы тромбина прямые, B01AE07 апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03), а не антагонистам витамина К [84,85,319].
УДД 1 УУР А
Комментарий: при продленной терапии применяют стандартные дозировки АВК с достижением целевого диапазона МНО 2,0-3,0. Следует особо отметить, что заведомое снижение целевого диапазона не рекомендуется, т.к. подобный подход не влияет на риск развития больших кровотечений, но существенным образом уменьшает эффективность вторичной профилактики ВТЭО (Таблица 14) [319].
3.2.6.8. Салициловая кислота и ее производные
Салициловая кислота и ее производные (АТХ группа: антиагреганты, кроме гепарина, B01AC).
- Препараты ацетилсалициловой кислоты** (АТХ группа: антиагреганты, кроме гепарина, B01AC) не рекомендуются в качестве средств для продленной антитромботической терапии у пациентов с ВТЭО [314–317,319].
УДД 1 УУР А
Комментарий: еще с 1980-х годов ацетилсалициловая кислота** рассматривали, как альтернативный препарат для вторичной профилактики ВТЭО благодаря низкой стоимости, благоприятному профилю побочных эффектов, удобной дозировке и относительно низкому риску кровотечения. Эта возможность была изучена в исследовании WARFASA. Всего 402 пациента с первым неспровоцированным эпизодом ВТЭО, завершившие терапию антикоагулянтами через 6-18 месяцев, были рандомизированы на группы для приема ацетилсалициловой кислоты** 100 мг однократно в сутки или плацебо с периодом наблюдения в течение двух лет. Рецидивы ВТЭО отмечали реже в группе ацетилсалициловой кислоты** (6,6% против 11,2%; ОР, 0,58; 95% ДИ, 0,36–0,93). В каждой группе у одного пациента развилось большое кровотечение [316]. В другое исследование ASPIRE, оценившее влияние ацетилсалициловой ксилоты** на риск рецидива ВТЭО, было включено 822 пациента с первым неспровоцированным тромботическим эпизодом, которые завершили курс антикоагулянтной терапии и были рандомизированы на группы для приема ацетилсалициловой кислоты** в дозе 100 мг или плацебо 1 раз в сутки с последующим наблюдением до 4 лет. У пациентов в группе ацетилсалициловой кислоты** частота рецидива ВТЭО составила 4,8% в год, тогда как в группе плацебо - 6,5% (ОР, 0,74; 95% ДИ, 0,52–1,05). Таким образом, применение ацетилсалициловой кислоты** в сравнении с плацебо не уменьшило вероятность повторного венозного тромбоза, но снизило шанс возникновения больших сердечно-сосудистых осложнений (ВТЭО, инфаркт миокарда, инсульт и смерть от сердечно-сосудистых осложнений) на 34% без влияния на опасность больших кровотечений [315]. Данные исследований WARFASA и ASPIRE были объединены в самостоятельный анализ INSPIRE, который показал, что АСК** снижает риск рецидива ВТЭО на 32% (5,1% против 7,5%; ОР, 0,68; 95% ДИ, 0,51-0,90) и риск больших сердечно-сосудистых осложнений на 34% (5,7% против 8,7%; ОР, 0,66; 95% ДИ, 0,50-0,86) без увеличения угрозы больших кровотечений [317]. Между тем, в рамках исследования EINSTEIN Choice обе дозы ривароксабана** (20 мг и 10 мг) продемонстрировали эквивалентную безопасность по частоте развития больших кровотечений и НКЗК, но существенное преимущество по эффективности в сравнении со 100 мг ацетилсалициловой кислоты** [314]. Т.о., при вторичной профилактике ВТЭО преимущество ацетилсалициловой кислоты** в виде относительно невысокого числа больших кровотечений продемонстрировано не было. Поэтому рутинное применение препарата следует признать нецелесообразным в связи с наличием более эффективной альтернативы.
3.2.6.9. Сулодексид
Сулодексид (АТХ группа: группа гепарина, B01AB11).
- У пациентов с высоким риском геморрагических осложнений и сохраняющимся риском рецидива ВТЭО или отказе от продолжения применения ПОАК для продленной антикоагулянтной терапии рекомендуется применение #сулодексида [320,379,385].
УДД 2 УУР А
Комментарий: сулодексид является альтернативным средством продленной терапии и вторичной профилактики ВТЭО. Он представляет собой природный гликозаминогликан с антитромботическими и профибринолитическими свойствами, в меньшей степени воздействующий на систему гемостаза, что определяет минимальный риск геморрагических осложнений. Антитромботический эффект сулодексида связан с эндотелиопротективным действием. Эффективность и безопасность препарата для вторичной профилактики ВТЭО изучена в исследовании SURVET, включившего 615 пациентов с неспровоцированным ТГВ, получавших терапию антикоагулянтами в течение 3-12 месяцев. Пациентов рандомизировали в группы для получения сулодексида по 500 ЛЕ дважды в день или плацебо в течение 2 лет. Рецидив ВТЭО развился у 15 из 307 пациентов, получавших сулодексид (4,9%, 95% ДИ, 2,9-8,1) и у 30 из 308 пациентов, получавших плацебо (9,7%, 95% ДИ 6,8–13,7), что соответствует снижению риска на 51% (ОР, 0,49; 95% ДИ, 0,27-0,92). При этом больших кровотечений не было ни в одной из групп. Следует отметить, что только у 8% пациентов в этом исследовании имелась ТЭЛА [379]. В рамках мета-анализа были оценены данные по сулодексиду для вторичной профилактики ВТЭО, учитывая исследование SURVET и три других работы, в которых суммарно включили 1461 пациента. Было установлено, что сулодексид снижает риск рецидива ВТЭО на 49% (ОР, 0,51; 95% ДИ, 0,35-0,74) и риск тромбоза поверхностных вен на 59% (ОР, 0,41; 95% ДИ, 0,22-0,76). Общая частота кровотечений в группе сулодексида составила 0,28%, в контрольной группе - 1,60% [320]. По результатам другого сетевого мета-анализа (18 РКИ и 7 наблюдательных исследований) было установлено, что пролонгированная терапия сулодексидом существенно снижает риск большого кровотечения в сравнении с применением ацетилсалициловой кислоты**. Также сулодексид является наиболее безопасным препаратом в отношении риска развития клинически значимого кровотечения, по сравнению с АСК**, ПОАК и АВК. Более того, применение сулодексида ассоциируется с минимальным риском смерти от любой причины и смерти от ВТЭО, ТЭЛА, инфаркта миокарда и ОНМК. Было установлено, что сулодексид более эффективен в отношении риска развития рецидива ТГВ и ТЭЛА по сравнению с ацетилсалициловой кислотой**. Использование ПОАК является эффективным в плане снижения рецидива ВТЭО, тем не менее, терапия сулодексидом показала сопоставимые данные с АВК в отношении первичных и вторичных исходов [385]. Представляет интерес тот факт, что сулодексид не увеличивает риск кровотечения, уменьшает смертность, а по частоте развития побочных эффектов сопоставим с плацебо. На сегодняшний день применение сулодексида в рамках продленной терапии ВТЭО изучено для дозы 500 ЛЕ (2 таб. по 250 ЛЕ) 2 раза в сутки, которую следует использовать по названным показаниям не ранее, чем через 3 месяца терапии антикоагулянтами.
3.3. Хирургические и эндоваскулярные вмешательства при ТГВ - общие положения
Целями хирургических и эндоваскулярных вмешательств при ТГВ являются профилактика тромбоэмболии легочных артерий и/или профилактика развития посттромботической болезни (ПТБ) тяжелой степени [1,386,387]. Хирургические и эндоваскулярные вмешательства являются дополнением к антикоагулянтной терапии. При рассмотрении методов хирургического лечения ТГВ необходимо учитывать механизм тромбообразования: восходящий из глубоких вен голени с проксимальным распространением, и нисходящий, который на фоне экстра- или интравазальной компрессии нижней полой или подвздошных вен носит противоположный по направлению характер с вторичным вовлечением более дистальных вен [1,386,387].
Хирургические методы должны применяться в условиях стационара с палатой интенсивной терапии, сердечно-сосудистыми хирургами или специалистами по рентген эндоваскулярной диагностике и лечению.
3.3.1. Инструментальные методы диагностики перед хирургическим лечением ТГВ
- Пациентам с тромбозом глубоких вен перед хирургическим лечением рекомендуется дополнительно выполнить триплексное сканирование нижней полой вены (A04.12.015.001), подвздошных вен и вен нижних конечностей (комплексное) или КТ-венографию (компьютерно-томографическая ангиография сосудов нижних конечностей (A06.12.053) или МР-венографию (магнитно-резонансная венография (одна область) (A05.12.005)) для определения уровня и характера проксимальной границы тромба [388–391].
УУР 1 УУД А
Комментарий: по сравнению с МСКТ-венографией, ультразвуковое дуплексное сканирование имеет среднюю чувствительность и специфичность 97% и 94% со средними положительными и отрицательными прогностическими значениями 97% и 98% для симптоматического проксимального ТГВ [388]. К сожалению, при ультразвуковом осмотре адекватная визуализация подвздошных вен снижена у тучных пациентов и у неподготовленных больных из-за пневматизации кишечника. Проксимальную границу тромба при поражении подвздошных вен удается выявить лишь в 23% случаев [389]. Объединенный анализ 13 исследований, сравнивающих МСКТ с УЗИ или венографией, показал общую чувствительность и специфичность 95,9% и 95,2% для выявления ТГВ соответственно [391]. МР-венография также продемонстрировала свою точность при диагностике ТГВ. Мета-анализ 14 исследований с использованием различных методов МРТ по сравнению с венографией или ультразвуковой визуализацией продемонстрировал чувствительность и специфичность 95,7% и 92,9% соответственно [390].
3.3.2. Профилактика ТЭЛА во время хирургического или эндоваскулярного лечения ТГВ
- Рутинная установка временного кава-фильтра или баллонная окклюзия нижней полой вены перед эндоваскулярным лечением ТГВ пациентов с тромбозом глубоких вен дистальнее нижней полой вены не рекомендуется [267,392–397].
УДД 2 УУР А
Комментарий: по данным систематического обзора, включившего 19 РКИ, 1943 пациентов с острым проксимальным ТГВ, объединенные результаты катетерного тромболизиса (КТЛ) и фармакомеханической тромбэктомии (ФМТ) не продемонстрировали увеличение частоты ТЭЛА (ОР 1,01; 95% ДИ, 0,33-3,05) и летального исхода (ОР 0,76; 95% ДИ, 0,31-1,89)[267]. Частота ТЭЛА во время катетерного тромболизиса не превышает таковую при стандартной антикоагулянтной терапии [392,394,395,397,398]. В двух исследованиях, сравнивающих результаты лечения 103 пациентов, которым выполняли только КТЛ, и 69 пациентов, у которых КТЛ дополняли другими методами дезобструкции, не было выявлено никаких симптомов ТЭЛА [393,399]. Среди 473 пациентов, включенных в Национальный венозный регистр США, у пациентов без имплантации кава фильтра, ТЭЛА возникла только у 1%. Примечательно, что 71% процедур КТЛ выполнялось при распространении тромба на подвздошно-бедренный сегмент, а 15% - на НПВ [400]. Эти риски аналогичны рискам, наблюдаемым у пациентов, получающих обычную антикоагулянтную терапию, и не требует рутинной установки фильтра НПВ.
- Рекомендуется рассмотрение целесообразности установки временного кава-фильтра или проведения баллонной окклюзии нижней полой вены у пациентов со сниженным кардиопульмонарным резервом перед эндоваскулярным или хирургическим лечением ТГВ [399,401–404].
УДД 4 УУР С
Комментарий: пациенты с тромбом в НПВ, подвергающиеся КТЛ и ФМТ часто считаются подверженными более высокому риску ТЭЛА и требуют рассмотрения возможности установки извлекаемого кава-фильтра [399,401–403] К сожалению, имеется мало достоверных данных, подтверждающих или опровергающих эту гипотезу. В одном исследовании среди 68 пациентов, перенесших различные фармакологические (40%), механические (17%) и фармакомеханические процедуры не было симптоматической перипроцедурной ТЭЛА, несмотря на то, что только у 20% из них был установлен кава-фильтр [399]. При этом нельзя исключить напрасное установление кава-фильтров даже если учитывать, что 30% пациентов имели распространение ТГВ на НПВ. В другой небольшой серии, состоящей из 85 пациентов, сообщалось о наличии бессимптомных эмболов, попавших в фильтр НПВ, на фоне проведенного КТЛ или ФМТ с вовлечением НПВ и без него. Однако также очевидно, что симптоматическая ТЭЛА может редко, но существенно осложнять эти процедуры, омрачая результаты общей выборки [404]. Учитывая, что имеется мало достоверных данных о риске ТЭЛА при использовании относительно новых катетерных методов венозной дезобструкции, представляется разумным считать этот вопрос нерешенным и, по крайней мере, рассмотреть относительную баланс пользы и риска в ситуациях потенциально высокого риска.
3.4. Хирургическая и эндоваскулярная дезобструкция венозного русла
3.4.1. Цель дезобструкции глубоких вен
- Основной целью дезобструкции венозного русла при ТГВ рекомендуется считать предупреждение развития тяжелых форм ПТБ [84,85,387,405–407].
УДД 1 УУР А
Комментарий: дезобструкцию при проксимальных ТГВ применяют в рамках стратегии раннего удаления тромба, которая была разработана и внедрена в начале XXI века [85,387,405]. Ее целью служит профилактика тяжелых форм ПТБ. В последние 10-15 лет ведущие специализированные хирургические сообщества рекомендовали раннее удаление тромба, при этом уровни доказательности в зависимости были различными. В настоящий момент отношение к этому подходу сдержано и максимально индивидуализировано [85]. Необходимым условием для дезобструкции является соответствующая техническая и методологическая база медицинского учреждения: наличие рентген-операционной с возможностью выполнения флебографического контроля на всех этапах вмешательств, использование внутрисосудистого ультразвукового исследования при необходимости; наличие опытных рентгенэндоваскулярных специалистов, специальной аппаратуры и расходного материала, позволяющих эффективно и безопасно выполнять как саму процедуру дезобструкции глубоких вен, так и устранять остаточные стенозы магистральных вен с помощью ангиопластики и венозного стентирования, необходимость в проведении которых возникает у 17-80% больных [84,85,387,405,406].
3.4.2. Показания к дезобструкции венозного русла
- Пациентам с подвздошно-бедренным ТГВ и давностью симптомов до 28 дней (в зависимости от метода пособия) рекомендуется выполнение ранней хирургической дезобструкции с целью снижения риска развития ПТБ в отдаленном периоде [85,267–269,274,330,394–398].
УДД 1 УУР А
Комментарий: несмотря на очевидные преимущества ранней дезобструкции при илиофеморальном ТГВ, одним из ключевых факторов, ограничивающих более широкое ее применение, служит достаточно высокая частота больших кровотечений. По данным мета-анализа 4 РКИ (TORPEDO, CaVenT, ATTRACT, CAVA) высок кумулятивный риск больших кровотечений (ОР 5,68, 95% ДИ, 1,27-25,33; p = 0,02) [85]. С другой стороны, имеются данные об эффективности в отношении предотвращения средних и тяжелых форм ПТБ (ОР 0,59, 95% ДИ, 0,44-0,80; p <0,001). Поэтому дезобструкцию оптимально предлагать пациентам с высоким риском развития ПТБ (протяженное тромботическое поражение, локализация проксимальной части тромба), с высокими шансами на успех, ранними сроками заболевания (до 28 суток с момента начала тромбообразования), при низком риске кровотечений [269].
- При наличии технических условий, квалифицированного персонала, владеющего соответствующими методами у пациентов с синей флегмазии, с развитием ишемических расстройств в нижней конечности рекомендуется рассмотреть методы хирургической дезобструкции [267,274,330,394–398,408,409].
УДД 1 УУР А
Комментарий: распространенный тромбоз с практически полной обструкцией венозного кровотока, который получил название синяя флегмазия, сопровождается массивным отеком, цианозом кожных покровов, интенсивным болевым синдромом. В наиболее тяжелых случаях синей флегмазии при тромбозе всех коллатеральных путей оттока и сосудов микроциркуляторного русла развивается гангрена нижней конечности.
- Пациентам с бедренно-подколенным тромбозом и дистальным тромбозом глубоких вен хирургическая или эндоваскулярная дезобструкция не рекомендуется [275,330].
УДД 2 УУР А
Комментарий: в дополнительном анализе подгруппы РКИ ATTRACT, которая включила 300 пациентов с бедренно-подколенным ТГВ в период от 6 до 24 месяцев между группами ФМТ и без ФМТ не было различий по частоте развития и тяжести проявлений ПТБ (шкала Виллальты (Villalta) (Приложение Г12) ≥5: ОР = 0,97; 95% ДИ, 0,75–1,24); по частоте развития среднетяжелой ПТБ (шкала Виллальты ≥10: ОР = 0,93; 95% ДИ 0,57 - 1,52; по частоте развития тяжелых форм ПТБ; согласно неспецифическим и веноспецифическим опросникам качества жизни (p> 0,5 для всех сравнений). Так же через 10 дней и через 30 дней не было разницы в уменьшении боли или отека в ногах между группами лечения. В период до 10 дней лечения большое кровотечение произошло у трех пациентов в группе ФМТ, в группе антикоагулянтной терапии таковых не было (p=0,06). В этот же период любое кровотечение произошло в восьми случаях против двух в группе без ФМТ (p = 0,032). По частоте рецидива ВТЭО межгрупповых различий не получено (p = 0,24) [275].
В дополнительном анализе качества жизни по общей выборке исследования ATTRACT у пациентов с ТГВ бедренно-подколенного сегмента показатели изменений качества жизни по сравнению с исходным уровнем по всем опросникам были одинаковыми в группах c ФМТ и без ФМТ [330].
3.4.3. Стратегия раннего удаления тромба
- В качестве первой линии хирургического лечения пациентов с ТВГ рекомендовано применять эндоваскулярные катетерные вмешательства, такие как катетерный тромболизис, фармакомеханическая или механическая тромбэктомия [85,408,410,411].
УДД 1 УУР А
Комментарий: по результатам мета-анализа, включающего 4 РКИ (TORPEDO, CaVenT, ATTRACT, CAVA) эффективность стратегии раннего удаления тромба методами чрескожного тромболизиса и фармакомеханической тромбэктомией очевидна, что подтверждается снижением относительного риска развития тяжелых форм ПТБ (ОР 0,59, 95% ДИ, 0,44 - 0,80; p <0,001), так же из-за широкого доверительного интервала показана лишь тенденция снижения частоты любой ПТБ (ОР 0,67, 95% ДИ, 0,45-1,0; p = 0,005). Риск больших кровотечений так же увеличивается в группе тромболитической терапии (ОР 5,68, 95% ДИ, 1,27-25,33; p = 0,02) [85].
- В качестве второй линии хирургического лечения пациентов с ТВГ рекомендовано применять открытые хирургические вмешательства [408].
УДД 2 УУР B
Комментарий: по данным систематического обзора открытая хирургическая тромбэктомия в сравнении с терапией антикоагулянтами ассоциируется со снижением риска ПТБ на 33% (ОР, 0,67;4 95% ДИ, 0,52-0,87), снижением риска формирования рефлюкса по глубоким венам на 32% (ОР, 0,68; 95% ДИ, 0,46-0,99) и тенденцией к уменьшению риска сохранения резидуальной венозной обструкции (ОР, 0,844; 95% ДИ, 0,60-1,19) [408]. Качественные исследования, касающиеся эффективности и безопасности открытой хирургии у больных с ТГВ весьма ограничены по объему. В шведском РКИ сравнивались результаты лечения 13 пациентов, которым выполнена открытая тромбэктомия, с последующим назначением антикоагулянтных препаратов и 17 пациентов с острым подвздошно-бедренным ТГВ, которые в качестве лечения использовали только АКТ. Проходимость вен через 10 лет была значительно лучше в хирургической группе по сравнению с консервативной (83% против 41% соответственно). Кроме того, в группе пациентов, перенесших оперативное пособие наблюдалось уменьшение отека нижних конечностей (71% против 46%) и частоты развития трофических язв (18% против 8%) С целью предупреждения ретромбоза – объем оперативного вмешательства включал формирование артериовенозной фистулы [410]. Имеется всего одно небольшое прямое сравнительное исследование открытых хирургических вмешательств и чрескожных манипуляций, в котором продемонстрирована сопоставимая эффективность хирургической тромбэктомии с тромболизисом, при том, что стентирование выполнялось во всех случаях. Через два года у 85% пациентов в группе хирургической тромбэктомии и у 87% больных в группе тромболизиса не развилась ПТБ [411].
- У пациентов с тромбозом подвздошного сегмента при наличии противопоказаний к тромболитической терапии рекомендуется выполнение механической тромбэктомии или открытой хирургической тромбэктомии [410,412–419]
УДД 2 УУР А
Комментарий: доказательства эффективности катетерной механической тромбэктомии в отношении илиофеморального ТГВ ограничены по качеству. В мета-анализе, в который включены 16 ретроспективных исследований, в общей сложности сообщается о результатах лечения проксимального ТГВ у 481 пациента. Применяли различные тромболитические препараты (АТХ группа: ферментные препараты, В01AD), дозировки и устройства. Восстановление 82–100% просвета вены (степень II или III) произошло у 83–100% пациентов. Все различные устройства оказались безопасными, не было зарегистрировано случаев смерти или инсультов, связанных с процедурами. Частота симптоматической ТЭЛА была <1%. О кровотечениях сообщалось в 6 из 16 исследований, переливание крови потребовалось 4–14% пациентов [412]. По данным другого мета-анализа, применение механической тромбэктомии в сравнении с КТЛ ассоциировалось со значительным снижением риска геморрагических осложнений параллельно с улучшенным сохранением проходимости вен через 6 мес. наблюдения [419]. Несмотря на свою травматичность, открытая тромбэктомия восстанавливает проходимость вен и, возможно, снижает частоту развития ПТБ в сравнении с АКТ. Данное вмешательство применимо у тщательно отобранных пациентов с илиофеморальным и илиокавальным ТГВ [410,413–418].
- У пациентов с тромбозом илиокавального сегмента при невозможности проведения эндоваскулярных методов дезобструкции рекомендуется рассмотреть целесообразность открытой хирургической тромбэктомии [408,410,413–418].
УДД 2 УУР А
- Пациентам с тромбозом глубоких вен для оценки эффективности технического результата хирургического лечения ТГВ рекомендуется рассмотреть целесообразность использования шкал оценки тромботической нагрузки (Приложения Г13 – Г17) [400,420].
УДД 4 УУР С
Комментарий: изменение тромботической нагрузки в результате хирургического лечения острого тромбоза глубоких вен позволяет объективизировать результаты.
Система оценки Marder: субстрат оценки – флебография, анализ 7 анатомических сегментов, максимальный счет 40 баллов, сокращенная версия 28 баллов. Оценка объема тромбоза базируется на отношении площади проекции тени тромба к площади венозного сегмента, баллы в сегменте от 4 до 10. Недостатки: субъективности оценки площади проекций, отсутствие оценки нижней полой вены (НПВ), объединение подвздошных вен в один сегмент, отсутствие глубокой бедренной вены (ГБВ), мышечных и берцовых вен голени. Приложение Г13.
Система оценки Arnesen H, субстрат оценки – флебография, анализ 7 анатомических сегментов, максимальный счет 30 баллов. Оценка одно сегмента по длине тромба, степени стеноза или окклюзии. В сегменте возможно от 0 до 3х баллов. Недостатки: отсутствие оценки НПВ, ГБВ, мышечных и берцовых вен, объединение подвздошных вен в один сегмент, субъективность оценки длины тромба. Приложение Г14.
Система счета тромботической нагрузки группы специалистов из нескольких научных сообществ под председательством John M. Porter «Scoring system of a subcommittee of venous disease». Субстрат оценки – флебография, анализ 17 сегментов, объединенных в 6 анатомических областей глубоких вен и 2 сегмента поверхностных вен. Оценка венозного сегмента основана на двух переменных - длина тромба и степень стеноза или окклюзия. Максимальный счет в полной версии 24 балла, сокращенной 18. Недостатки: объединение подвздошных вен, бедренных вен, вен голени, субъективность оценки длины тромба. Приложение Г15.
Система Björgell О., субстрат оценки – флебография, рекомендована авторами для оценки УЗИ, ВСУЗИ, МРТ или КТ. Максимальный счет 42 балла. Включает оценку 14 венозных сегментов глубоких вен. Оценка сегмента базируется только на длине тромба по отношению к длине сегмента от 0 до 3х баллов. Парная или двойная вена оценивается как один сегмент. Разработан коэффициент перевода баллов из шкалы Marder. Недостаток: не учитываются поверхностные вены, наличие полной окклюзии, субъективность оценки длины тромба. Приложение Г16.
Система Protack C., субстрат оценки – флебография. Максимальный счет 14 баллов. Оценка сегмента по 3-х бальной шкале - полное открытие вены, частичное открытие вены, полная окклюзия. Недостатки: не оценивается ГБВ, вены дистальнее подколенной вены. Приложение Г17.
Наиболее полная по охвату венозных сегментов является система Björgell О., наиболее легкая в воспроизведении оценки тромботического распространения в одном анатомическом сегменте является Система Protack C, которую легко воспроизводить в рутинной хирургической практике.
3.4.4. Способы эндоваскулярной дезобструкции венозного русла
- У пациентов с ТГВ при наличии показаний к эндоваскулярной дезобструкции рекомендуется использовать следующие методики: катетерный тромболизис, фармакомеханическая или механическая катетерная тромбэктомия [85,410,411].
УДД 5 УРР С
Комментарий: КТЛ проводят, установив катетер с множественными отверстиями для высвобождения тромболитического препарата непосредственно в тромб [85,269,387,405,406,421]. Доступ может быть осуществлен как прямым способом, так и под контролем УЗИ через подколенную или берцовые вены. Внутритромботическое введение лекарственного препарата может осуществляться как постоянной инфузией, так и пульсирующим способом («спрей»-методика). В качестве тромболитических препаратов используют тканевой активатор плазминогена** (АТХ группа: ферментные препараты, B01AD02). Общая длительность КТЛ варьирует от 24-72 часов, в зависимости от объема тромботического поражения, скорости лизиса. Флебографию повторяют каждые 12 часов, меняя позицию катетера по мере лизиса тромбов. Контрольное исследование по окончании КТЛ осуществляют для оценки результата и выявления остаточных стенозов магистральных вен, с проведением их ангиопластики и стентирования при необходимости [85,387,405,406].
Усиленный ультразвуком катетерный тромболизис основан на комбинации ультразвукового мини-трансдьюсера с инфузионным катетером для тромболизиса [85,387,422]. При этом ультразвуковые волны, генерируемые вовремя тромболизиса увеличивают площадь соприкосновения литического агента с фибрином и ускоряют процесс тромболизиса. По результатам отдельных исследований преимущества ультразвукового усиления при КУТ неочевидны, так как результаты сопоставимы с обычным КУТ [422].
В основе фармакомеханической тромбэктомии заложена комбинация механического разрушения тромба и введение локально литического агента в зону воздействия. При реолитической фармакомеханической тромбэктомии механическое воздействие осуществляется по принципу Бернулли (за счет высокой скорости поступления раствора в катетер создается зона низкого давления и вакуума) с последующей эвакуацией тромбов и введением тромболитического препарата. Процедура занимает значительно меньше времени, чем КТЛ и сопровождается применением меньших дозировок тромболитических препаратов. По мнению многих авторов именно за ФМТ будущее [85,387,406,423].
Общим принципом чрескожной катетерной механической тромбэктомии является применение устройств, использующих только механические способы разрушения с или без экстракции тромба и без применения тромболитических препаратов. Предложено достаточно большое количество устройств, которые находятся на разной стадии внедрения в практику. Исследования, изучавшие механические методы ограничены по качеству, но демонстрируют убедительные результаты [412].
3.4.5. Особенности различных методов эндоваскулярной дезобструкции венозного русла
3.4.5.1. Фармакологический тромболизис
- У пациентов с ТГВ не рекомендуется выполнять системный тромболизис [267,424,425].
УДД 1 УУР В
Комментарий: системный тромболизис при остром ТГВ рутинно не применяется вследствие низкой эффективности и высокой вероятности больших кровотечений. Объединенный анализ шести рандомизированных сравнительных исследований показал, что системное введение стрептокиназы в бинарной системе оценки (лучше/не лучше) в 3,7 раза эффективнее гепарина при увеличении вероятности большого кровотечения в 2,9 раза [424]. Количественный анализ тромболитических исходов при лечении подвздошно-бедренного тромбоза методом системного введения тканевого активатора плазминогена** (АТХ группа: ферментные препараты, B01AD02) продемонстрировал полный тромболизис всего у 8,9% и отсутствие эффективности у 33,8% пациентов [425].
- У пациентов с ТГВ не рекомендуется выполнять регионарный тромболизис [267,424–426].
УДД 1 УУР А
Комментарий: под этим видом подразумевается введение тромболитического препарата в свободный от тромбоза венозный сегмент, без установки катетера в тромботические массы. Данные хорошего качества по регионарному тромболизису существенно ограничены. Результаты Кокрейновского обзора свидетельствуют, что регионарный тромболизис в сравнении с антикоагулянтной терапией улучшает реканализацию вены (ОР 10; 95% ДИ, 1,33-75,23), по результатам двух исследований регионарный тромболизис не увеличивает риск кровотечений (ОР 4; 95% ДИ, 0,46-34,75). В сроках 6-60 месяцев регионарный тромболизис не изменяет риск развития ПТБ (ОР 0,65; 95% ДИ, 0,4-1,04), не изменяет относительный риск развития трофических язва (ОР 1; 95% ДИ, 0,07-15) [426].
- Катетерный тромболизис рекомендуется выполнять при отсутствии противопоказаний отобранным пациентам соответствующим следующим критериям: вовлечение подвздошного сегмента, продолжительность симптомов ТГВ не более 21 дня, физическая активность пациента с приемлемой прогнозируемой продолжительностью жизни [395,408,426].
УДД 1 УУР А
Комментарий: в РКИ CaVenT рандомизированы 209 пациентов с впервые возникшим илиофеморальном ТГВ и длительностью симптомов 21 день. Продемонстрировано существенно меньшая частота развития ПТБ в группе, где применен катетерный тромболизис в сравнении со стандартной антикоагулянтной терапией в сроке наблюдения 24 месяца (ОР 41,1%; 95% ДИ, 31,5–51,4; и 55·6%; 95% ДИ, 45,7–65,0, p=0,047 соответственно). Полное открытие просвета илиофеморального сегмента глубоких вен через 6 месяцев зафиксировано у 65,9% пациентов в группе, где использовали катетерный тромболизис в сравнении 47,4% группы контроля (p=0,012). В общей сложности катетерный тромболизис осложнился кровотечениями у 20 больных, из которых 3 больших кровотечения (гематома передней брюшной стенки, кровотечение в глубокий компартмент голени, и гематома в месте паховой пункции) и 4 клинически значимых кровотечения. При этом риск ТЭЛА, инсульта и интракраниального кровотечения не увеличивался [395].
По результатам систематического обзора ранние результаты КТЛ превосходят стандартную АКТ в сроке до 1 месяца по критерию «любое уменьшение тромботической нагрузки» (ОР 35,05; 95% ДИ, 2,28-539,63), не превосходят по критерию «полное растворение тромба» (ОР 21,79; 95% ДИ, 1,38-343,26), уступают по критерию «риск кровотечений» (малые кровотечения), в основном за счет кровотечения места пункции (ОР 7,69 95% ДИ, 0,4-146,9), сопоставимы по риску развития ТЭЛА (ОР 0,32; 95% ДИ, 0,01-7,26); среднесрочные результаты (6-60 месяцев) сопоставимы по риску формирования ПТБ (ОР 0,74; 95% ДИ, 0,55-1), превосходят по полному открытию просвета вены (ОР 2,52; 95% ДИ, 0,52-12,17), превосходят по критерию «отсутствие рефлюкса» (ОР 2,98; 95% ДИ, 1,75-5,08), эквивалентны по риску рецидива ВТЭО (ОР 0,61; 95% ДИ, 0,3-1,25); поздние результаты (более 60 месяцев) превосходят по риску наступления ПТБ (ОР 0,6; 95% ДИ, 0,45-0,79), эквивалентны по критерию «полное открытие просвета вены» (ОР 1,11; 95% ДИ, 0,94-1,33), эквивалентны по риску развития ВТЭО (ОР 0,63; 95% ДИ, 0,34-1,18), сопоставимы по летальности (ОР 0,36; 95% ДИ, 0,1-1,3) [426].
Результаты другого систематического обзора свидетельствуют, что КТЛ по сравнению со стандартной АКТ снижает риск развития ПТБ (ОР 0,19; 95% ДИ, 0,07–0,48), формирования венозного рефлюкса (ОР 0,21; 95% ДИ, 0,09-0,53) и венозной обструкции (ОР 0,35; 95% ДИ, 0,17-0,34) [408].
- Перед КТЛ рекомендуется выполнить общий анализ крови (общий (клинический) анализ крови развернутый (016.003)), общий анализ мочи, определить АЛТ, АСТ креатинин (анализ крови биохимический общетерапевтический (B03.016.004)), АЧТВ (коагулограмма (ориентировочное исследование системы гемостаза) (B03.005.006), антитромбин III (определение активности антитромбина III в крови A09.05.047), фибриноген (исследование уровня фибриногена в крови (A09.05.050)), провести тест на беременность (исследование уровня хорионического гонадотропина (свободная бета-субъединица) в сыворотке крови (A09.05.090)) [204,395,397,427–431].
УДД 4 УУР С
Комментарий: перед КТЛ для определения противопоказаний и расчета риска кровотечения необходимы анализы крови и мочи [429].
Наиболее опасным осложнением катетерного тромболизиса является внутричерепное кровотечение или кровотечение, требующее хирургического вмешательства, прекращения терапии или переливания крови. Частота больших кровотечений при КТЛ колеблется от 2,2% до 3,3% и зависит от соответствия с показаниями и противопоказаниями к проведению тромболизиса [395,397,428].
Абсолютные противопоказания к КТЛ включают: активное внутреннее кровотечение или ДВС-синдром, цереброваскулярные события, включая транзиторные ишемические атаки, нейрохирургические вмешательства (интракраниальные, спинальные) или травма головы в течение последних 3 месяцев, известные внутричерепные опухоли, аневризмы и/или сосудистые мальформации противопоказания к антикоагулянтной терапии.
Относительные противопоказания включают: сердечно-легочная реанимация, большая операция, родоразрешение, большая травма, биопсия органа, операции на глазах в течение последних 10 дней, неконтролируемая гипертензия (систолическое давление> 180 мм рт. ст., диастолическое> 110 мм рт.), большое желудочно-кишечное кровотечение в течение последних 3 месяцев, известная, тяжелая аллергия на контрастный агент, антикоагулянт или тромболитический препарат, тяжелая тромбоцитопения, известный право-левый сердечный шунт или тромб левых отделов сердца, подозрение на инфицированный венозный тромб, средней тяжести или тяжелая почечная недостаточность, беременность или лактация, тяжелые нарушения функции печени, бактериальный эндокардит, диабетическая ретинопатия, геморрагический диатез [395,427,430,431].
- Во время катетерного тромболизиса рекомендуется динамический контроль уровня гемоглобина, тромбоцитов (общий (клинический) анализ крови развернутый (B03.016.003)) и концентрации фибриногена (исследование уровня фибриногена в крови (A09.05.050)), не реже 1 раза в 24 часа [427,429].
УДД 5 УУР С
Комментарий: лабораторный контроль необходим для динамической оценки риска кровотечения. При снижении уровня фибриногена менее 1,5 г/л рекомендуется уменьшение скорости введения тромболитического препарата в 2 раза, при снижении уровня фибриногена менее 1 г/л рекомендуется прекращение тромболизиса [427].
- Непрерывно проводить катетерный тромболизис рекомендуется не более 96 часов [395,401,432].
УДД 2 УУР В
Комментарий: по результаты систематического обзора средняя продолжительность проведения катетерного тромболизиса составляет 53,4 часа. Увеличение продолжительности манипуляции приводит к повышению частоты кровотечений [395,401,432].
- При выполнении катетерного тромболизиса пункционный доступ в целевые вены рекомендуется выполнять под УЗИ контролем [394,433].
УДД 2 УУР А
- Для проведения катетерного тромболизиса рекомендуется применять фармакологические препараты из группы тромболитических препаратов (АТХ группа: ферментные препараты, В01AD) [395,428,434–440].
УДД 2 УУР В
Комментарий: В одном сравнительном исследовании, где применялись тканевые активаторы плазминогена** (АТХ группа: ферментные препараты, B01AD02) в дозировке 1 мг/час в лечении ТГВ 24 конечностей ,было продемонстрировано более короткое время лечения для достижения приемлемого эффекта (24 часа против 33 часов, p <0,011) [434].
В другом сравнительном исследовании тканевые активаторы плазминогена** применялись в дозировке 0,5 мг/ч в лечении ТГВ 32 конечностей в лечении ТГВ 38 конечностей при этом не было продемонстрировано различий в отношении времени инфузии, частоты успеха, частоты осложнений, но использование тканевых активаторов плазминогена** было менее дорогостоящим [435].
Доза #алтеплазы** (АТХ группа: ферментные препараты, B01AD02) составляет 1-2 мг/ч, но не должна превышать 2 мг / ч. [406,427,440]. Препарат разводится на 100 мл 0,9% раствора натрия хлорида** (АТХ группа: растворы для внутривенного введения, солевые растворы, B05CB01), а скорость введения составляет 100 мл в час.
- Во время катетерного тромболизиса рекомендуется применять НФГ** и НМГ [393,436].
УДД 4 УУР С
Комментарий: антикоагулянтная терапия при проведении КТЛ обязательна. После окончания тромболитической инфузии показано продолжение антикоагулянтной терапии [393,436]. Антикоагулянты (АТХ группа: антитромботические средства, В01А) возможно использовать в составе литической смеси через катетер для проведения тромболизиса или отдельно через периферический венозный катетер [429]. Подкожное введение нефракционированного гепарина** исключено из-за сложности дозирования препарата и это может привести к обширным подкожным кровоизлияниям. Начальная дозировка НФГ** составляет 1000 МЕ в час с последующей коррекцией дозы для достижения АЧТВ в диапазоне 1,5–2,5 раза выше стартового значения (50-90 сек) [393,395,436]. Дозировка НМГ рассчитывается по актуальной массе тела пациента в соответствии с официальной инструкцией [393,395]. На сегодняшний день отсутствует убедительные данные в отношении оптимального препарата, его дозы и режима введения вовремя КТЛ. Предлагается применение терапевтических доз НФГ** или субтерапевтических доз НФГ** при использовании #алтеплазы** (АТХ группа: ферментные препараты, B01AD02).
- Рекомендуется рассмотреть целесообразность применения прерывистой пневмокомпрессии нижних конечностей (A15.12.002.001) (ППК) во время проведения КТЛ [441].
УДД 3 УУР В
Комментарий: в небольшом проспективном исследовании, включившем пациентов с подвздошно-бедренным ТГВ, доказана эффективность перемежающейся пневмокомпрессии, как адъювантного метода лечения к КТЛ. ППК обеспечивала более полноценное восстановление просвета вен, снижения частота развития ПТБ [441].
3.4.5.2. Фармакомеханическая тромбэктомия
- Фармакомеханическая тромбэктомия рекомендуется у пациентов с продолжительностью симптомов ТГВ не более 14 дней с целью сокращения времени тромболизиса и суммарной дозы тромболитического препарата при наличии соответствующего оборудования. [395,401,407,423,432,442–445].
УДД 1 УУР А
Комментарий: общим принципом всех методов чрескожной фармакомеханической тромбэктомии является комбинация механического разрушения и удаления тромба и локальное введение тромболитического препарата в зону воздействия. Основными аргументами в пользу ФМТ служат более короткие сроки лечения, меньшее количество тромболитического препарата и, связанная с этим, меньшая частота геморрагических осложнений, чем при КТЛ [401,442–444].
Исследование PEARL с применением реолитической тромбэктомии с участием 329 пациентов из 32 центров в США, показало, что в 73% случаях процедура ФМТ длилась в течение 24 часов, а 36% - 6 часов [423]. Это гораздо меньше, чем при КТЛ, где длительность может достигать 72 и даже 96 часов [395,401,432]. Вместе с тем убедительных данных о превосходстве ФМТ перед КТЛ в эффективности нет. В ретроспективном сравнительном исследовании эффективность ФМТ (с помощью технологии реолитической тромбэктомии) и КТЛ не имели статистически значимых различий. Частота полного лизиса составила 70% против 75%, частичного лизиса 30% против 25% соответственно. Так же потребность в баллонной ангиопластике и стентировании существенно не отличались (78% и 82%). Клиническое улучшение достигнуто в 72% при ФМТ и 81% при КТЛ [401]. Систематический обзор и мета-анализ по изучению эффективности различных методик эндоваскулярной дезобструкции не продемонстрировал различий между ФМТ и КТЛ по влиянию на риск развития ПТБ, на проходимость вен, риск развития геморрагических осложнений и общую смертность [445]. В рамках другого мета-анализа было показано, что применение усиленного ультразвуком тромболизиса в сравнении с КТЛ ассоциируется с улучшенной проходимостью вен (ОР, 4,67; 95% ДИ, 1,58-13,81) [407].
В РКИ ATTRACT представлены сравнительные результаты лечения острого проксимального ТГВ у 692 пациентов с длительностью симптомов не более 14 дней методами ФМТ и КТЛ, группу контроля составили пациенты, получавшие стандартную антикоагулянтную терапию. Хотя в период 6-24 месяца по факту наступления ПТБ межгрупповые различия не получены (47% в группе ФМТ и КТЛ и 48% в контрольной группе; ОР 0,96; 95 % ДИ, 0,82–1,11; р = 0,56), ФМТ и КТЛ позволили уменьшить риск среднетяжелой и тяжелой ПТБ с 24% в контрольной группе до 18% в группе ФМТ+КТЛ (ОР 0,73; 95% ДИ 0,54–0,98; P = 0,04). При этом риск кровотечений увеличился в сравнении с АТ (1,7% против 0,3%, р = 0,049), а частота рецидивов ВТЭО в ближайшие 24 месяца 12% в группе наблюдения против 8% в группе контроля р = 0,09) [397].
При применении реолитической ФМТ следует учитывать вероятность развития гемолиза и острой почечной недостаточности [446,447]. После процедуры требуется тщательное наблюдение и меры по предотвращению развития почечной недостаточности [448].
3.4.5.3. Механическая тромбэктомия
- Механическая тромбэктомия рекомендуется качестве альтернативы катетерному тромболизису и фармакомеханической тромбэктомии у пациентов с повышенным риском кровотечений и давностью ТГВ более 14 дней [419,449–457].
УДД 2 УУР B
Комментарий: на сегодняшний день существует большое количество разнообразных устройств для чрескожной механической тромбэктомии. Самое изученное устройство подобного типа предполагает тромбэкстракцию через боковые отверстия рабочего наконечника, при которой используется высокоскоростная вращающаяся спираль внутри гибкого атравматического катетера. Катетер устанавливается по проводнику, проходящему внутри спирали. Таким образом, всасывание тромба происходит за счет вихревых потоков при скорости вращения 40000 оборотов (эффект Бернулли), а продвижение внутри катетера происходит по принципу работы архимедовой спирали [449].
В регистр по данному устройству вошли 56 пациентов, с разным сроком ТГВ. Длительность симптомов менее 14 дней диагностирована у 40 пациентов (71%), длительность симптомов ТГВ более 14 дней у 13 (23 %), длительность более 28 дней - 3 (6 %). Технический успех составил 100%. Никаких осложнений или неисправностей, связанных с устройством, не зафиксировано. Средняя длительность лечения составила 94,2 мин (27-238 минут). В 4 случаях выполнен КТЛ глубокой бедренной вены. Связанные с процедурой тяжелые осложнения (повторная окклюзия целевой вены, длительная госпитализация из-за необходимости наложения артериовенозной фистулы) наблюдались у 8 (14%) пациентов. Незначительные побочные эффекты в виде гематомы места пункции произошли в 20%. Больших кровотечений не было. Всем пациентам выполнили стентирование, при этом, в среднем имплантировано 1,9 венозных стента на одно поражение. Проходимость стентов, определенная с применением транскутанного ультразвукового дуплексного сканирования, как >50% через 1 месяц составили 95%, через 6 месяцев 94%, через 12 месяцев 87%. Посттромботическая болезнь в легкой форме через 12 месяцев, (шкала CEAP ≤ 3 баллов и rVCSS ≤ 3 баллов) зафиксирована у 64% пациентов, среднетяжелая ПТБ (шкала CEAP> 3, но ≥4 баллов и rVCSS> 3, но ≤ 6), наблюдались у 36% пациентов. Тяжелая ПТБ (CEAP > 4, rVCSS > 6) не наблюдалось [450].
Похожие результаты получены в ретроспективном исследовании, в котором 30 пациентам с подвздошно-бедренным ТГВ выполнена ротационная тромбэктомия таким же устройством. Успешное удаление тромба и восстановление проходимости вен достигнуто у всех пациентов (100%). Частота стентирования составила 100%. Среднее время процедуры - 107,3 ± 33,9 мин. Никаких серьезных осложнений не произошло. Постпроцедурное течение пациентов во всех случаях протекало без осложнений, в 83,3% случаев выписка из больницы состоялась в течение 2 дней. Ранний ретромбоз стента произошел в течение 1 недели у 3 пациентов. Уровень стента в сроке наблюдения 22,3 ± 14,2 месяца по оценке с помощью ультразвукового дуплексного сканирования составил 86,7%. Авторы делают заключение о высокой безопасности и эффективности механической тромбэктомии этим устройством [451].
Другое устройство вакуумной катетерной тромбэктомии с расширенной канюлей для венозного дренажа может использоваться для удаления свежих объемных тромботических масс, эмболов в верхней полой вене, нижней полой вене, подвздошно-бедренном сегменте, в правом желудочке сердца и вегетаций в правом предсердии. В небольшом ретроспективном исследовании показана польза применения этого устройства у 16 пациентов с внутрисердечными тромботическими массами (68,8%), тромбоз нижней полой вены (56,3%) и катетер ассоциированный тромбоз (43,8%). У 7 (43,8%) пациентов была ТЭЛА. Смертность во время процедуры составила 0%, а внутрибольничная летальность - 12,5% при среднем сроке наблюдения 14 дней. Легочных кровотечений, инсультов, инфарктов миокарда не было. 62,5% пациентов имели значительное падение гемоглобина, что потребовало переливания крови, но не было эпизода явного кровотечения. Авторы делают заключение об устройстве, как о разумной альтернативе хирургической тромбэктомии у пациентов с объёмными тромбами с высоким риском ТЭЛА [458].
Известно еще одно похожее устройство, применяющееся при ТГВ, состоящее из катетера, сепаратора и вакуумного насоса. Для лечения венозного тромбоза применяется катетер диаметром 8F, через который можно аспирировать кровь в объеме до 160 мл/с. Представлены результаты применения этого устройства у 10 пациентов. Показаниями для лечения были ТГВ (n = 4), рецидивирующий ТГВ (n = 1), тромбоз стента (n = 3), сильное экстравазальное сужение нижней полой вены с ее тромбозом и обструкция НПВ из-за инвазии опухолью печени. У пяти пациентов верифицирован синдром Мэй-Тернера. Аспирационная тромбэктомия была технически успешной у шести пациентов. Из четырех пациентов, у которых тромбэктомия не увенчалась успехом, трое успешно прошли дальнейшее лечение с помощью КТЛ. Рецидив после успешной аспирации наблюдался у двух пациентов. У одного пациента развилась тромбоэмболия легочной артерии, которая не потребовала дополнительного лечения. Авторы делают заключение о техническом успехе в 60% при остром подвздошно-бедренном тромбозе и тромбозе полых вен. В качестве новой терапии это позволяет избежать необходимости тромболизиса в большинстве отдельных случаев без осложнений, связанных с кровотечением, и является многообещающим методом лечения острого ТГВ [459].
Так же имеются данные о применении устройства, позволяющего выполнять одновременно: инспирацию в тромб 0,9% раствора натрия хлорида** под давлением с целью его размягчения и с последующей аспирацией тромботических масс. На конце такого катетера имеется несколько боковых отверстий для распыления и торцевое отверстие для аспирации. Преобладающим риском этого метода является смещение и возможная эмболия. Существуют только описание единичных случаев применения данного метода при ТГВ [460]. В литературе упоминается о возможности прямой мануальной аспирации шприцом через катетер с боковым или торцевым отверстием [461].
- Механическая катетерная тромбэктомия рекомендуется при невозможности тромболитической терапии [85,419,449–460].
УДД 2 УУР B
Комментарий: в ряде исследований тромболитический препарат не применяли вовсе, при этом первичный успех находился в пределах 60-100%. При невозможности проведения тромболизиса механическая тромбэктомия может рассматриваться как альтернатива открытой тромбэктомии [85,449–460].
В шести исследованиях проведено сравнение результатов лечения 195 пациентов которым проведена механическая тромбэктомия с КТЛ (МТ+КТЛ) и 193 пациентов, которым выполнен только КТЛ. Частота частичного лизиса тромба была выше в группе МТ+КТЛ (ОР 2,64; 95% ДИ, 1,34-5,21; р = 0,005), тогда как частота полного лизиса не была статистически значима в обеих группах (ОР 1,38; 95% ДИ. 0,87–2,18; р=0,17). Разница сумм баллов по шкале Villalta в двух группах во время последующего наблюдения не имела статистической значимости (ОР, 0,50; 95% ДИ, 0,34-1,34; р = 0,24). Доза тромболитического препарата в группе МТ+КТЛ была намного ниже, чем в группе КТЛ (стандартная средняя разница -0,98; 95% ДИ, -1,59 до –0,38; P=0,001), а время проведения процедуры было короче в группе МТ+КТЛ (средняя разница - 16,94; 95% ДИ, от -22,38 до -11,50; р <0,001). Не было значимой разницы в риске больших кровотечений (ОР, 1,20; 95% ДИ, 0,50- 2,90; р=0,24) или легочной эмболии (ОР, 1,18; 95% ДИ, 0,16-8,73; P =0,87) [385].
По результатам систематического обзора с мета-анализом, объединившего результаты 17 исследований с участием 117 пациентов, применение механической тромбэктомии в сравнении с КТЛ не отличалось по показателям технического успеха, риску развития ПТБ и рецидива ВТЭО. Между тем, первичная проходимость сосуда была выше, а риск развития больших кровотечений ниже при использовании механической тромбэктомии. Следует отметить, что механические методы ассоциировались с увеличенным риском развития гематурии [419]. В другом мета-анализе, объединяющем данные из 16 исследований с участием 1170 пациентов также было выявлено снижение риска развития больших кровотечений, а также уменьшение риска развития ПТБ при использовании механической тромбэктомии в сравнении с КТЛ [419] .
- При неудовлетворительном техническом результате механической катетерной тромбэктомии (резидуальный стеноз более 50%) рекомендуется дополнительно выполнить катетерный тромболизис (при отсутствии показаний), баллонную ангиопластику и стентирование [462].
УДД 2 УУР В
Комментарий: в мета-анализ были включены 35 исследований, 1323 пациента, которым выполнены различные методики механической тромбэктомии/тромбодеструкции с/или без дополнительного катетерного тромболизиса. В объединенном анализе доля пациентов, перенесших успешный тромболизис с частичным или полным лизисом, составила 93,4% (95% ДИ, 90,1–95,6) и 67,0% (95% ДИ, 59,1–76,4), соответственно. Суммарная доля 30-дневного ретромбоза составила 11,9% (95% ДИ, 6,7-20,3). Смертность, связанная с 30-дневным ТГВ, составила 2,4% (95% ДИ, 1,6–3,7%). Периоперационная частота больших кровотечений и тромбоэмболии легочной артерии составила 4,6% (95% ДИ, 2,9–7,3%) и 3,8% (95% ДИ, 2,5–6,7%), соответственно. За время наблюдения частота поздних ретромбозов составила 10,7% (95% ДИ, 8,7–13,0); средний период наблюдения составил от 2,8 до 32,1 мес). У примерно 15,1% (95% ДИ, 9,6–22,9%) пациентов развился посттромботический синдром во время наблюдения (средний период наблюдения варьировал от 3,8 до 29,6 месяцев).
3.4.5.4. Дезобструкция при тромбозах НПВ
Принципы и методы внутрисосудистой дезобструкции при тромбозе НПВ в целом аналогичны таковым при проксимальных ТГВ. Используются указанные выше катетерные методики тромболизиса или фармакомеханической тромбэктомии [387,463–465]. Более чем, у половины пациентов после эндоваскулярных методов дезобструкции при тромбозе илиокавального сегмента, в т.ч., при тромбозе кава-фильтров, требуется выполнение ангиопластики и стентирования [387,463,464,466].
- Эндоваскулярная дезобструкция при тромбозах НПВ рекомендуется только при исключении опухолевого поражения НПВ, в срок до 14 суток с момента начала заболевания, у активных больных при длительной ожидаемой продолжительности жизни [387,463–466].
УДД 4 УУР С
- Рекомендуется рассмотреть целесообразность имплантации съемного кава-фильтра с последующим его удалением у пациентов, которым планируется катетерный тромболизис при тромбозе илиокавального сегмента с целью уменьшения вероятности развития ТЭЛА [467].
УДД 2 УУР А
Комментарий: использование кава-фильтров при КТЛ у пациентов с тромбозом НПВ служит предметом дискуссии [399,463,464,467–472]. В исследовании FILTER-PEVI (Filter Implantation to Lower Thromboembolic Risk in Percutaneous Endovenous Intervention) частота симптомной ТЭЛА оказалась в 8 раз ниже в группе пациентов с предварительно имплантированными КФ (1,4% против 11,3%, р=0.048) [467]. Вместе с тем, это не оказало влияния на летальность и общую частоту осложнений. В других подобных исследованиях было показано, что отдаленные результаты дезобструкции при илиофеморальных и илиокавальных тромбозах значительно улучшились при использовании ангиопластики и стентирования, а также своевременного съема кава-фильтров [399,468,469,472]. В реальной клинической практике большинство специалистов склоняются к имплантации съемных КФ перед КТЛ при высоком риске ТЭЛА, в том числе при «нестабильных» тромбах НПВ [463,464,469]. Дополнительным показанием для установки КФ является исходная массивная симптомная ТЭЛА с дисфункцией правых камер сердца, или случаи низкого кардиопульмонального резерва у пациентов с тяжелой сопутствующей патологией или перенесенных ранее ВТЭО [468].
- Пациентам с тромбозом дистальнее нижней полой вены перед эндоваскулярным лечением не рекомендуется рутинная имплантация временного кава-фильтра [267,392–397].
УДД 2 УУР А
Комментарий: по данным систематического обзора, включившего 19 РКИ (1943 пациентов) КТЛ и ФМТ не ассоциируются с увеличением частоты ТЭЛА, в т.ч., летальной [267]. Частота ТЭЛА во время КТЛ не превышает таковую при АКТ [392,394–397]. В двух исследованиях (103 и 69 пациентов), после КТЛ и других способов дезобструкции не было выявлено никаких симптомов ТЭЛА [393,399].
- Любые методы дезобструкции нижней полой вены рекомендуется выполнять в специализированных стационарах, в условиях рентген-операционных, при наличии соответствующего расходного материала, в том числе для ангиопластики и стентирования НПВ при остаточных стенозах [1,85,387,399,456,457,463–466,468–470,472,473].
УДД 3 УУР С
3.4.6. Открытая тромбэктомия
- Открытую тромбэктомию при окклюзивных илиофеморальных ТГВ с целью дезобструкции рекомендуется выполнять только при длительности симптомов ТГВ до 14 дней, угрозе потери конечности или крайней выраженности симптомов и проявлений ТГВ, невозможности проведения эндоваскулярных методов дезобструкции и при условии наличия у хирурга опыта выполнения таких оперативных вмешательств [362,408,427].
УДД 1 УУР А
Комментарий: открытая тромбэктомия при окклюзивных илиофеморальных ТГВ является одним из вмешательств в рамках так называемой стратегии раннего удаления тромба [387,405,474], что позволяет снизить риск развития ПТБ [408]. Однако показания к ее выполнению сегодня сильно сужены, прежде всего, в результате развития методов эндоваскулярной дезобструкции. Вмешательство может быть выполнено у отдельных пациентов при наличии противопоказаний к тромболизису или невозможности выполнения внутрисосудистых вмешательств, в том числе у пациентов с флегмазией и угрозой потери нижней конечности, когда важно быстро восстановить проходимость глубоких вен подвздошно-бедренного сегмента [408,427,474]. Как и другие методы дезобструкции вмешательство следует выполнять в рентген- или гибридной операционной с выполнением рентгенэндоваскулярного контроля на всех этапах операции, и при необходимости – ангиопластики и стентирования для восстановления адекватного оттока по подвздошным венам.
Тромбэктомия эффективна в остром периоде ТГВ для быстрого устранения обструкции подвздошно-бедренного сегмента глубоких вен и способствует сохранению функции клапанов вен. Результаты прямого сравнения с антикоагулянтной терапией представлены в 10 исследованиях [475–484], только одно из которых было проспективным рандомизированным исследованием [481]. Все исследования были небольшими, от 15 до 192 пациентов с периодом наблюдения от 6 месяцев до 10 лет.
В систематический обзор и мета-анализ, в котором сравнивалась эффективность стандартной АКТ, хирургической тромбэктомии и КТЛ в лечения острого подвздошно-бедренного ТГВ, вошло 15 исследований. По сравнению с АКТ, тромбэктомия была связана со статистически значимым снижением риска развития ПТБ (ОР 0,67; 95% ДИ, 0,52-0,87), венозного рефлюкса (ОР 0,68; 95% ДИ, 0,46-0,99) и тенденция к снижению риска венозной обструкции (ОР 0,84; 95% ДИ, 0,60–1,19). Как и во всех методах раннего удаления тромба, при планировании тромбэктомии из подвздошно-бедренного сегмента требуется уделить тщательное внимание отбору пациентов и индивидуальной оценке рисков и преимуществ, а также предпочтений самого пациента [408].
3.4.7. Антикоагулянтная терапия при дезобструкции венозного русла
- После применения любого метода дезобструкции, со стентированием или без него, рекомендуется АКТ по общим принципам определения дозировок и продолжительности [275,485,486].
УДД 2 УУР А
- При определении характера и длительности АКТ после дезобструкции проксимальных вен в сочетании с ангиопластикой и стентированием рекомендуется ориентироваться на характер тромботического процесса (спровоцированный/неспровоцированный), наличие его осложнений (ТЭЛА), наличие других факторов риска (тромбофилии, злокачественные новообразования и др.), а также на опыт оперирующего хирурга [85,276,470,487–490].
УДД 3 УУР В
Комментарий: после стентирования магистральных вен АКТ не должна отличаться от таковой, использующейся при изолированном консервативном лечении проксимальных ТГВ [85,469]. По результатам Дельфийского консенсуса 106 экспертов по стентированию магистральных вен (с ежегодным опытом не менее 100 вмешательств) отмечено, что АКТ необходима на срок 6-12 месяцев после стентирования, НМГ являются препаратами выбора в первые 2-6 недель после стентирования, АКТ на неопределенно долгий срок (пожизненно) показана пациентам с рецидивным ТГВ, отмена АКТ после 6-12 месяцев ее проведения может быть рассмотрена у пациентов с единственным эпизодом проксимального ТГВ [489]. Относительно роли антиагрегантной терапии после венозного стентирования консенсуса достичь не удалось, хотя 55% экспертов выступили за длительную антиагрегантную терапию у пациентов со стенозами подвздошных вен экстравазального характера [489]. В систематическом обзоре указано, что лишь в 26% исследований пациентам назначали дополнительная Антиагрегантная терапия [490].
3.4.8. Стентирование после дезобструкции венозного русла
- Пациентам с ТГВ рекомендуется рассмотреть целесообразность дополнительного выполнения баллонной ангиопластики и/или стентирование остаточных тромботических или обструктивных поражений илиокавального сегмента непосредственно после дезобструкции с целью повышения эффективности дезобструкции и снижения риска ретромбоза [430,487,490–495].
УДД 2 УУР А
Комментарий: стентирование вен илиокавального сегмента после их дезобструкции высокоэффективно и безопасно [85,387,490,494,495]. По данным мета-анализов эффективность стентирования остаточных стенозов подвздошно-бедренного сегмента после дезобструкции при острых проксимальных ТГВ достигает 94,5% и более, при низкой частоте развития осложнений менее 1% [490,494,495].
Показаниями к адъювантному стентированию после выполнения различных методов дезобструкции являются: остаточный стеноз, ограничивающий кровоток (в различных исследованиях величина такого стеноза обычно расценивается как 50% по данным ВСУЗИ или многопроекционной флебографии); видимый застой контраста; контрастирование венозных коллатералей; сохранение дефекта контрастирования в просвете сосуда; визуализируемая внешняя компрессия вены [450,462,469,496].
По данным различных РКИ ангиопластика или стентирование илиокавального сегмента после дезобструкции ассоциированы с меньшей частотой ретромбозов [490]. При этом технический успех этой манипуляции составляет 94%, а проходимость стента через 12 месяцев достигает 87% [494]. Общепринятыми показаниями для ангиопластики и стентирования после дезобструкции проксимальных вен при острых ТГВ являются резидуальные стенозы подвздошных вен или НПВ (50% и более) [387,430,487,491,493]. При проведении ангиопластики и стентирования пункционный доступ осуществляют через бедренную или подколенную вены, а в случае необходимости дополнительно выполняют трансюгулярный доступ. В ходе стентирования производят предилятацию стенозов, оценивают диаметр и число необходимых стентов. Для НПВ обычно используют стенты 18-24 мм, для общей подвздошной вены – 14-18 мм, для наружной подвздошной вены – 12-16 мм [488,491]. Вмешательство проводят, как правило, без общей анестезии, в ряде случаев требуется внутривенная анестезия. При имплантации двух стентов необходим «перехлест» между ними на 1,5 – 2 см для профилактики рестеноза. Используют специальные приемы для точной установки венозных стентов при высоких поражениях илиофеморального сегмента, а также при стентировании НПВ через имплантированный ранее кава-фильтр [470,488]. Осуществляют постдилятацию перед контрольной флебографией или внутрисосудистым УЗИ. Критериями эффективности стентирования при контрольной флебографии служат спонтанный кровоток в стенозированном участке, отсутствие контрастирования коллатералей [69, 125].
Есть мнение о том, что одним из недостатков проведенных рандомизированных клинических исследований ATTRACT и CaVenT, является именно низкий процент проведения стентирования после внутрисосудистой дезобструкции проксимальных глубоких вен (выполнены у 28% и 18% пациентов в этих исследованиях, соответственно), что не позволило продемонстрировать преимущества внутрисосудистой дезобструкции над изолированной АКТ [487].
Одной из частых причин резидуальной экстраорганной обструкции после удаления тромба из подвздошного сегмента глубоких вен является синдромы Мей-Тернера и Коккета [497,498]. Так же стенотическое поражение может быть также связано как с экстравазальным сдавлением (новообразованиями различного генеза, кистами, пакетами лимфатических узлов и т.п.), так и с интравазальными препятствиями кровотоку (резидуальные тромботические массы, посттромботические изменения стенки вен при рецидивирующем ТГВ, имплантированные кава-фильтры) [487,491,493,499].
По данным РКИ у пациентов с выполненной дезобструкцией в сочетании со стентированием первичная проходимость при последнем контрольном визите через 24 месяца составили 87,5% против 29,6% и показателем проходимости через год 86,0% против 54,8% соответственно [492].
По результатам мета-анализа, выполненного Razavi et al. (2015), технический успех стентирования после дезобструкции глубоких вен при острых ТГВ составляет 94%, первичная проходимость через 12 месяцев - 87%, вторичная проходимость через 12 месяцев – 89% [494]. По данным одного из систематических обзоров, выполненного Taha et al., (2018), средний уровень проходимости стентов в данных ситуациях составляет 87,8% с частотой ретромбозов 8% при сроке наблюдения в отдаленном периоде 12-19,7 месяцев [490]. Частота развития посттромботической болезни вен нижних конечностей после успешной дезобструкции с последующим стентированием остаточных стенозов составляет лишь 14,6%. Необходимость реинтервенций вследствие рестенозов в самих стентах или в результате их экстравазальной компрессии требуется, по данным различных авторов, у 2-25% пациентов в отдаленном периоде [490,493–495,499].
- Для стентирования глубоких вен илиофеморального и илиокавального сегментов после их дезобструкции рекомендуется использование универсальных стентов или специальных венозных самораскрывающихся стентов [85,487,490–495,499].
УДД 2 УУР А
Комментарий: в настоящий момент широко используются универсальные артериальные стенты для имплантации в магистральных венах, Также разработаны специфические модели стентов для применения в венозной позиции [487,493,494]. По результатам систематического обзора и мета-анализа, достоверных различий по эффективности при использовании специальных венозных и универсальных стентов не выявлено [500]. Следует иметь в виду, что до сих пор не опубликованы финальные результаты многих регистрационных исследований по изучению эффективности и безопасности специальных венозных стентов.
- Не рекомендуется проводить стентирование глубоких вен бедренно-подколенного сегмента [400,501].
УДД 4 УРР С
Комментарий: стентирование в бедренно-подколенном сегменте по эффективности не отличается от стандартной АКТ [400].
3.5. Хирургическая и эндоваскулярная профилактика ТЭЛА
3.5.1. Способы хирургической и эндоваскулярной профилактики ТЭЛА
Методом, направленным исключительно на профилактику ТЭЛА является имплантация кава-фильтра. Методы хирургической дезобструкции глубоких вен (открытая и эндоваскулярная тромбэктомия) направлены на предотвращение ТЭЛА и профилактику тяжелых форм ПТБ.
3.5.1.1. Эндоваскулярная профилактика ТЭЛА
Имплантация кава-фильтров является эффективным методом хирургической профилактики ТЭЛА [1,387]. Имплантация кава-фильтров характеризуется рисками развития осложнений во время оперативного пособия (кровотечение, гематома), так и осложнениями в отдаленном периоде (тромбозы кава-фильтров, перфорации стенки НПВ, тяжелые формы ПТБ нижних конечностей) [1,85,279,387,465,502,503]. Поэтому, показания к имплантации кава-фильтров должны быть строго определены и документированы, а выбор конкретного кава-фильтра для имплантации, по возможности, должен учитывать его конструктивные особенности.
- У пациентов с ТГВ, получающих полноценную антикоагулянтную терапию, использование кава-фильтров не рекомендуется [1,85,279,387,465,471,502,504–507].
УДД 1 УУР А
Комментарий: рандомизированные клинические исследования PREPIC и PREPIC II, сравнившие имплантацию кава-фильтра в дополнение к полноценной терапии антикоагулянтами у пациентов с ТГВ и ТЭЛА не выявили достоверного влияния интервенции на риск рецидива ВТЭО или общую смертность [471,508,509]. В исследовании PREPIC у пациентов с проксимальным ТГВ и высокой вероятностью легочной эмболии наблюдалось достоверное снижение риска рецидива ТЭЛА (преимущественно бессимптомной) в течение первых 12 суток лечения на фоне имплантации кава-фильтра (1,1% против 4,8%). При 2-летнем сроке наблюдения достоверность этих различий исчезала (3,4% против 6,3%). При наблюдении за пациентами в течение 8 лет было обнаружено статистически значимое снижение риска рецидива ТЭЛА (6,2% против 15,1%) параллельно с увеличением риска рецидива ТГВ (35,7% против 27,5%) без отличий по общему числу ВТЭО, ТЭЛА-ассоциированной и общей летальности. В исследовании PREPIC II у пациентов с тяжелой легочной эмболией имплантация съемного кава-фильтра в дополнение к терапии антикоагулянтами не оказала влияния на риск рецидива ВТЭО в течение 3 месяцев наблюдения (3,0% против 1,5%). Таким образом, авторами обеих работ был сделан вывод об отсутствии пользы от имплантации кава-фильтра у пациентов, получающих полноценную терапию антикоагулянтами. По данным мета-анализа 7 рандомизированных клинических исследований с участием 127 пациентов имплантация кава-фильтра снижает риск рецидива ТЭЛА в течение 3 мес. (ОР, 0,17 95% ДИ, 0,04-0,65) и всего периода наблюдения (ОР, 0,42; 95% ДИ, 0,25-0,71), но не влияет на общую или ТЭЛА-ассоциированную смертность [504].
- Имплантацию временного кава-фильтра рекомендуется рассмотреть у пациентов с проксимальным тромбозом глубоких вен при наличии абсолютных противопоказаний к антикоагулянтной терапии [467,504,510].
УРР 4 УДД C
Комментарий: на сегодняшний день отсутствуют данные рандомизированных клинических исследований по оценке эффективности и безопасности имплантации кава-фильтров у пациентов, имеющих противопоказания к терапии антикоагулянтами. Принимая во внимание относительную эффективность имплантации фильтра для снижения риска развития ТЭЛА в остром периоде, пациенты с противопоказаниями к антикоагулянтам могут иметь преимущество от интервенции [504]. По данным ретроспективного анализа страховых заявок, имплантация фильтра у пациентов с активным кровотечением ассоциировалась со снижением 30-дневной смертности на 32% [510]. При этом следует отдавать предпочтение съемным моделям с максимально быстрым их удалением после возобновления адекватной терапии антикоагулянтами.
- Имплантацию кава-фильтра на фоне проведения терапии антикоагулянтами рекомендуется рассмотреть у пациентов с индивидуально высоким риском развития фатальной ТЭЛА [84,85,126,279,465,511].
УРР 5 УДД С
Комментарий: на сегодняшний день отсутствуют инструменты для определения риска ТЭЛА и вероятности летального исхода при ее развитии у пациента с ТГВ. Чаще всего в международных клинических рекомендациях обсуждается вопрос имплантации кава-фильтра при прогрессировании или рецидиве ВТЭО на фоне введения лечебных доз антикоагулянтов; при массивной ТЭЛА, низком кардиопульмонарным резерве и резидуальном ТГВ, при наличии крупного флотирующего тромба в проксимальных венах [84,85,126,279,465,511]. Для всех описанных ситуаций абсолютная польза интервенции не была доказана, поэтому адекватная терапия антикоагулянтами является приоритетной. Прогрессирование и рецидив ТГВ на фоне введения антикоагулянтов обсуждают в соответствующем разделе. При наличии достоверных сведений за прогрессирование или рецидив тромбоза с возникновением угрозы развития фатальной ТЭЛА имплантация фильтра может быть рассмотрена на период оптимизации терапевтических подходов. Следует иметь в виду, что имплантация фильтра не решает проблем антикоагуляции. Определенная польза в виде увеличения шанса на эмболию в кава-фильтр была показана у пациентов с проксимальным ТГВ и низким кардиопульмонарным резервом при систолическом давлении в легочной артерии более 50 мм.рт.ст. [512]. В отношении флотирующего тромбоза проведенные ранее исследования показали отсутствие дополнительного риска развития ТЭЛА в сравнении с окклюзивным поражением вены той же локализации [91]. В связи с этим современные международные рекомендации не поддерживают имплантацию кава-фильтра по причине флотации. Взаимосвязь между риском развития симптоматической или фатальной ТЭЛА и длиной флотирующей верхушки не была доказана. В единственном ретроспективном анализе результатов лечения ТГВ у 78 пациентов было продемонстрировано повышение частоты развития ТЭЛА при наличии флотирующего тромбоза с длиной головки >5 см в сравнении с отсутствием флотации (3 случая эмболии на 5 флотирующих тромбозов против 4 случаев эмболии на 73 не флотирующих тромбоза) [513]. При ретроспективном анализе медицинских записей было выявлено, что факт наличия флотирующей головки длиной до 7 см, 7-10 см и более 10 см не увеличивает вероятность эмболии в кава-фильтр в сравнении с фильтрами, установленными по другим показаниям (противопоказания и неэффективность антикоагулянтов) [512]. Таким образом, на протяжении многих лет имплантация кава-фильтра при флотирующей тромбозе с длиной верхушки более 5 см поддерживалась только авторами рекомендаций Американского венозного форума при отсутствии какой-либо серьезной доказательной базы [387]. На сегодняшний день флотирующий тромбоз вне зависимости от длины верхушки не может рассматриваться в качестве показания к хирургической профилактике ТЭЛА. Но в отдельных ситуациях на основании комплексной оценки всех факторов риска, когда вероятность фатальной ТЭЛА в результате отрыва и миграции флотирующей верхушки тромба расценивается чрезвычайно высоко, может быть рассмотрен вопрос об имплантации кава-фильтра. При этом следует помнить, что методика не обладает абсолютной эффективностью, риск фатальной ТЭЛА после имплантации фильтра составляет 0,9-1,7% [514], его фильтрующая способность зависит от размера сгустка [515], а для развития симптоматической окклюзии ветвей легочной артерии может быть достаточно микроэмболов и микроагрегатов [516].
- При определении показаний к имплантации кава-фильтров рекомендуется индивидуальная оценка ожидаемой пользы и возможного вреда от вмешательства с учетом риска рецидива ВТЭО, кардиопульмонального статуса (резерва) больного, возможности проведения/эффективности проводимой АКТ [465,506,517,518].
УДД 5 УУР С
Комментарий: Общество по Интервенционной Радиологии (Society of Interventional Radiology – SIR) представило детальный анализ большинства из упомянутых выше показаний к имплантации кава-фильтров, ключевой точкой которого является индивидуальная оценка пользы и риска от установки фильтра [465]. В частности, такие абсолютные показания к имплантации кава-фильтров, как противопоказания к антикоагулянтной терапии, ее неэффективность или осложнения, должны быть тщательно уточнены в конкретной клинической ситуации. Большинству пациентов при наличии противопоказаний к АКТ, возникшим в первые недели после течение первых 4 недель после манифестации ТГВ и/или ТЭЛА, целесообразно имплантировать кава-фильтр. Напротив, при возникновении противопоказаний к АКТ на фоне ее продленного характера, имплантация КФ в подавляющем большинстве случаев нецелесообразна. Ситуации, связанные с осложнениями и неэффективностью, назначенной АКТ, в том числе при рецидивах ВТЭО, требуют ревизии ранее назначенной терапии – многие подобные случаи могут быть потенциально скорректированы медикаментозно (неправильные дозировки препаратов, межлекарственные взаимодействия и т.п.).
- Рекомендуется отдавать предпочтение съемным моделям КФ, которые могут быть удалены при исчезновении высоких рисков рецидива ВТЭО [1,85,387,465,507,518].
УДД 5 УУР С
Комментарий: в отличие от постоянных КФ, извлекаемые фильтры можно удалить, как только снизится риск тромбоэмболии у пациента [519]. Существует противоречивые данные о связи съемного или постоянного типа КФ с более высоким уровнем осложнений [519,520]. Перспективными представляются конвертируемые фильтры. В одном варианте такой фильтр вместо удаления может быть активно «преобразован» в открытую, не фильтрующую конфигурацию, подобную сосудистому стенту. Другие типы конструкции конвертируемых фильтров подразумевают «самопревращение» примерно через 60 дней, когда снижается риск развития ТЭЛА [521]. Конвертируемые фильтры разрабатываются с целью ограничения потребности в инвазивных методах извлечения [522].
- В ситуациях, когда при флотирующих тромбозах НПВ не остается места (площадки) для безопасной имплантации кава-фильтра в инфраренальный отдел, рекомендуется выполнить внутрисосудистую механическую тромбэктомию, либо открытое вмешательство [1,387,456,457,523–530].
УДД 4 УУР В
Комментарий: в РФ достаточно широкое применение получила методика эндоваскулярной механической тромбэктомии с помощью специального устройства (тромбоэкстрактора) с рабочей частью по типу «капюшона» [1,456,457]. Тромбоэкстрактор вводят яремным доступом, «капюшон» открывают над флотирующим тромбом НПВ, «надевая» затем устройство на всю длину тромба. Далее специальной режущей нитью-петлей срезают тромб у его основания. Завершением эндоваскулярной механической тромбэктомии является, как правило, имплантация кава-фильтра в освобожденный инфраренальный отдел НПВ. Технически вмешательство успешно в 94% случаев и более [457]. В подобных ситуациях также применяют систему для эндоваскулярной аспирационной механической тромбэктомии [387,465,524,529,530]. Вмешательство проводят под общей анестезий, вводя две канюли, аспирационную и для реинфузии при осуществлении вено-венозного шунтирования. Наконечник аспирационной канюли имеет воронку, которая приводится в действие баллоном, расширяется для увеличения площади аспирации, и производит непосредственно аспирацию флотирующего тромба. Тромботические массы аккумулируются в специальном фильтре. В конце процедуры, как правило, устанавливается кава-фильтр. Технически процедура успешна в 73 - 100% случаев.
- У пациентов с имплантированным кава-фильтром характер, длительность и режим терапии антикоагулянтами рекомендуется определять по общим правилам, как при отсутствии кава-фильтра [84,85,126,279,465,531]
УДД 2 УУР B
Комментарий: на сегодняшний день отсутствуют сведения, подтверждающие излишнюю тромбогенность кава-фильтров [532], которая требовала бы изменения режима или длительности терапии антикоагулянтами. По результатам мета-анализа 9 исследований с участием 1369 пациентов применение антикоагулянтов после имплантации кава-фильтра не оказывало влияния на риск рецидива ВТЭО [531].
- У пациентов с ТГВ хирургические методы с целью профилактики ТЭЛА (перевязка, клипирование, пликация вен), помимо имплантации кава-фильтра, не рекомендуются для применения в рутинной клинической практике [84,85,126,279,511]
УДД 5 УУР С
Комментарий: на сегодняшний день отсутствуют достоверные сведения об эффективности и безопасности применения подобных методов. Следует иметь в виду, что односторонняя парциальная окклюзия вен (перевязка поверхностной бедренной вены, пликация подвздошных вен) не может защитить пациента от легочной эмболии с источником на контрлатеральной конечности или в венах таза. Подобные вмешательства могут быть рассмотрены при чрезвычайно высокой угрозе развития фатальной ТЭЛА и при наличии объективных показаний к имплантации кава-фильтра, но отсутствии технических возможностей для этого.
3.6. Диагностика и лечение рецидива ТГВ
Под рецидивом ТГВ следует понимать повторное возникновение тромбоза прежней или отличной от прежней локализации, сопровождающееся появлением характерных симптомов, после лечения первичного эпизода ВТЭО в острую фазу, т.е. в течение первых 2-х недель от момента начала заболевания [533]. При этом под успешным лечением следует понимать, в первую очередь, симптоматическое улучшение. Усиление старых симптомов, появление новых симптомов и признаков дальнейшего ухудшения состояния в течение первых 2 недель терапии принято называть прогрессированием ВТЭО (см. соответствующий раздел). При этом отсутствие клинического улучшения без прогрессирования старых, появления новых симптомов и без признаков поражения ранее интактных венозных сегментов в остром периоде заболевания не следует трактовать, как прогрессирование. Выделяют ранний и поздний рецидивы, развивающиеся, соответственно, в течение первых 3 мес. и более чем через 3 мес. от начала лечения. Таким образом, ранний рецидив ВТЭО развивается в период обязательной длительной терапии антикоагулянтами (рецидив на антикоагулянтах), а поздний рецидив может регистрироваться, как в период продленной терапии, так и после ее завершения.
- К ранним рецидивам ТГВ рекомендуется относить повторное возникновение симптоматического тромбоза прежней (повторная окклюзия ранее реканализованной вены) или отличной (окклюзия ранее интактной вены) локализации в течение первых 3 месяцев у пациента, уже получающего терапию антикоагулянтами по поводу ранее выявленного ТГВ [533].
УУД 5 УУР С
Комментарий: следует критически относиться к результатам повторных инструментальных исследований, валидность которых в рамках оценки эффективности антикоагулянтной терапии окончательно не изучена. Так по данным ряда работ при выполнении повторного УЗАС в период от 7 дней до 6 месяцев признаки увеличения протяженности тромбоза могут быть обнаружены в 3-38% случаев, что не всегда отражает неэффективность проводимой терапии [534]. Изменения эхографической структуры тромба в процессе естественной его эволюции (изменение эхогенности, протяженности, появление флотации) достоверно не описаны и не могут использоваться для верификации рецидива ТГВ в отсутствии клинического подозрения. Таким образом, результаты повторных инструментальных исследований следует трактовать в контексте наличие клинических признаков рецидива и личного риска ВТЭО.
- К поздним рецидивам ТГВ рекомендуется относить повторное возникновение симптоматического тромбоза прежней (повторная окклюзия ранее реканализованной вены) или отличной (окклюзия ранее интактной вены) локализации спустя 3 месяца и более у пациента, продолжающего или завершившего терапию антикоагулянтами по поводу ранее выявленного ТГВ [533].
УУД 5 УУР С
- Для диагностики рецидива ТГВ у пациента с наличием клинического подозрения рекомендуется использовать триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное) (A04.12.015.001), определение концентрации Д-димера в крови (A09.05.051.001), КТ-ангиографию (компьютерно-томографическая ангиография сосудов нижних конечностей (A06.12.053)) и МР-венографию (магнитно-резонансная венография (одна область) (A05.12.005)) [85,533,535–537].
УУД 2 УУР С
Комментарий: диагностика рецидива ТГВ представляет собой непростую задачу, так как его симптомы могут быть невыраженными и походить на симптомы ПТБ. Информативность Д-димера у пациентов с предполагаемым рецидивом ТГВ ограничена высокой вероятностью сохранения его повышенных значений после прекращения антикоагуляции. Так, в одном исследовании частота повышения уровня Д-димера у 396 больных с ВТЭО составила 15,5% сразу после отмены антикоагулянтов и 46,2% через 3 мес. [187]. При этом сохранение повышенного уровня Д-димера после прекращения антикоагулянтной терапии ассоциируется с двукратным увеличением риска рецидива ВТЭО. По данным мета-анализа 26 исследований с участием 10725 пациентов частота рецидива ВТЭО составила 16,1% при повышенном Д-димере и 7,4% при нормальных показателях (ОР, 2,1; 95% ДИ, 1,7-2,8) [275]. Использование Д-димера нецелесообразно при высокой клинической вероятности наличия рецидива ТГВ (яркие клинические проявления, ≥2 баллов по шкале Уэллса (Wells)), в таких случаях рекомендуется выполнять УЗАС [533,537]. При низкой клинической вероятности наличия рецидива ТГВ (стертая симптоматика, <2 баллов по шкале Уэллса (Wells)) нормальный уровень Д-димера позволяет исключить повторный тромбоз. Между тем, риск ложноотрицательного результата при таком подходе может достигать 6-7% [538]. Применение МР-венографии по технологии прямой визуализации тромба (MRDTI) позволяет исключить рецидив ТГВ даже у пациентов с наличием резидуальных изменений при УЗАС, риск ложноотрицательного результата при этом составляет 1,7% (95% ДИ, 0,2-5,9%) [536].
- У пациента с подозрением на рецидив ТГВ к ультразвуковым признакам повторного тромбоза рекомендуется относить: окклюзию ранее интактного венозного сегмента, окклюзию ранее реканализованного венозного сегмента, увеличение степени резидуальной венозной обструкции на ≥4 мм в сравнении с предыдущим исследованием [533].
УУД 5 УУР С
Комментарий: при отсутствии возможности сравнения с данными предыдущего УЗАС результаты исследования следует трактовать индивидуально в соответствии с клинической вероятностью наличия рецидива ТГВ и степенью риска рецидива ВТЭО у конкретного больного. По данным одной работы результаты УЗАС невозможно трактовать у 32% больных с подозрением на рецидив ТГВ в связи с отсутствием предыдущего заключения (11%) или невозможностью сравнения динамики изменения резидуальной венозной обструкции (21%) [539]. При оценке степени изменения резидуальной венозной обструкции следует иметь в виду высокую ее вариабельность при повторных измерениях. Рецидив ТГВ можно исключить, в случае если диаметр вены при максимальной компрессии изменился не более, чем на 2 мм. В случае увеличения диаметра вены при максимальной компрессии на 2-4 мм рекомендуется повторить исследование через 5-7 дней или начать лечение рецидива ТГВ. В случае увеличения диаметра вены при максимальной компрессии на ≥4 мм рекомендуется начать лечение рецидива ТГВ.
- У пациента с ранним рецидивом ТГВ рекомендуется установить возможную причину неэффективности проводимого лечения, а также изменить или усилить терапию антикоагулянтами [85,279,540].
УДД 4 УУР С
Комментарий: если рецидив ТГВ развился на фоне АКТ, то следует в первую очередь установить причину ее неэффективности (низкая приверженность терапии, прием сопутствующих препаратов, которые могут взаимодействовать с антикоагулянтами, неадекватные дозы ПОАК, несоответствие МНО целевому диапазону при приеме АВК, недиагностированный рак, антифосфолипидный синдром и т.д. При рецидиве ТГВ, возникшем в период приема орального антикоагулянта, целесообразно перевести пациента на полные лечебные дозы НМГ на один месяц с последующей заменой орального антикоагулянта на другой с отличным механизмом действия (переход с ПОАК на АВК), увеличением дозы орального антикоагулянта (переход с редуцированной на полную лечебную дозу ПОАК), увеличением целевого диапазона МНО (от 2,0-3,0 до 2,5-3,5), устранением возможных причин рецидива ТГВ (Таблица 15) [85,279,540]. При рецидиве ТГВ на фоне терапии пониженными дозами НМГ целесообразен переход на полные лечебные дозы, при возникновении рецидива ТГВ на фоне применения полных лечебных доз НМГ целесообразно их увеличение на 20-25% на период 1 месяца [31,541,542]. Также целесообразен подбор индивидуальной дозы НМГ под контролем анти-Ха активности.
Таблица 15. Возможные причины рецидива ТГВ и способы их коррекции
|
Возможная причина |
Тактика лечения |
|
Онкологическое заболевание |
Переход на НМГ, возможно, увеличение дозы; при миелопролиферативном заболевании рекомендуется циторедуктивная терапия и антиагреганты (АТХ группа: антиагреганты, кроме гепарина, B01AC) |
|
Антифосфолипидный синдром |
Переход на АВК, возможно использование повышенного целевого диапазона МНО |
|
Пароксизмальная ночная гемоглобинурия |
Антикоагулянты и экулизумаб** |
|
Гепарин-индуцированная тромбоцитопения |
#Бивалирудин (АТХ группа: ингибиторы тромбина прямые, B01AE06, фондапаринукс натрия (АТХ группа: прочие антикоагулянты, B01AX05) [543] |
|
Беременность |
Контроль анти-Ха активности, увеличение дозы НМГ/НФГ |
|
Болезнь Бехчета |
Специфическая иммуносупрессивная терапия |
|
Сосудистые аномалии |
Декомпрессия, стентирование, эскалация режима терапии |
|
Редуцированная доза ПОАК |
Увеличение до лечебной |
|
Масса тела >120 кг |
Переход с ПОАК на АВК |
|
Лекарственные взаимодействия |
Переход с ПОАК на АВК |
|
Прием ривароксабана** без пищи |
Инструктаж |
|
Низкая приверженность |
Переход с ПОАК на АВК |
3.7. Осложнения антикоагулянтной терапии
3.7.1. Кровотечение
При лечении любыми антитромботическими препаратами могут развиться геморрагические осложнения, к факторам риска которых относят пожилой возраст, кровотечения или инсульт в анамнезе, злокачественные опухоли, почечную и печеночную недостаточность, сахарный диабет, недавно выполненное хирургическое вмешательство, анемию, тромбоцитопению, частые падения, злоупотребление алкоголем, прием антитромбоцитарных препаратов или нестероидных противовоспалительных препаратов [279]. При наличии одного фактора риска вероятность большого кровотечения увеличивается по крайней мере в 2 раза, а при наличии двух и более факторов риска – в 8 раз. Значительное увеличение частоты геморрагических осложнений может наблюдаться и при наличии одного фактора риска, например, в течение первых дней после большого хирургического вмешательства или при наличии тяжелой тромбоцитопении. В зависимости от количества факторов риска (0,1 или ≥2) пациенты могут быть разделены на группы низкого, среднего и высокого риска с соответствующей ежегодной частотой больших кровотечений на уровне 0,8%, 1,6% и ≥6,5%, соответственно [279]. Необходимо отметить, что предсказательная ценность этой стратификации в условиях реальной клинической практики оказалась недостаточно высокой [191]. Существуют и другие шкалы, предназначенные для оценки риска кровотечений при АКТ (Приложение Г10). Несмотря на ограниченную валидацию в исследованиях, эти шкалы могут быть использованы для определения индивидуального риска больших кровотечений на фоне длительной и продленной АКТ.
Указанные цифры риска геморрагических осложнений относятся, в первую очередь, к начальной терапии гепаринами с переходом на АВК. Длительное применение АВК ассоциируется с высокой частотой угрожающих жизни больших кровотечений, летальность при которых составляет 9-11% и достигает 45% при внутричерепной локализации [308,309]. При начальной терапии применение НМГ и фондапаринукса натрия (АТХ группа: прочие антикоагулянты, B01AX05) в качестве альтернативы НФГ** позволяет снизить угрозу геморрагических осложнений [350,352–354]. Максимальную безопасность при начальной и длительной терапии ВТЭО демонстрируют ПОАК. По данным мета-анализа регистрационных исследований, включивших более 27000 пациентов с ВТЭО, лечение ПОАК сопровождается снижением риска больших кровотечений на 39% (ОР, 0,61, 95% ДИ, 0,45-0,83) по сравнению с АВК [544,545]. Кроме того, при использовании ПОАК было выявлено снижение риска внутричерепных кровоизлияний на 63% (ОР, 0,37; 95% ДИ, 0,21-0,68) и летальных кровотечений на 64% (ОР, 0,36; 95% ДИ, 0,15-0,84). Увеличения частоты желудочно-кишечных кровотечений, которое наблюдали на фоне ПОАК у пациентов с неклапанной фибрилляцией предсердий, у больных с ВТЭО отмечено не было. Преимущество ПОАК по безопасности перед АВК сохранялось у пациентов в возрасте ≥75 лет и при КлКр 30-49 мл/мин.
- У пациента с ТГВ, длительно получающего лечение с помощью АВК, рекомендуется проводить активное выявление, контроль и коррекцию факторов риска геморрагических осложнений [373,546,547].
УДД 5 УУР С
Комментарий: наиболее часто кровотечения возникают в желудочно-кишечном и мочеполовом трактах, поэтому во время применения АВК целесообразен контроль анализа мочи для исключения микрогематурии и исследование кала на скрытую кровь. У больных с анамнезом язвенной болезни желудка, двенадцатиперстной кишки, принимающих АВК, целесообразно проводить ЭГДС на регулярной основе. Внеочередное обследование показано при появлении жалоб, подозрительных в отношении обострения заболевания. При нестойкой ремиссии, а также если АВК приходится сочетать с антиагрегантами, следует рассмотреть целесообразность лекарственной профилактики кровотечений из верхних отделов желудочно-кишечного тракта. У пациентов с артериальной гипертензией требуется подбор эффективной гипотензивной терапии. При внезапных повышениях АД необходима его скорейшая нормализация. При носовом кровотечении на фоне высокого АД быстрый дополнительный прием больным гипотензивных препаратов (АТХ группа: антигипертензивные средства, С02) часто способствует прекращению кровотечения. Необходимо проинформировать пациента, что при кровотечении ему необходимо срочно связаться с врачом и воздержаться от приема очередной дозы АВК как минимум до определения МНО.
После отмены антикоагулянтное действие варфарина** прекращается примерно через 5 дней, аценокумарола - через 1-3 дня. Поэтому, если требуется достаточно срочное устранение воздействия АВК, наряду с отменой препарата показано использование фитоменадиона (АТХ: витамин К и другие гемостатические средства, B02BA01), эффект которого ожидается в ближайшие 24 ч. Препарат менадиона натрия бисульфит (АТХ: витамин К и другие гемостатические средства, B02BA02) не является аналогом пероральной формы витамина К1. Менадиона натрия бисульфит способствует синтезу витамин К-зависимых факторам свертывания de novo за счет влияния на процессы карбоксилирования, поэтому эффект после его приема наступает медленно, и он бесполезен для быстрого устранения ассоциированной с АВК коагулопатии. Отечественный препарат фитоменадион (АТХ: витамин К и другие гемостатические средства, B02BA01) в капсулах по 0,1 г 10% масляного раствора содержит чрезмерно высокую дозу витамина К1, способную вызвать длительную невосприимчивость к АВК. Наиболее быстрый, но временный эффект дает внутривенное введение свежезамороженной плазмы (СЗП), концентрата протромбинового комплекса** (КПК) (АТХ группа: гемостатические средства, факторы свертывания крови, B02BD), рекомбинантного фактора VIIа** (АТХ группа: гемостатические средства, факторы свертывания крови, B02BD). Свежезамороженная плазма немедленно замещает витамин-К-зависимые факторы свертывания, но лишь частично корригирует коагулопатию и требует длительного времени для восстановления МНО (в течение 30 минут МНО нормализуется лишь в 9,2% случаев) [548]. Быстрая и полная реверсия эффекта варфарина** возможна в течение 10-15 минут после введения концентрата протромбинового комплекса**, содержащего высокие концентрации витамин-К-зависимых факторам свертывания (АТХ группа: гемостатические средства, факторы свертывания крови, B02BD) в различной комбинации: II, IX, X (трехкомпонентный), +VII (четырехкомпонентный), +VIIa (активный четырехкомпонентный) , а также антитромбин, протеины С и S и гепарин. Тактика реверсии антикоагулянтного эффекта АВК (АТХ группа: антагонисты витамина К, B01AA) приведена в Таблице 16.
Таблица 16. Тактика реверсии антикоагулянтного эффекта АВК
|
Клиническая ситуация |
Лечебная тактика |
|
Большое кровотечение |
Прекратить прием варфарина** Госпитализация пациента в стационар Ввести фитоменадион (АТХ: витамин К и другие гемостатические средства, B02BA01) 5-10 мг путем медленной в/в инъекции Ввести концентрат протромбинового комплекса** 30-50 ЕД/кг или (если нет концентрата) свежезамороженную плазму 15 мл/кг |
|
МНО >8,0, нет кровотечения или малое кровотечение |
Прекратить прием варфарина** Возобновить прием варфарина при МНО <5,0 При наличии кровотечения ввести фитоменадион (АТХ: витамин К и другие гемостатические средства, B02BA01) 0,5-2,5 мг путем медленной в/в инъекцией или 5 мг per os (для частичной реверсии антикоагуляции ввести меньшую дозу фитоменадиона, например - 0,5-2,5 мг, используя per os препарат, приготовленный для в/в инъекции). Повторить введение фитоменадиона, если МНО остается слишком высоким по прошествии 24 часов. |
|
6,0 <МНО <8,0, нет кровотечения или малое кровотечение |
Прекратить прием варфарина** Возобновить прием варфарина** при уровне МНО <5,0 |
|
МНО <6,0, но >0,5 выше целевого уровня |
Снизить дозу или прекратить прием варфарина** Возобновить прием варфарина** при уровне МНО <5,0
|
|
Неожиданное кровотечение при терапевтическом уровне МНО |
Выявить лежащую в основе причину развития кровотечения, например, не предвиденную ранее патологию желудочно-кишечного тракта. |
- У пациентов с ТГВ, получающих антикоагулянтную терапию с помощью АВК, при значениях МНО >4,5 и <10,0 при отсутствии клинически значимого кровотечения не рекомендуется применение фитоменадиона в дополнение к временному прерыванию антикоагулянтной терапии [132].
УДД 5 УУР С
Комментарий: по данным мета-анализа применение фитоменадиона у пациентов с варфариновой коагулопатией при отсутствии клинически значимого кровотечения не влияет на общую смертность, скорость нормализации МНО, риск рецидива ВТЭО, но ассоциируется с незначимой тенденцией к увеличению частоты больших кровотечений (ОР, 2,43; 95% ДИ, 0,81-7,27) [132].
- У пациентов с ТГВ, получающих АВК, при развитии угрожающего жизни кровотечения рекомендуется введение концентрата протромбинового комплекса** вместо свежезамороженной плазмы, в дополнение к прерыванию антикоагуляции и внутривенному введению фитоменадиона [132,549].
УДД 2 УУР В
Комментарий: по данным мета-анализа применение КПК** (АТХ группа: гемостатические средства, факторы свертывания крови, B02BD) в сравнении с СЗП ассоциируется со снижением общей смертности на 44% (ОР, 0,56; 95% ДИ, 0,37-0,84), с более быстрой нормализацией МНО, с уменьшением вероятности объемной перегрузки и сердечной недостаточности без влияния на шанс достижения гемостаза и риск тромботических осложнений [549]. Более того, у пациентов с внутричерепным кровоизлиянием применение КПК** в отличие от СЗП позволяет стабилизировать гематому [550].
ПОАК обладают относительно коротким периодом полувыведения, поэтому не требуют обязательной инактивации. В случае угрожающего жизни кровотечения могут использоваться как специфические антидоты, так и КПК** [132]. Также не следует забывать о неспецифических средствах гемостаза [85]. К специфическим средствам реверсии ПОАК относят идаруцизумаб (АТХ группа: антидоты, V03AB37), который представляет собой моноклональное антитело и активен только в отношении дабигатрана этексилата**. Тактика гемостатической терапии при больших кровотечениях, ассоциированных с применением ПОАК, представлена в таблице 17.
Таблице 17. Тактика гемостатической терапии при большом кровотечении, возникшем на фоне приема ПОАК
|
Большое кровотечение |
Прямые ингибиторы тромбина (дабигатрана этексилат**, АТХ группа: ингибиторы тромбина прямые, B01AE07) |
Прямые ингибиторы Ха фактора (апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03) |
|
Не угрожающее жизни |
Выяснение названия препарата, дозы и времени последнего приема |
|
|
Локальный гемостаз |
||
|
Восполнение кровопотери |
||
|
Трансфузия эритроцит-содержащих сред по показаниям |
||
|
Трансфузия тромбоцитарных сред по показаниям (тромбоцитопения, тромбоцитопатия) |
||
|
Плазма свежезамороженная (для восполнения ОЦК, но не для реверсии) |
||
|
#Транексамовая кислота** (АТХ группа: антифибринолитические средства, B02AA02) может быть рассмотрена в качестве адьюванта (1 г в/в, повторная доза каждые 6 часов при необходимости) |
||
|
Ожидаемое время нормализации гемостаза: КлКр >80 мл/мин: 12-24 ч КлКр 50-80 мл/мин: 24-36 ч КлКр 30-50 мл/мин: 36-48 ч КлКр <30 мл/мин: >48 ч |
Ожидаемое время нормализации гемостаза: 12-24 ч |
|
|
Поддержание диуреза |
Поддержание диуреза |
|
|
Рассмотреть идаруцизумаб |
||
|
Угрожающее жизни |
Все вышеуказанные методы |
Все вышеуказанные методы |
|
Идаруцизумаб |
||
|
В качестве альтернативы факторы свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]****: 50 ЕД/кг (дополнительно, 25 ЕД/кг при необходимости) [85] |
||
- У пациентов с ТГВ, получающих дабигатрана этексилат** при развитии угрожающего жизни кровотечения рекомендуется введение идаруцизумаба с целью остановки кровотечения [85,132,551,552].
УДД 2 УУР C
Комментарий: эффективность и безопасность идаруцизумаба для реверсии действия дабигатрана этексилата** была изучена в рамках исследования RE-VERSE AD, включившего 301 больного с большим кровотечением и 202 пациентов с потребностью в экстренном хирургическом вмешательстве. Внутривенное введение двух болюсов по 2,5 г (50 мл) в течение 15 минут привело к 100% реверсии активности дабигатрана этексилат** по лабораторным данным и достижению эффективного гемостаза через 2,5 часа в 67,7% случаев больших кровотечений. За последующие 30 дней наблюдения рецидив тромбоза был зарегистрирован в 4,8% случаев, а летальный исход – в 13,5% [551].
- У пациентов с ТГВ, получающих ПОАК, при развитии угрожающего жизни кровотечения рекомендуется введение концентрата протромбинового комплекса** при недоступности специфических антидотов [85,132,552,553].
УДД 3 УУР В
Комментарий: мета-анализ 10 обсервационных исследований с участием 340 пациентов показал, что КПК** в дозе 18-50 ЕД/кг или 2000-3500 ЕД для реверсии эффекта ПОАК у пациентов с большими кровотечениями обеспечивал гемостаз в 69-77% случаев. В течение последующих 30 дней наблюдения частота тромботических осложнений составила 4%, а общая смертность - 16% [553]. Важно, что обнаруженная летальность на фоне применения КПК** не отличается от таковой в исследовании ANNEXA-4 (14%) [554] и RE-VERSE AD (13,5%) [551]. По данным систематического обзора с мета-анализом, эффективность и безопасность применение КПК** у пациентов с внутричерепными кровоизлияниями на фоне терапии ПОАК существенным образом не отличалась от применения специфических антидотов (эффективность – 77%, летальность – 26% и тромботические осложнения – 8%) [552].
- У пациентов с ТГВ, получающих НФГ** и НМГ, при развитии угрожающего жизни кровотечения рекомендуется введение протамина сульфата** (АТХ группа: антидоты, V03AB14) [122,132].
УДД 5 УУР С
Комментарий: эффективность и безопасность протамина сульфата** у пациентов, получающих НФГ** и НМГ, была изучена только в рамках реверсии действия препаратов при экстренных оперативных вмешательствах. Мета-анализ обсервационных исследований продемонстрировал снижение риска больших кровотечений на 39% (ОР, 0,61; 95% ДИ, 0,39-0,96) при отсутствии различий по общей смертности и тромботическим осложнениям [132]. Полученные данные условным образом могут быть экстраполированы на больных с угрожающим жизни кровотечением.
- У пациентов с ТГВ, имеющих показания к продленной АКТ, после купирования большого кровотечения и его последствий рекомендуется в течение 90 дней возобновить лечение при условии невысокого риска рецидива геморрагических осложнений [132,301].
УДД 2 УУР С
Комментарий: мета-анализ 17 обсервационных исследований продемонстрировал, что возобновление АКТ после перенесенного большого желудочно-кишечного кровотечения и внутричерепного кровоизлияния ассоциируется со снижением общей смертности на 38% (ОР, 0,62; 95% ДИ, 0,43-0,89), снижением риска тромбоэмболических осложнений на 55% (ОР, 0,45; 95% ДИ, 0,25-0,83), тенденцией к снижению риска ТЭЛА (ОР, 0,35; 95% ДИ, 0,11-1,11) и ВТЭО (ОР, 0,58; 95% ДИ, 0,26-1,28) без значительного влияния на риск ТГВ (ОР, 0,81; 95% ДИ, 0,31-2,16) параллельно с увеличением угрозы большого кровотечения (ОР, 1,57; 95% ДИ, 1,12-2,21) [132].
В случае перенесенного желудочно-кишечного кровотечения возобновление терапии оральными антикоагулянтами (апиксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF02; ривароксабан**, АТХ группа: прямые ингибиторы фактора Xa, B01AF01; эдоксабан, АТХ группа: прямые ингибиторы фактора Xa, B01AF03) (на примере фибрилляции предсердий) рекомендуется как можно раньше у пациентов с низким риском повторного геморрагического осложнения. При этом к факторам риска рецидива кровотечения относятся отсутствие ясного источника первичного кровотечения, множественные ангиодисплазии пищеварительного тракта, отсутствие обратимой или потенциально излечиваемой причины, кровотечение, возникшее в период прерывания АКТ, злоупотребление алкоголем, старший возраст [301].
В случае перенесенного внутричерепного кровоизлияния возобновление терапии оральными антикоагулянтами (на примере фибрилляции предсердий) рекомендуется в течение 4-8 недель у пациентов с низким риском повторного геморрагического осложнения. При этом к факторам риска рецидива кровотечения относится отсутствие обратимой или потенциально излечиваемой причины, множественные кровоизлияния, тяжелое внутричерепное кровоизлияние, старший возраст, кровотечение, возникшее в период прерывания АКТ, неконтролируемая артериальная гипертензия, кровотечение на адекватных или пониженных дозах ПОАК, злоупотребление алкоголем, потребность в двойной антиагрегантной терапии [301].
3.7.2. Прогрессирование тромбоза на фоне АКТ
Под прогрессированием ТГВ понимают распространение или рецидив тромбоза в течение первых 2 недель после начала антикоагулянтной терапии [28]. Следует иметь в виду, что в большинстве случаев такие эпизоды выявляют при повторном инструментальном исследовании и это не всегда ассоциируются с клиническим ухудшением или отсутствием улучшения. Поэтому трактовка подобных находок должна проводиться в индивидуальном порядке с учетом клинической картины и особенностей пациента. Как и при рецидиве ТГВ, в таких случаях следует установить возможные причины неэффективности антикоагулянтной терапии, увеличить ее интенсивность, а также рассмотреть вопросы хирургической профилактики ТЭЛА.
- У пациента с ТГВ с целью диагностики прогрессирования венозного тромбоза рекомендуется учитывать распространение (увеличение проксимальной границы) или рецидив (окклюзия ранее интактной или реканализованной вены) тромбоза в течение первых 2 недель с момента диагностики ТГВ и начала АКТ [533].
УУД 5 УУР С
Комментарий: следует критически относиться к результатам повторных инструментальных исследований, валидность которых в рамках оценки эффективности антикоагулянтной терапии окончательно не изучена. Так по данным ряда работ при выполнении повторного инструментального исследования в течение 5-14 дней от момента начала лечения признаки нарастания тромбоза могут быть обнаружены в 12-39% случаев, что не всегда отражает неэффективность проводимой терапии [555]. Свидетельства новой легочной эмболии (преимущественно бессимптомной) могут быть выявлены у 4-6% пациентов с ТГВ вне зависимости от факта обнаружения флотации первичного тромба [91]. Изменения эхографической структуры тромба в процессе естественной его эволюции (изменение эхогенности, протяженности, появление флотации) достоверно не описаны и не могут использоваться для верификации прогрессирования ТГВ в отрыве от клинических проявлений. Т.о., результаты повторных инструментальных исследований следует трактовать в контексте симптомов заболевания и риска ВТЭО у пациента.
- У пациента с прогрессированием ТГВ на фоне, продолжающейся АКТ рекомендуется рассмотреть целесообразность хирургической профилактики ТЭЛА [85,279,540].
УДД 5 УУР С
3.7.3. Гепарин-индуцированная тромбоцитопения (ГИТ)
Гепарин-индуцированная тромбоцитопения (ГИТ) – это парадоксальная реакция тромбоцитов на гепарин (их агрегация и разрушение), потенциально опасная развитием венозных и артериальных тромбозов, реже кровотечений. Частота развития ГИТ колеблется от 0,5 до 7% [556–558]. Наибольшая вероятность наблюдается у пациентов кардиохирургического профиля из-за частого применения высоких доз гепарина [559]. Риск ГИТ в 10 раз выше при использовании НФГ** в сравнении с НМГ [557,560]. Пациенты, получающие гепарин бычьего происхождения, имеют более высокий риск возникновения ГИТ, нежели лица, использующие препарат свиного происхождения [561]. У женщин вероятность развития ГИТ в 2 раза выше, чем у мужчин. Пациенты, получающие гепарин в течение 30 сут. до операции, попадают в зону высокого риска появления антител и симптомов ГИТ в первые 5 сут. после вмешательства [562]. В группе лиц, у которых выявлены антитела и тромбоцитопения параллельно с тромбозами, смертность в течение первых 30 дней увеличивается на 30% по сравнению с пациентами с тромбоцитопенией, но без тромбозов [563]. Повышенный индекс массы тела, предоперационная сердечная недостаточность, увеличенная интраоперационная доза гепарина, экстренное хирургическое вмешательство и операции на аорте служат дополнительными независимыми факторами риска в случае наличия антител при ГИТ II типа [564].
3.7.3.1. Виды ГИТ
Различают 2 типа ГИТ. Гепарин-индуцированная тромбоцитопения I типа развивается в результате прямого взаимодействия гепарина с мембраной тромбоцитов через специфические рецепторы Р2Y12 и IIb/IIIa, которое вызывает активацию и агрегацию тромбоцитов. ГИТ I характеризуется кратковременным снижением числа тромбоцитов на 10–30% в первые 5 суток терапии гепарином у 10–30% пациентов и обычно не достигает количества ниже 100х109/л, не является клинически значимым событием и не требует дополнительного лечения, кроме отмены гепарина. Даже при продолжении лечения гепарином количество тромбоцитов может восстановиться. Тромбозы при этом типе развиваются редко.
Гепарин-индуцированная тромбоцитопения II типа является иммуноспецифической реакцией, развивающейся на 4-15-е сутки от начала фармакотерапии гепарином, является клинически значимым синдромом, наиболее часто приводящим к тромбозам. Диагноз ГИТ II типа устанавливается в том случае, когда у пациента с тромбоцитопенией развиваются клинические признаки артериального или венозного тромбоза [559].
3.7.3.2. Критерии диагностики ГИТ
Подозрение на развитие ГИТ II типа возникает при уменьшении числа тромбоцитов на 30-50% относительно максимального значения на 4-15-й день терапии гепарином. У 90% пациентов количество тромбоцитов опускается ниже 150х109/л. Во время острой фазы ГИТ II типа обнаруживаются циркулирующие антитела к комплексу PF-4/гепарин с одновременной тромбоцитопенией, что максимально увеличивает вероятность тромбообразования [565]. Восстановление количества тромбоцитов происходит примерно через одну неделю после прекращения применения гепарина у 90% пациентов, но может затянуться на несколько недель [562]. ВТЭО, чаще встречаются при ГИТ II типа, чем артериальный тромбоз [566]. Тем не менее у пациентов с ГИТ II типа может развиться артериальный тромбоз, инсульт, инфаркт, некроз надпочечников [566,567].
Диагностика ГИТ II типа должна начинаться с оценки вероятности данного состояния с использованием балльной шкалы – шкалы 4Т (Таблица 18) [107,567,568]. Вторым по важности критерием подтверждения диагноза ГИТ II типа у пациентов с клиническими проявлениями является обнаружение антител к комплексу PF4/гепарин. Все существующие на сегодняшний день лабораторные тесты для диагностики ГИТ основаны на идентификации антител к комплексу PF-4/гепарин и делятся на 2 группы: антигенные (с использованием комплекса PF-4/гепарин в качестве антигена) и функциональные (тесты с активацией тромбоцитов). К антигенным тестам относят твердофазный иммуноферментный анализ и иммунотурбидиметрия; к функциональным – тест на высвобождение серотонина, агрегация тромбоцитов, гепарин-индуцированная агрегация тромбоцитов. Тесты на обнаружение антител обладают относительно низкой чувствительностью, но быстры в исполнении, поэтому могут использоваться в рамках первичного скрининга. Функциональные тесты характеризуются максимальной чувствительностью и должны использоваться для окончательной верификации диагноза.
Таблица 18. Клиническая балльная система оценки риска ГИТ II типа
|
Клинический признак |
2 балла |
1 балл |
0 баллов |
|
Тромбоцитопения |
Снижение Тр более 50% или Тр >20х109/л |
Снижение Тр на 30- 50% или Тр> 10-19 х109/л |
Снижение Тр менее 30% или Тр <10х109/л |
|
Время снижения количества тромбоцитов после воздействия гепарина |
5-10 сут, или в 1-е сут. (с применением гепарина в течение 30 дней в анамнезе) |
>10 сут. или >1 дня (с применением гепарина в течение 30-100 дней в анамнезе) |
<4 дней без анамнеза применения гепарина |
|
Тромбоз или другие осложнения |
Новый доказанный тромбоз, некроз кожи в местах введения гепарина, острая системная реакция после внутривенного нефракционированного гепаринового** болюса |
Прогрессирующий или рецидивирующий тромбоз, эритематозные поражения кожи, подозрение на тромбоз |
Отсутствие тромбоза |
|
Другие причины тромбоцитопении |
Нет очевидных причин |
Возможные причины |
Определённые причины |
Примечание. Вероятность ГИТ II типа до тестирования: высокая = 6–8 баллов, промежуточная = 4–5 баллов, низкая = 0–3 балла.
- Пациентам с ТГВ и подозрением на ГИТ рекомендуется использовать балльную шкалу 4T для оценки вероятности ГИТ с принятием дальнейших решений по лабораторной диагностике и изменению режима антикоагулянтной терапии [107].
УУД 5 УУР С
Комментарий: данная шкала предусматривает подсчет баллов по 4 критериям и 3 степеням, каждой категории присваивается от 0 до 2 баллов, сумма баллов оценивает состояние пациента как: 1) низкая вероятность развития ГИТ - 0–3 балла; 2) промежуточная вероятность - 4-5 баллов и 3) высокая вероятность ГИТ - 6-8 баллов. Тем не менее, положительная прогностическая ценность шкалы не до конца надежна, и диагноз в большей степени требует подтверждения лабораторными тестами. У пациентов с низким баллом (<3) вероятность ГИТ II типа составляет менее 5%, и тестирование на антитела к комплексу PF-4/гепарин не требуется, равно как и изменение режима АКТ. У пациентов с умеренной (4-5 баллов) и высокой (6-8 баллов) клинической вероятностью необходимо выполнить лабораторный анализ на наличие антител к комплексу PF-4/гепарин, а также прекратить введение гепаринов [107].
- Пациентам с ТГВ и средней или высокой вероятностью ГИТ по шкале 4Т рекомендуется прекратить введение гепаринов и провести иммуноферментный анализ с последующим (в случае положительного результата) выполнением функциональных тестов (если доступны) с целью верификации диагноза [107].
УУД 5 УУР С
Комментарий: математическое моделирование на основании данных трех систематических обзоров показало, что подобный подход приведет к правильной диагностике ГИТ у 100 пациентов, к ложно-отрицательному результату на этапе клинической диагностики в 10 случаях и к необоснованному отказу от гепаринов и выполнению лабораторных тестов у 408 больных на каждую 1000 лиц с подозреваемой ГИТ II типа [107].
3.7.3.3. Антикоагулянтная терапия при подозреваемой или подтвержденной ГИТ
При подозреваемой и верифицированной ГИТ II типа не рекомендуется применение гепаринов, а также АВК до момента восстановления уровня тромбоцитов ≥150×109/л. Отказ от использования антикоагулянтов в остром периоде ассоциируется с прогрессирующим увеличением риска тромботических осложнений и летального исхода [569]. Препаратами выбора служат фондапаринукс натрия, бивалирудин, или ПОАК (Таблица 19).
Таблица 19. Режим введения препаратов, рекомендованных к применению при ГИТ II типа
|
Препарат |
Начальная доза |
Мониторинг |
|
#Бивалирудин [543] (АТХ группа: ингибиторы тромбина прямые, B01AE06 ) |
Болюс: не предусмотрен Постоянная инфузия: 0,05-0,1 мг/кг/час При печеночной или почечной недостаточности возможно уменьшение дозы |
Подбор дозы по АЧТВ до достижения показателем величины, в 1,5-2,5 раза превышающей верхнюю границу нормы |
|
Фондапаринукс натрия (АТХ группа: прочие антикоагулянты, B01AX05) |
Стандартный режим |
Не предусмотрен |
|
ПОАК |
Стандартный режим |
Не предусмотрен |
- Пациентам с ТГВ и средней или высокой вероятностью ГИТ по шкале 4Т рекомендуется прекратить введение гепарина и начать введение альтернативного антикоагулянта (АТХ группа: прочие антикоагулянты, B01AX05, АТХ группа: ингибиторы тромбина прямые, B01AE06) до момента окончательной верификации или исключения диагноза [107].
УУД 5 УУР С
- Пациентам с ТГВ и подтвержденной ГИТ II типа рекомендуется проводить терапию альтернативными антикоагулянтами [107].
УУД 2 УУР B
Комментарий: по данным систематического обзора, включающего данные 8 исследований, по сравнительной оценке, эффективности и безопасности различных подходов к лечению ГИТ II типа, было выявлено, что переход на альтернативные антикоагулянты негепаринового ряда (АТХ группа: прочие антикоагулянты, B01AX05, АТХ группа: ингибиторы тромбина прямые, B01AE06 ) ассоциируется со снижением риска прогрессирования и рецидива тромбоза на 12-15% в сравнении с отказом от использования антикоагулянтов и на 50% в сравнении с переходом на АВК. В то же время, использование альтернативных антикоагулянтов ассоциируется с повышенным риском больших кровотечений (8-35%) преимущественно у критически больных лиц. Фондапаринукс натрия является изученным в рамках лечения ГИТ II типа препаратом, который доступен на территории РФ. По данным систематического обзора, включающего данные 9 исследований с участием 154 пациентов, использование фондапаринукса натрия (ассоциируется с развитием тромботических осложнений в 6,5% случаев, больших кровотечений – в 16,9% наблюдений и летального исхода – у 3,2% пациентов [570]. Все больше сведений накапливается по поводу возможности применения ПОАК при верифицированной ГИТ II типа, как у пациентов с тромбозами, так и без них. Отмечается относительно низкий риск развития тромботических и геморрагических осложнений на фоне их использования независимо от исходного уровня тромбоцитов [571–574]. Так, в одном несистематическом обзоре литературы было показано, что применение ПОАК позволяет предотвратить 98% тромботических осложнений ценой кровотечения в 3% случаев [571].
- Пациентам с ТГВ и подтвержденной ГИТ II не рекомендуется имплантация кава-фильтра [107,575].
УУД 4 УУР С
Комментарий: по отдельным сведениям, частота рецидива тромботических событий у больных с ГИТ II типа после имплантации кава-фильтра может достигать 90% [575]. Косвенные данные говорят о том, что риск развития тромботических осложнений при ГИТ II типа повышается при наличии инородных тел, например центрального венозного катетера (9,7% против 0%) [576]. По данным мета-анализа у пациентов без ГИТ имплантация кава-фильтра не снижает смертность от ТЭЛА [504]. Т.о., нет оснований предполагать пользу от имплантации кава-фильтра у пациента с ГИТ II типа.
- У пациентов с ТГВ и подтвержденной ГИТ II не рекомендуется использование АВК до восстановления уровня тромбоцитов ≥150×109/л [107,566,577,578].
УУД 4 УУР С
Комментарий: у пациентов с ГИТ II типа и уровнем тромбоцитов <150×109/л использование АВК ассоциируется с крайне неблагоприятными исходами: 5 случаев кожных некрозов, 2 случая гангрены конечности и 1 ампутация у 6 пациентов [578]; 8 случаев венозной гангрены у 66 пациентов [577]; 10 случаев тромбоза у 21 пациента [566].
- Пациентам с ТГВ и подтвержденной ГИТ II не рекомендуется рутинное переливание тромбоцитсодержащих сред при высоком риске кровотечения [107,579].
УУД 4 УУР С
Комментарий: по результатам анализа крупной базы данных с включением информации о 6332 больных трансфузия тромбоцитарных сред ассоциировалась с увеличением риска артериального тромбоза в 3,4 (95% ДИ, 1,2-9,5) раза и общей смертности в 5,2 (2,6-10,5) раз [579].
3.8. Особые ситуации, влияющие на тактику обследования и лечения
3.8.1. Особенности диагностики, профилактики и лечения ТГВ во время беременности и в послеродовом периоде
Детальное описание диагностики, тактики и особенностей лечения венозных тромбоэмболических осложнений, ассоциированных с беременностью, представлено в Клинических рекомендациях «Венозные осложнения во время беременности и послеродовом периоде. Акушерская тромбоэмболия» (2022 г., утверждены МЗ РФ, ID:723), разработчики Российское общество акушеров-гинекологов (РОАГ), Ассоциация анестезиологов реаниматологов (ААР), Ассоциация акушерских анестезиологов реаниматологов (АААР)) [580]. Данный раздел дополняет и уточняет указанные рекомендации.
В указанных рекомендациях затрагивается проблематика тромбоза поверхностных вен (тромбофлебита), ассоциированного с беременностью. Детальное описание диагностики, тактики и особенностей лечения тромбоза поверхностных вен (тромбофлебита) во время беременности и в послеродовом периоде представлено в Клинических рекомендациях «Флебит и тромбофлебит поверхностных сосудов» (2021 г., утверждены МЗ РФ, ID: КР668), разработчики Ассоциация флебологов России, Ассоциация сердечно-сосудистых хирургов России, Российское общество хирургов, Российское общество ангиологов и сосудистых хирургов) [581].
3.8.1.1. Формулировка диагноза
- При формулировке диагноза рекомендуется указать ассоциацию с беременностью, а также особенности, влияющие на тактику лечения и вторичной профилактики: уровень тромбоза (дистальный /проксимальный); ориентировочную дату или календарный период начала ТГВ; наличие осложнения ТГВ в виде ТЭЛА или сопутствующую ТЭЛА [84,580–583].
УДД 5 УУР С
Комментарий: при развитии ТГВ во время беременности или послеродового периода без наличия явных провоцирующих факторов необходимо указать ассоциацию с беременностью. При развитии ТГВ во время беременности или послеродового периода при наличии других провоцирующих факторов клиницист вправе выделить и указать ведущий провоцирующий фактор с упоминанием ассоциации тромбоза и беременности. Целесообразно перечисление в диагнозе пораженных венозных сегментов или сокращенное анатомическое обозначение уровня поражения: подвздошно-бедренный (илиофеморальный), бедренно-подколенный (феморопоплитеальный). К послеродовому периоду как фактору повышенного риска ВТЭО относят 6 недель после родов.
Примерные формулировки диагноза:
- Проксимальный тромбоз глубоких вен левой нижней конечности во время беременности от 02.2021
- Проксимальный тромбоз глубоких вен левой нижней конечности во время беременности от 01.02.2021
- Проксимальный тромбоз глубоких вен левой нижней конечности в послеродовом периоде от 01.02.2021
- Проксимальный тромбоз глубоких вен левой нижней конечности во время беременности (общая и наружная подвздошные вены, общая бедренная вена, бедренная вена) от 01.02.2021, ТЭЛА от 04.02.2021
- Спровоцированный большим временным фактором риска (перелом костей голени) проксимальный тромбоз глубоких вен левой нижней конечности во время беременности от 02.2021
3.8.1.2. Особенности обследования на тромбофилию
- Рекомендуется относить к основным тромбофилическим состояниям: АФС (или выявление АФС-антител), мутация гена фактора V (Лейденская) и мутация гена фактора II G20210A в гетерозиготном или гомозиготном состоянии или их сочетание, врожденный дефицит или снижение активности естественных антикоагулянтов – дефицит антитромбина (АТ), протеинов С и S [580,583,584].
УДД 5 УУР C
Комментарий: к факторам риска развития ВТЭО во время беременности и в послеродовом периоде относится постоянное повышение уровня волчаночного антикоагулянта и/или постоянный средний или высокий титр антител к кардиолипину и/или постоянный средний или высокий титр антител к бета-2-гликопротеину без предшествующего тромботического события [583].
Только для перечисленных в рекомендации состояний на сегодняшний день имеются доказательства ассоциации с риском развития ВТЭО. Степень повышения риска ВТЭО зависит от особенностей выявленных нарушений, в связи с чем распространено деление тромбофилических состояний на тромбофилии высокого и низкого риска. Для выявления указанных нарушений используются следующие тесты:
- Выявление мутаций генов факторов V и II
- Определение уровня АТ
- Определение уровня/активности протеинов С и S
- Выявление волчаночного антикоагулянта, антител к кардиолипину и β2 гликопротеину 1.
Из перечисленных только выявление мутаций генов факторов V и II являются генетическими тестами, результаты которых не зависят от проведения антикоагулянтной терапии и наличия беременности. Генетические тесты определяются 1 раз в жизни. Необходимость повторного выполнения функциональных тестов (определение уровня АТ; определение уровня/активности протеинов С и S; выявление волчаночного антикоагулянта, антител к кардиолипину и β2 гликопротеину) определяет клиницист с учетом особенностей анамнеза и клинической ситуации. Гипергомоцистеинемия часто рассматривается как фактор риска развития ВТЭО. В частности, в этом качестве гипергомоцистеинемия включена в рекомендации RCOG [583]. Несколько мета-анализов показали некоторое повышение риска ВТЭО при гипергомоцистеинемии [945-947]. Однако, данные мета-анализы не позволяют корректно оценить наличие или отсутствие связи ВТЭО и гипергомоцистеинемии по ряду причин: в связи с малыми объёмами включаемых исследований отсутствует корректировка по различным известным и неизвестным параметрам, способным влиять на результат анализа (пол, возраст, прием лекарственных средств и множество других); гетерогенность в определении гипергомоцистеинемии и порогового значения уровня гомоцистеина; в мета-анализах не учитывается возможная предвзятость публикаций с переоценкой рисков; в некоторых исследованиях связь ВТЭО с гипергомоцистеинемией выделялась только в подгруппах, где другие факторы риска ВТЭО отсутствовали. Роль гипергомоцистеинемии в развитии ВТЭО регулярно подвергается сомнению в связи с низким качеством имеющихся доказательств этой роли [948, 949]. Более того, исследования (в том числе РКИ) не показали пользы снижения уровня гомоцистеина в профилактике ВТЭО [950-952]. В 2018 году опубликованы результаты крупного исследования случай контроль по выявлению связи между гипергомоцистеинемией и первым ВТЭО (ТГВ и/или ТЭЛА) [953]. Анализ включал данные по 1689 пациентам с первым ВТЭО и 1726 субъектов контроля из исследования Multiple Environmental and Genetic Assessment of Risk Factors for Venous Thrombosis (MEGA). Это исследование позволило оценить ассоциации ВТЭО с гипергомоцистеинемией при выборе различных пороговых значений уровня гомоцистеина в различных подгруппах, в которых была проведена корректировка по известным и неизвестным факторам риска (скрытым переменным) за счет сравнения пациентов с «популяционными» группами контроля, сформированными с использованием метода случайного набора номеров (random-digit dialing, RDD). Анализ проведен по 5 интервалам уровня гомоцистеина, для интервала с минимальным уровнем установлено значение <66 мкмоль/л (<1,60 мг/л), для интервала с максимальным ≥94 мкмоль/л (≥2,30 мг/л). Не обнаружена связь между ВТЭО и гипергомоцистеинемией при различных уровнях гомоцистеина как у мужчин, так и у женщин. В рекомендациях ACOG 2018 г., РОАГ 2021 г., не рекомендуется определение уровня гомоцистеина и обследование на наличие полиморфизмов генов метилентетрагидрафолатредуктазы (MTHFR), а также не рекомендована антенатальная и постнатальная тромбопрофилактика при наличии указанных полиморфизмов или гипергомоцистеинемии [580,584].
- При планировании беременности и отсутствии ВТЭО в анамнезе рекомендуется информировать пациентку о целесообразности обследования на основные тромбофилические состояния для определения оптимальной тактики профилактики ВТЭО [583,584].
УДД 5 УУР C
Комментарий: выявление бессимптомной тромбофилии может повлиять на оценку риска развития ТГВ/ВТЭО при беременности и в послеродовом периоде и тактику тромбопрофилактики. В большинстве рекомендаций зарубежных профессиональных сообществ не рекомендуется скрининг на тромбофилии при планировании беременности, однако под этим понимается рутинный тотальный скрининг за счет средств здравоохранения. Под сомнение ставится именно экономическая целесообразность тотального скрининга, и такая позиция обоснована систематическим обзором с метаанализом [954]. Вместе с тем, во-первых, в клинических руководствах и рекомендациях практически всегда делаются оговорки, что обследование на тромбофилии целесообразно тогда, когда оно может повлиять на тактику тромбопрофилактики, так как снижает риск развития опасных для жизни и здоровья беременной осложнений [194,583,584]. Во-вторых, в ряде рекомендаций основные тромбофилические состояния прямо указаны как факторы риска развития ВТЭО и включены в алгоритмы определения тактики тромбопрофилактики при беременности и в послеродовом периоде, то есть их выявление априори признается влияющим на определение этой тактики [583,584]. Поэтому пациентка должна быть информирована о возможной пользе тестирования на тромбофилию при планировании беременности.
- При планировании беременности, отсутствии ВТЭО в анамнезе и наличии семейного анамнеза (подтвержденный эпизод неспровоцированного или эстроген-ассоциированного ВТЭО у родственника 1 линии в возрасте до 50 лет) для определения оптимальной тактики профилактики ВТЭО рекомендуется обследование на основные тромбофилические состояния [583].
УДД 5 УУР C
Комментарий: наличие семейного анамнеза является одиночным слабым фактором риска развития ВТЭО. Вместе с тем, выявленная тромбофилия может иметь существенно больший «вес» как фактор риска ВТЭО, т.е. результат обследования может повлиять на тактику тромбопрофилактики во время беременности и в послеродовом периоде.
- При планировании беременности и ВТЭО в анамнезе с целью оптимизации тактики профилактики ВТЭО рекомендуется определение активности антитромбина III в крови (A09.05.047) и определение содержания антител к фосфолипидам в крови (A12.06.030) [580,583,585–587].
УДД 5 УУР С
Комментарий: наличие ВТЭО в анамнезе автоматически относит пациентку в группу высокого риска развития ВТЭО во время беременности или в послеродовом периоде. На тактику тромбопрофилактики в такой ситуации влияет только выявление АФС или дефицита антитромбина III, когда рекомендуется применение высоких доз НМГ в течение всей беременности. Выявление других тромбофилических состояний на тактику тромбопрофилактики не влияет. Обследование на другие виды тромбофилии при ВТЭО в анамнезе может преследовать другие цели (например, определение потребности и объема обследования детей в пациентки) и не привязано к планированию беременности.
- При наступившей беременности и ВТЭО в анамнезе рекомендуется определение активности антитромбина III в крови (A09.05.047) и определение содержания антител к фосфолипидам в крови (A12.06.030) [580,583].
УДД 5 УУР C
Комментарий: наличие ВТЭО в анамнезе автоматически относит пациентку в группу высокого риска развития ВТЭО во время беременности или в послеродовом периоде. Выявление бессимптомной тромбофилии в такой ситуации не может повлиять на оценку риска развития ТГВ/ВТЭО при беременности и в послеродовом периоде и тактику тромбопрофилактики, за исключением выявления дефицита антитромбина III и АФС-антител (волчаночный антикоагулянт, антитела к кардиолипину, антитела к бета-2-гликопротеину)
- При развитии ТГВ /ВТЭО во время беременности, рекомендуется определение содержания антител к фосфолипидам в крови (A12.06.030), обследование на другие тромбофилии не рекомендуется [580,583].
УДД 5 УУР C
Комментарий: выявление тромбофилии (например, генетическими тестами) в такой ситуации не влияет на тактику лечения ТГВ/ВТЭО, а большинство функциональных тестов не рекомендуется проводить на фоне антикоагулянтной терапии или беременности [580,583]. Целесообразным может быть определение АФС-антител. Согласно рекомендациям РОАГ 2021, при возникновении случая ВТЭО во время беременности не рекомендовано исследование на волчаночный антикоагулянт, но необходимо выполнить определение содержания антител к кардиолипину и антител к бета-2-гликопротеину1 в крови, так как это может повлиять на выбор дозы препаратов для тромбопрофилактики, а также длительность проведения антикоагулянтной терапии [580].
- Не рекомендуется использовать Д-димер для диагностики ВТЭО в период беременности и в послеродовом периоде, а также для коррекции антикоагулянтной терапии [580,583].
УДД 5 УУР C
Комментарий: отрицательный результат (уровень Д-димеров находится в пределах референсного интервала для не беременных) достоверно не исключает текущий венозный тромбоз.
3.8.1.3. Оценка риска развития ВТЭО, порядок лечебно-диагностических мероприятий, показания к госпитализации и особенности инструментального обследования
Тактика профилактики ВТЭО в антенатальном периоде и после родов описана в пункте «5.2.9. Профилактика ВТЭО во время беременности и в послеродовом периоде».
- Рекомендуется оценка гинекологом риска развития ВТЭО антенатально (при планировании беременности или при первом посещении врача при наступившей беременности) и постнатально (после родов) [580,588].
УДД 5 УУР С
Комментарий: оценку риска развития ВТЭО и рекомендации по тактике профилактики ВТЭО во время беременности и в послеродовом периоде по результатам сбора анамнеза, осмотра и дуплексного сканирования вен нижних конечностей вправе дать врач-хирург или врач-сердечно-сосудистый хирург с внесением результатов оценки в протокол врачебного осмотра (клиническое заключение) в произвольной форме.
- Рекомендуется считать симптомами возможной ТЭЛА одышку, кашель, кровохарканье, кратковременную потею сознания, тахикардию; симптомами возможного ТГВ боль в конечности, отек одной конечности, болезненность при пальпации конечности [84,362,582,583,585,589].
УДД 5 УУР С
Комментарий: указанные симптомы наиболее часто описывают в рекомендациях различных профессиональных сообществ по профилактике ВТЭО и в отдельных исследованиях как симптомы, позволяющие заподозрить наличие ТГВ и ТЭЛА. Чувствительность и специфичность этих симптомов, по всей видимости низкая. Вместе с тем выделение нескольких ключевых симптомов необходимо для формализации «клинического подозрения» развития ТГВ или ТЭЛА. Наличие одного или нескольких указанных симптомов может быть обусловлено другими причинами (не ТГВ или ТЭЛА). Трактовка симптомов в совокупности и по отдельности, отнесение или не отнесение их к признакам ТГВ или ТЭЛА является прерогативой и компетенцией клинициста.
- Рекомендуется оценка риска развития ВТЭО у беременной при подозрении на ТГВ или ТЭЛА в соответствии с Приложением Г18 для стратификации по группе риска и определения порядка проведения лечебно-диагностических мероприятий [590].
УДД 5 УУР C
Комментарий: при отсутствии клинического подозрения на ВТЭО госпитализация не требуется. Целесообразно оценить состояние вен нижних конечностей клинически. При неопределенных данных анамнеза и осмотра, подозрении на перенесенный венозный тромбоз необходимо провести дуплексное сканирование вен нижних конечностей.
- При клиническом подозрении на ТГВ или ТЭЛА (наличии симптомов возможного ТГВ или ТЭЛА) или при выявлении ТГВ во время беременности или в послеродовом периоде рекомендуется госпитализировать пациента [590].
УДД 5 УУР С
Комментарий: легочная эмболия - одна из основных причин смерти во время беременности. Смертность от не диагностированной легочной тромбоэмболии достигает 30%, своевременная диагностика и лечение снижает смертность от ТЭЛА до 2-8% [591]. В ретроспективном анализе Peter S Heyl с соавт. отношение числа летальных исходов, связанных с беременностью, к числу живорождений (pregnancy-related mortality ratio, PRMR), составило 1,6/100 000. (при кесаревом сечении PRMR = 2,8 (95 % ДИ = 1,8-4,2), при вагинальных родах PRMR = 0,2 (95 % ДИ = 0,1-0,5). Женщины в возрасте 35 лет и старше имели самый высокий PRMR = 2,6 на 100 000 живорождений. Каждая пятая умершая (21,7%) сообщила по крайней мере о двух симптомах, указывающих на легочную эмболию за несколько дней до смерти. Ранняя диагностика тромбоэмболии легочной артерии имеет решающее значение для снижения заболеваемости и смертности от ТЭЛА во время беременности. Тактика диагностики и лечения ТГВ во время беременности должна обеспечивать эффективную профилактику и раннюю диагностику ТЭЛА. Однако многие клинические инструменты диагностики ТЭЛА (например, шкалы вероятности, стратификация пациентов на группы риска, лабораторные показатели) ограничены в применении для беременных и качественные данные оценки их применения отсутствуют. В связи с этим существуют расхождения и противоречия в рекомендациях профессиональных сообществ в отношении алгоритма диагностики ТЭЛА. Сравнительный анализ позиций профессиональных сообществ по диагностике ТЭЛА у беременных представлены в обзорах Wan T. С соавт. 2017 года и Cohen S.L. с соавт. 2020 г. [590,592]. В указанных обзорах рассмотрены рекомендации 7 зарубежных профессиональных сообществ [583,590].
- Australasian Society of Thrombosis and Haemostasis and the Society of Obstetric Medicine of Australia and New Zealand (ASTHSOMANZ)
- American Thoracic Society and Society of Thoracic Radiology (ATSSTR)
- European Association of Nuclear Medicine (EANM)
- European Society of Cardiology (ESC)
- Working Group in Women’s Health of the Society of Thrombosis and Haemostasis (GTH)
- Society of Obstetricians and Gynaecologists of Canada (SOGC)
- Royal College of Obstetricians and Gynaecologists (RCOG).
Ключевая информация, представленная в данных обзорах:
Шкалы вероятности (предиктивные шкалы), такие как шкала Уэллса (Wells score), пересмотренная шкала Женева (Geneva score), широко применяются у небеременных пациентов. Это балльные системы для разделения пациентов на группы риска/вероятности ТЭЛА. Беременные исключались при разработке этих шкал. Соответственно, в них учитываются факторы, важные у небеременных пациентов, но существенно менее значимые у беременных (возраст старше 65 лет, операция или перелом конечности в течение последнего месяца). В пяти из семи рекомендациях ЗПС применение шкал вероятности не рекомендуется. В рекомендациях еще одного применение шкал вероятности вообще не рассматривается. В рекомендациях ESC использование предиктивных инструментов рекомендуется, однако не указано, какую именно шкалу и как следует применять. Стратификация беременных по группам риска. Стратификация беременных по группам риска предлагается в рекомендациях 6 из 7 зарубежных профессиональных сообществ (за исключением EANM). В рекомендациях ASTHSOMANZ, ATSSTR, ESC и GTH предлагается разделение на группы высокого и «не-высокого» риска (high risk, nonhigh risk), RCOG – на группы высокого и низкого риска (high risk, low risk), SOGC - на группы низкого и «не-низкого» риска (low risk, nonlow risk). Стратификация в рекомендациях зарубежных профессиональных сообществ влияет тактику лечения и диагностики, однако, в большинстве из них не дана четкая система отнесения беременной к той или иной группе риска. В частности, рекомендации GTH содержат список факторов риска без системы оценки, рекомендации ROCG предоставляют факторы риска и систему оценки, но в версии, не учитывающей диагностические тесты. В отдельных клинических исследованиях описываются варианты стратификации беременных на группы риска ТЭЛА с использованием различных инструментов с различной точностью. Например, в работе Righini с соавторами использована пересмотренная шкала Женева [593]. В группе низкого риска оказалось 4% пациенток с ТЭЛА (7 из 192), в группе среднего риска - 9% (18 из 200), в группе высокого риска – 100% (3 из 3), при этом при дальнейшем наблюдении не зарегистрированы эпизоды эмболии у пациенток, которым не назначена медикаментозная профилактика. Имеются примеры применения адаптированных к беременности алгоритмов стратификации (алгоритм YEARS) [594]. Однако, учитывая важность стратификации риска, необходимы дальнейшие исследования, чтобы определить оптимальный алгоритм стратификации.
Эмпирическое лечение. Смерть от ТЭЛА может произойти в течение 30 минут, что намного меньше среднего времени проведения диагностических мероприятий. Ранний старт антикоагуляции у небеременных пациенток улучшает частоту развития ТЭЛА, смертность и отдаленные результаты. Таким образом, ранняя эмпирическая антикоагуляция может иметь ключевое значение в защите беременной от ТЭЛА. 4 из 7 рекомендаций зарубежных профессиональных сообществ предлагают эмпирическое лечение (антикоагуляцию) до окончания диагностических мероприятий. RCOG и ESC рекомендуют антикоагуляцию всем беременным при подозрении на ТЭЛА, GTH и ATSSTR – беременным с высоким риском ТЭЛА. В рекомендациях ASTHSOMANZ, EANM и SOGC эмпирическая антикоагуляция не рассматривается. Рекомендации эмпирической антикоагуляции не имеют доказательной базы преимуществ такого подхода. При этом следует учитывать, что применение антикоагулянтов несет определенные риски (геморрагические осложнения, ГИТ, теоретический риск потери плода или преждевременных родов)[595,596].
Д-димеры. Идея использования определения уровня Д-димеров в диагностике ТЭЛА у беременных основана на предположении, что «нормальный» уровень Д-димеров позволит надежно исключить ТЭЛА. Однако при наличии ТГВ следует учитывать его влияние на уровень Д-димеров. При отсутствии ТГВ точность отрицательного теста на Д-димеры (например, уровень Д-димеров) также сомнительна. To M.S. описал случай подтверждения ТЭЛА у пациентки после двух отрицательных тестов на Д-димеры [597]. Использование тестирования Д-димеров рекомендуется только в двух руководствах - ESC и GTH. Рекомендации GTH не учитывают степень риска ВТЭО и триместр, по ESC тестирование применимо только для беременных «не-высокого» (nonhigh risk) риска ТЭЛА. Остальные 5 сообществ (ASTHSOMANZ, ATSSTR, EANM, RCOG и SOGC) не рекомендуют использовать определение Д-димеров в комплексе диагностики ТЭЛА при беременности.
Ультразвуковое исследование вен нижних конечностей (УЗИ) до расширенной визуализации. В 2 из 7 зарубежных профессиональных сообществ (ASTHSOMANZ и EANM) не рекомендуется ультразвуковое исследование вен нижних конечностей (далее – УЗИ) до применения методов расширенной визуализации. Остальные пять зарубежных профессиональных сообществ (ATS-STR, ESC, GTH, RCOG и SOGC) предлагают диагностические алгоритмы, в которых УЗИ используется до расширенной визуализации.
Во всех пяти указанных руководствах рекомендуется дополнительное обследование при отрицательных результатах УЗИ. В ATSSTR, ESC и RCOG Узи рекомендуется только при наличии симптомов ТГВ. В GTH и SOGC рекомендуется УЗИ всем беременным при подозрении на ТЭЛА (вне зависимости от наличия симптомов ТГВ) до расширенной визуализации для отсева пациенток, которым не нужна визуализация с применением рентгеновского излучения. Рекомендации зарубежных профессиональных сообществ различаются по порядку применения УЗИ, эмпирического лечения и тестирования на Д-димеры. Из них, рекомендующих УЗИ всем пациенткам: SOGC рекомендует начать диагностические мероприятия с УЗИ; GTH рекомендует для пациенток высокого риска ТЭЛА начать с антикоагуляции с последующим тестированием на Д-димеры до проведения УЗИ; GTH рекомендует для пациенток «не-высокого» риска начать с тестирования на Д-димеры до проведения УЗИ. Из зарубежных профессиональных сообществ, рекомендующих УЗИ пациенткам только с симптомами ТГВ: RCOG и пациентки высокого риска по ATSSTR и ESC – начать антикоагуляцию до УЗИ; для пациенток «не-высокого» риска ATSSTR – начать с УЗИ, ESC – Д-димеры и эмпирическая антикоагуляция до УЗИ. ESC рекомендуют МР-венографию, если сохраняется подозрение на ТГВ при отрицательном УЗИ. Расширенная визуализация. Под расширенной визуализаций понимается прямая визуализация ТЭЛА с помощью КТ- ангиопульмонографии, и сцинтиграфия легких (планарная сцинтиграфия легких, вентиляционно-перфузионная сцинтиграфия легких, V/Q сцинтиграфия легких, V/Q-сканирование). Текущие рекомендации ЗПС расходятся в оценке необходимости предварительной (до КТ- ангиопульмонографии или сцинтиграфии) рентгенографии грудной клетки, а также в определении основного способа расширенной визуализации. Все рекомендации содержат ремарку: необходимо провести любое доступное исследование расширенной визуализации, чтобы предотвратить задержку лечения.
В описанной выше работе Cohen S.L. с соавт. 2020 г. по сравнительному анализу позиций 7 профессиональных сообществ по диагностике ТЭЛА у беременных (ASTHSOMANZ, ATSSTR, EANM, ESC, GTH, SOGC, RCOG) предлагается авторский тактико-диагностический алгоритм [590]. Особого внимания требует рекомендация авторов при клиническом подозрении на ВТЭО и отрицательных данных УЗИ использовать методы расширенной визуализации ТЭЛА. Это подразумевает, что в описанной ситуации беременная должна быть госпитализирована. Выявление ТГВ также не исключает необходимости выполнения дополнительных исследований (КТ- ангиопульмонографии или рентгенография грудной клетки с последующей сцинтиграфией легких).
- При подозрении на ТЭЛА (наличии симптомов возможной ТЭЛА) во время беременности и в послеродовом периоде и отнесении пациентки к группе не-низкого риска развития ВТЭО в соответствии с Приложением Г18 рекомендуется до проведения диагностических мероприятий начать терапию лечебными дозами НМГ по текущему весу или по весу пациентки на момент наступления беременности [84,598–602].
УДД 5 УУР С
- При подозрении на ТЭЛА во время беременности и в послеродовом периоде и отнесении пациентки к группе низкого риска развития ВТЭО в соответствии с Приложением Г18 рекомендуется направить беременную на госпитализацию не начиная терапии антикоагулянтами [84,598–602].
УДД 5 УУР С
- При подозрении на ТГВ (наличии симптомов возможного ТГВ) во время беременности и в послеродовом периоде, отсутствии возможности немедленного проведения ультразвукового исследования и отнесении пациентки к группе не-низкого риска развития ВТЭО в соответствии с Приложением Г18 рекомендуется начать терапию лечебными дозами НМГ по текущему весу или по весу пациентки на момент наступления беременности и направить беременную на госпитализацию [84,598–602].
УДД 5 УУР С
- При подозрении на ТГВ во время беременности и в послеродовом периоде, отсутствии возможности немедленного проведения ультразвукового исследования и отнесении беременной к группе низкого риска развития ВТЭО в соответствии с Приложением Г18 рекомендуется направить беременную на госпитализацию не начиная терапию антикоагулянтами [84,598–602].
УДД 5 УУР C
- При подозрении на ТГВ во время беременности и в послеродовом периоде и возможности немедленного проведения ультразвукового исследования рекомендуется выполнить триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное) (A04.12.015.001) [85,581,588].
УДД 5 УРР C
Комментарий: основным методом инструментальной диагностики ТГВ служит ультразвуковое триплексное сканирование вен нижних конечностей. Ультразвуковое исследование вен нижних конечностей для подтверждения диагноза может выполнить любой специалист, занимающийся диагностикой и лечением заболеваний вен и имеющий практический опыт выполнения ультразвукового исследования. Ультразвуковое исследование вен с оформлением заключения (протокола) должно проводиться врачом ультразвуковой диагностики. Врач-хирург, врач-сердечно-сосудистый хирург вправе использовать УЗИ-аппарат при осмотре пациента для сканирования вен с целью уточнения особенностей состояния или поражения венозной системы и определения тактики профилактики и лечения [581]. Запись с интерпретацией и клинической оценкой обнаруженных при сканировании особенностей и характеристик вен конечностей вносится в протокол врачебного осмотра (клиническое заключение) в произвольной форме.
- При подозрении на ТГВ (наличии симптомов возможного ТГВ) во время беременности и в послеродовом периоде и отрицательных данных дуплексного сканирования вен нижних конечностей рекомендуется направить беременную на госпитализацию не начиная терапию антикоагулянтами для окончательного исключения ВТЭО [84,598–602].
УДД 5 УУР С
Комментарий: госпитализация в описанной ситуации призвана обеспечить возможность достоверного исключения изолированного тромбоза подвздошных вен и/или проведения серии ультразвуковых исследований в динамике, а также исключения ТЭЛА. Возможности ультразвукового исследования в диагностике ТГВ подвздошных вен весьма ограничены. По данным Torkzad с соавт., между 23 и 37 неделями беременности с помощью УЗИ выявляется около 42% тромбозов тазовых вен, в то время как с помощью МРТ удалось диагностировать 98,5% [603]. Предпочтительны протоколы МРТ без применения гадолиния. В приведенной выше работе Cohen S.L. с соавт. 2020 г. по сравнительному анализу позиций 7 профессиональных сообществ по диагностике ТЭЛА у беременных (ASTHSOMANZ, ATSSTR, EANM, ESC, GTH, SOGC, RCOG) особого внимания заслуживает рекомендация авторов при клиническом подозрении на ВТЭО и отрицательных данных УЗИ использовать методы расширенной визуализации ТЭЛА [590]. Окончательно необходимость госпитализации для наблюдения или обследования в условиях стационара определяет врач-хирург или врач-сердечно-сосудистый хирург стационара при поступлении пациентки.
- Не рекомендуется рутинно использовать методы расширенной визуализации с лучевой нагрузкой для оценки состояния проксимального сегмента тромба во время беременности [603,604].
УДД 4 УУР C
Комментарий: в рекомендациях зарубежных профессиональных сообществ КТ-АПГ и сцинтиграфия легких (планарная сцинтиграфия легких, вентиляционно-перфузионная сцинтиграфия легких, V/Q сцинтиграфия легких, V/Q-сканирование) методы расширенной визуализации предлагаются только для диагностики ТЭЛА. Состояние проксимального сегмента тромба у беременной в большинстве случаев не влияет на тактику лечения. Основные методы визуализации в диагностике ТГВ и тромбоза вен таза во время беременности - неинвазивные и неионизирующие, дуплексное сканирование вен и МРТ. Лучевые методы могут применяться в особых ситуациях (например, необходимость проведения тромболизиса при угрозе конечности, рассмотрение целесообразности постановки кава-фильтра при невозможности проведения антикоагулянтной терапии, необходимость диагностики (подозрение на тромбоз вен таза) при недоступности МРТ и т.п.).
- При отрицательном результате дуплексного сканирования и сохранении симптомов возможного ТГВ рекомендуется повторение триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное) (A04.12.015.001) [588].
УДД 5 УУР C
Комментарий: при сохранении симптоматики целесообразно провести повторное дуплексное сканирование вен нижних конечностей также на 7 день от первого исследования [588].
- При отрицательном результате триплексного сканирования, сохранении симптомов возможного ТГВ и возможности амбулаторного наблюдения (доступность проведения дуплексного сканирования вен нижних конечностей в динамике, предпочтение амбулаторного наблюдения пациенткой, доступность неотложной медицинской помощи) рекомендуется наблюдение и повторение триплексного сканирования нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное) (A04.12.015.001) [588].
УДД 5 УУР C
- При выявлении любого ТГВ во время беременности и в послеродовом периоде рекомендуется начать терапию лечебными дозами НМГ [588].
УДД 5 УУР C
- Не рекомендуется использовать лабораторные показатели (коагулограмма, уровень Д-димеров) в оценке риска развития или в диагностике ТГВ при беременности и в послеродовом периоде [588].
УДД 5 УУР C
- Рекомендуется выписка на амбулаторное лечение ТГВ во время беременности или в послеродовом периоде при следующих условиях [588]:
- отсутствие угрозы конечности;
- отсутствие прогрессирования ТГВ в период наблюдения на фоне АКТ;
- отсутствие признаков ТЭЛА в период наблюдения на фоне АКТ;
- доступность и возможность наблюдения и проведения антикоагулянтной терапии амбулаторно.
УДД 5 УУР C
3.8.1.4. Особенности терапии ТГВ во время беременности и в послеродовом периоде
- При необходимости проведения терапии с помощью НМГ рекомендуется подбор дозы по текущему весу или по весу пациентки на момент наступления беременности [589].
УДД 5 УУР C
- При развитии ТГВ /ВТЭО во время беременности рекомендуется антикоагулянтная терапия лечебными дозами НМГ до завершения беременности и не менее 6 недель после родов при общей продолжительности терапии не менее 3 месяцев [588].
УДД 5 УУР С
- Не рекомендовано назначать антикоагулянтную терапию при повышении уровня Д-димеров в отсутствие клинических признаков ВТЭО [580,605,606].
УДД 3 УУР В
- Рекомендуется для определения показаний к компрессионной терапии при беременности и в послеродовом периоде использовать показания к компрессионной терапии для небеременных [583,607].
УДД 5 УУР С
- При развитии во время беременности ТГВ рекомендуется как можно более ранее (немедленное) начало компрессионной терапии с целью уменьшения боли, ощущения отека, обеспечения ранней активизации беременной и профилактики развития ПТБ [607].
УДД 5 УУР С
- При ТГВ у беременной в анамнезе рекомендуется применение компрессионной терапии во время беременности при наличии симптомов и проявлений ПТБ с целью уменьшения/устранения этих симптомов [607].
УДД 5 УУР С
Комментарий: основное назначение компрессионной терапии при перенесенном ТГВ – уменьшение или устранение симптомов и проявлений ПТБ («венозных» симптомов и отеков). Целесообразность применения компрессионной терапии и ее параметры определяет клиницист с учетом особенностей клинического случая.
3.8.2. Инвазивные вмешательства на фоне антикоагулянтной терапии
Использование антикоагулянтной терапии у пациентов, которым предстоит инвазивное вмешательство, представляет собой сложную задачу: с одной стороны, отмена АКТ временно увеличивает риск ВТЭО, с другой – любое хирургическое пособие увеличивает риск геморрагических осложнений. В случае развития последних потребуется отмена антикоагулянтной терапии на длительный срок, что повлечет за собой увеличение риска ВТЭО. Поэтому необходимо уравновесить эти два возможных события. Для этого необходимо оценить риск ВТЭО (таблица 20), риск геморрагических осложнений (таблица 2), определить время отмены АКТ, решить, использовать мост-терапию, или нет.
Таблица 20. Периоперационный риск ВТЭО
|
Риск ВТЭО |
Показания для АКТ |
||
|
Механические клапаны сердца |
Фибрилляция предсердий |
ВТЭО |
|
|
Высокий риск |
Протезирование митрального клапана Протезирование аортального клапана (шаровой, или дисковый) Недавний (в течение 6 месяцев) ишемический инсульт или транзиторная ишемическая атака |
CHA2DS2-VASc – 7-9 баллов Недавний ишемический инсульт (3 месяца) или транзиторная ишемическая атака Ревматическая болезнь сердца |
Недавнее ВТЭО (3 месяца) Тяжелые тромбофилии ( дефицит протеина С, протеина S, антитромбина III, антифософлипидный синдром) |
|
Средний риск |
Двустворчатый аортальный клапан в сочетании с: фибрилляцией предсердий, перенесенный инсульт или транзиторная ишемическая атака, гипертонической болезнью, сахарный диабет, ХСН, возраст старше 75 лет |
CHA2DS2-VASc – 4-6 баллов
|
ВТЭО в течение 3-12 месяцев Нетяжелая тромбофилия Рецидив ВТЭО в анамнезе Онкология |
|
Низкий риск |
Двустворчатый аортальный клапан без фибрилляции предсердий и факторов риска для ишемического инсульта |
CHA2DS2-VASc – 0-3 баллов
|
ВТЭО в анамнезе более 12 месяцев Нет других факторов риска ВТЭО |
Таблица 21. Риск геморрагических осложнений [85].
|
Минимальный риск кровотечения |
|
|
Стоматология |
Экстракция 1-3 зубов, парадонтальная хирургия, вскрытие абсцесса, имплантация зубного протеза |
|
Офтальмология |
Лечение катаракты или глаукомы |
|
Эндоскопия |
Эндоскопия без биопсии или резекции (пищевод, желудок, кишечник, трахея и бронхи) |
|
Дерматология и хирургия |
Удаление новообразований кожи и подкожной жировой клетчатки, вскрытие абсцесса подкожной жировой клетчатки. |
|
Сердечно-сосудистая хирургия |
Эндовенозные вмешательства на поверхностных венах, склерооблитерация поверхностных вен, минифлебэктомия |
|
Низкий риск кровотечения (низкая частота кровотечений и/или с незначительными последствиями кровотечения) |
|
|
Эндоскопия |
Эндоскопия с биопсией (пищевод, желудок, кишечник, трахея и бронхи) |
|
Урология |
Биопсия простаты или мочевого пузыря |
|
Рентгенэндоваскулярные диагностика и лечение |
Некоронарная ангиография |
|
Аритмология |
Электрофизиологическое исследование или катетерная абляция, имплантация кардиостимулятора или имплантируемого кардиовертера-дефибриллятора (кроме сложных анатомических условий, например, врожденный порок сердца). |
|
Высокий риск кровотечения (частые кровотечения и/или большие клинически значимые кровотечения) |
|
|
Эндоскопия |
Сложная эндоскопия (например, полипэктомия, ретроградная холангиопанкреатография и так далее.) |
|
Торакальная хирургия |
Все вмешательства |
|
Абдоминальная хирургия |
Все вмешательства |
|
Ортопедия |
Большая ортопедическая хирургия |
|
Урология |
Трансуретральная резекция простаты, экстракорпоральная ударно-волновая литотрипсия (ЭУВЛ) |
|
Любая специальность |
Биопсия внутренних органов (печени, почек, селезенки, поджелудочной железы, для верификации пристеночных образований легких и плевры), поясничная диагностическая пункция |
|
Анестезиология и реанимация |
Спинальная или эпидуральная анестезия; |
Оценив риск ВТЭО и геморрагических осложнений следует принять решение о дальнейшей АКТ исходя из следующего: высокий риск геморрагических осложнений – отмена антикоагулянтной терапии, в случае высокого риска ВТЭО – рассмотреть возможность мост-терапии; в случае низкого риска геморрагических осложнений – возможно возобновление и дальнейшее продолжение АКТ.
- Рекомендуется не изменять режим приема антикоагулянтов у пациентов, которым планируется хирургическое вмешательство с низким риском геморрагических осложнений [608–613].
УДД 3 УУР С
Комментарий: стоматологическая хирургия обычно сопровождается незначительным риском кровотечения и возможностью адекватного местного гемостаза [608]. Однако рекомендации часто основаны на невысоком качестве доказательств фармакологических протоколов и исследований [609]. Удаление зубов обычно безопасно в амбулаторных условиях без прерывания антикоагуляции или прерывание путем однократного пропуска очередной дозы ПОАК. благодаря возможности обеспечить надежный местный гемостаз [610–613]. Перипроцедурный гемостаз обеспечивается применением окисленной целлюлозы (АТХ группа: гемостатические средства для местного применения, B02BC02) или абсорбирующей желатиновой губки (АТХ группа: гемостатические средства для местного применения, B02BC01), хирургического шва, жидкости для полоскания рта #транексамовой кислотой** или компрессионной марли, пропитанной #транексамовой кислотой**.
3.8.2.1. Мост-терапия
Мост-терапия подразумевает использование парентерального антикоагулянта с коротким периодом полувыведения (НФГ** или НМГ) в период отмены орального антикоагулянта (АВК или ПОАК), принимаемого на постоянной основе.
- У всех пациентов, принимающих оральные антикоагулянты, в период прерывания терапии рекомендуются использовать механические и фармакологические средства профилактики ВТЭО в соответствии с оцененным риском [614–622].
УДД 1 УУР А
Комментарий: подходы к периоперационной профилактике ВТЭО обсуждаются в соответствующем разделе. Механические, фармакологические и комбинированные методы профилактики должны использоваться у всех пациентов на основании индивидуальной оценки риска ВТЭО и кровотечения. Лица с наличием ТГВ/ТЭЛА в анамнезе, как правило, имеют умеренный (малая хирургия) или высокий (большая хирургия) риск ВТЭО, что требует введения профилактических доз антикоагулянтов. Таким образом, обсуждаемые вопросы о целесообразности использования мост-терапии касаются преимущественно повышенных (промежуточных и лечебных) доз.
- Рекомендуется применение мост-терапии в предоперационном и послеоперационном периодах у пациентов с высоким риском ВТЭО [623–625].
УДД 5 УУР С
- Рекомендуется в качестве мост-терапии использовать низкомолекулярные гепарины (далтепарин натрия, АТХ: группа гепарина, B01AB04; надропарин кальция, АТХ: группа гепарина, B01AB06; эноксапарин натрия**, АТХ: группа гепарина, B01AB05; бемипарин натрия, АТХ: группа гепарина, B01AB12; парнапарин натрия**, АТХ: группа гепарина, B01AB07) [626–628].
УДД 4 УУР С
Комментарий: терапевтическую дозу НМГ следует использовать у пациентов с фибрилляцией предсердий, механическими клапанами сердца, ВТЭО в анамнезе в течение предшествующего месяца. Промежуточные дозы применяют в этих же случаях, но у пациентов с высоким риском геморрагических осложнений. [626,629,630].
- При использовании в качестве мост-терапии НМГ рекомендуется прекращение его введения за 24 часа до планируемого инвазивного вмешательства [120,631,632].
УДД 4 УУР C
- При использовании в качестве мост-терапии НФГ** рекомендуется прекращение его введения при внутривенной инфузии за 5 часов до процедуры, при подкожном введении за 12 часов [120,623,633].
УДД 4 УУР C
- У пациента с ТГВ в случае прерывания терапии оральными антикоагулянтами решение о возобновлении АКТ после инвазивного вмешательства рекомендуется принимать на основании индивидуальной оценки риска геморрагических осложнений (клиническая оценка гемостаза, количество отделяемого по дренажам и его характер, уровень гемоглобина и пр.)[634].
УДД 5 УУР C
- У пациентов с высоким периоперационным риском геморрагических осложнений рекомендуется начинать введение терапевтических доз НМГ или НФГ** не ранее чем через 48-72 часа [635–637].
УДД 2 УУР А
- У пациентов с низким периоперационным риском геморрагических осложнений рекомендуется начинать введение терапевтических доз НМГ или НФГ** в течении 24 часов [635–637].
УДД 2 УУР А
3.8.2.2. Инвазивные вмешательства на фоне ПОАК
- Для хирургических вмешательств с минимальным риском кровотечения и тех процедур, при которых кровотечение легко контролируется не рекомендуется рутинная отмена ПОАК [608–613].
УДД 3 УУР C
- Пациенту, принимающему ПОАК на постоянной основе, рекомендуется прервать терапию на период операции или инвазивной процедуры без проведения мост-терапии [635,638,639].
УДД 3 УУР В
Комментарий: снижение антикоагулянтного эффекта ПОАК предсказуемо, что позволяет спланировать кратковременное прекращение терапии ПОАК перед операцией. Вместе с тем доказано, что, использование двух антикоагулянтов повышает риск кровотечения [638]. В исследованиях ПОАК у пациентов с фибрилляцией предсердий (ROCKET AF, RE-LY) прерывание терапии встречалось в 25-30% случаев и не сопровождалось увеличением риска тромботических осложнений независимо от использования мост-терапии [640,641]. При этом риск развития больших кровотечений существенным образом увеличивался на фоне периоперационного введения гепаринов. По данным Дрезденского регистра, мост-терапия в период прерывания ПОАК не приводила к снижению риска развития тромботических осложнений (1,2% против 0,2%), но ассоциировалась с достоверным увеличением риска больших (2,3% против 0,2%) и любых (3,9% против 0,7%) кровотечений [638]. Проспективное когортное исследование PAUSE с участием 3007 пациентов, принимающих ПОАК по поводу фибрилляции предсердий, продемонстрировало безопасность отмены препарата за 1-4 дня (в зависимости от риска геморрагических осложнений и КлКр) и возобновление его приема через 1-2 дня после операции [639]. Риск развития тромботических и геморрагических осложнений оказался не увеличен в сравнении с прогнозируемыми величинами. Также было продемонстрировано отсутствие необходимости измерения остаточной активности препарата в плазме крови при своевременной отмене препарата. Таким образом, на сегодняшний день отсутствуют данные о необходимости мост-терапии в период прерывания терапии ПОАК.
- При низком/среднем риске геморрагических осложнений рекомендуется отмена ПОАК за 24 часа до вмешательства и возобновление приема возможно через 24 часа после манипуляции (таблица 22) [642].
УДД 3 УУР В
- При высоком риске геморрагических осложнений рекомендуется отмена приема ПОАК за 48 часов до выполнения планового инвазивного вмешательства. Возобновление приема рекомендуется начать через 48 часов после выполнения вмешательства (таблица 22) [642].
УДД 3 УУР В
- У пациентов с клиренсом креатинина ниже 30-50 мл/минуту рекомендуется отмена дабигатрана этексилата** за 48 часов при низком риске геморрагических осложнений, и за 72 часа при высоком. При использовании прямых ингибиторов Ха фактора нет необходимости ориентироваться на скорость клубочковой фильтрации (таблица 22) [642].
УДД 3 УУР В
Таблица 22. Срок отмены ПОАК перед плановым оперативным вмешательством [643].
|
Препарат |
Дабигатран этексилат ** |
Апиксабан** |
Ривароксабан** |
||||
|
Риск кровотечения |
Низкий |
Высокий |
Низкий |
Высокий |
Низкий |
Высокий |
|
|
КлКр (мл/мин) |
≥80 |
≥24 ч |
≥48 ч |
≥24 ч |
≥48 ч |
≥24 ч |
≥48 ч |
|
50-80 |
≥36 ч |
≥72 ч |
≥24 ч |
≥48 ч |
≥24 ч |
≥48 ч |
|
|
30-50 |
≥48 ч |
≥96 |
≥24 ч |
≥48 ч |
≥24 ч |
≥48 ч |
|
|
15-30 |
Противопоказан |
≥36 ч |
≥48 ч |
≥36 ч |
≥48 ч |
||
|
<15 |
Противопоказан |
Противопоказан |
Противопоказан |
||||
- Рекомендуется возобновление приема ПОАК после планового оперативного вмешательства в течение 24 часов (низкий геморрагический риск) или 48 часов (высокий геморрагический риск) после завершения вмешательства на при условии достижения стабильного гемостаза [639].
УДД 3 УУР В
3.8.2.3. Инвазивные вмешательства на фоне варфарина**
- Рекомендуется отмена варфарина** за пять дней до планируемого вмешательства и контроль МНО за 1 день до манипуляции [633,635,637,644–646].
УДД 2 УУР B
Комментарий: выполнение вмешательства возможно если МНО за день до оперативного вмешательства <1,5 [644,645]. Возможно более продолжительное время для нормализации МНО у пациентов пожилого возраста, с высоким терапевтическим окном варфарина** (МНО 2,5-3,5) [646].
- Возобновление приема варфарина** после манипуляции рекомендуется через 24 часа [633,635,637,644].
УДД 2 УУР B
Комментарий: после выполнения манипуляции следует использовать ту же дозу варфарина**, что и до вмешательства. Обычно период достижения целевых показаний МНО составляет 5-6 дней, поэтому в этот период необходимо использовать НФГ** или НМГ в качестве мост-терапии.
- Для хирургических вмешательств с низким и высоким риском кровотечения у пациентов с низким риском ВТЭО при отмене АВК не рекомендуется мост-терапия [633,635,637,642,647].
УДД 2 УУР В
3.8.2.4. Экстренные или срочные вмешательства
- При необходимости выполнения экстренного или срочного оперативного вмешательства на фоне терапии АВК рекомендуется переливание свежезамороженной плазмы (СЗП) для нормализации системы гемостаза [548,551,648].
УДД 3 УУР С
- При необходимости выполнения экстренного или срочного оперативного вмешательства на фоне терапии АВК рекомендуется переливание концентрата протромбинового комплекса** для нормализации системы гемостаза [548,549,649].
УДД 2 УРР В
Комментарий: трехкомпонентные концентраты протромбинового комплекса** могут потребовать дополнительной инфузии СЗП, в то время как основным осложнением 4-х компонентного КПК** являются тромбозы. Поэтому применение последнего должно быть максимально оправдано. По данным мета-анализа, объединяющего исследования по коррекции системы гемостаза у пациентов, длительно принимающих АВК с развитием угрожающего жизни кровотечения или потребности в экстренном оперативном вмешательстве, применение КПК** в сравнении с СЗП ассоциируется со снижением общей смертности и более быстрой нормализацией МНО [548].
- В случае экстренного оперативного вмешательства у пациентов, принимающих прямые оральные антикоагулянты рекомендуется рассмотреть возможность применения специфических средств для инактивации [551].
УДД 3 УРР С
Комментарий: эффективность и безопасность применения препаратов при угрожающих жизни кровотечениях обсуждается в соответствующем разделе. Идаруцизумаб изучался у пациентов, длительно принимающих дабигатран этексилата** и требующих экстренного оперативного вмешательства [551,554].
- В случае экстренного оперативного вмешательства у пациентов, принимающих прямые оральные антикоагулянты рекомендуется рассмотреть возможность применения неспецифических антидотов, таких как различные варианты концентратов протромбинового комплекса** [85,132,553].
УДД 2 УУР C
Комментарий: по данным мета-анализа применение различных видов КПК** у пациентов, принимающих ПОАК с развитием большого кровотечения или потребности в экстренном хирургическом вмешательстве ассоциируется с достижением эффективного гемостаза в 69-77% случаев [553].
3.8.3. Нейроаксиальная анестезия у пациентов, получающих АКТ
Нейроаксиальную анестезию использует в качестве интраоперационного обезболивания, для купирования болевого синдрома в послеоперационном периоде, в послеродовом периоде, либо для лечения хронической боли. Пациенты, получающие АКТ, подвержены повышенному риску геморрагических осложнений нейроаксиальной анестезии, в первую очередь эпидуральной гематомы позвоночника [650,651].
- Не рекомендуется выполнять нейроаксиальную анестезию у пациентов, получающих несколько антитромботических препаратов [652].
УУД 5 УРР C
- У пациентов, получающих НФГ** внутривенно, рекомендуется прекращение инфузии за 4-6 часов до применения нейроаксиальной анестезии и определение АЧТВ [652–654].
УДД 5 УРР C
- Возобновление внутривенной инфузии #НФГ** рекомендовано не ранее, чем через 1 часа после выполнения нейроаксиальной анестезии [652,654].
УДД 5 УРР C
Комментарий: при нейроаксиальной анестезии, выполненной травматично, возобновление инфузии НФГ** необходимо отложить на 24 часа [655].
- У пациентов, получающих НФГ** подкожно, нейроаксиальную анестезию рекомендовано выполнять не ранее, чем через 6 часов после последней инъекции НФГ** [652,656,657].
УДД 5 УРР C
- Возобновлять подкожное введение НФГ** рекомендуется не ранее, чем через 2 часа после выполнения нейроаксиальной анестезии [652,656,657].
УДД 5 УРР C
- У пациентов, получающих НМГ в профилактических дозировках, нейроаксиальную анестезию рекомендовано выполнять не ранее, чем через 12 часов после последней инъекции НМГ [634,658].
УДД 2 УРР В
- У пациентов, получающих НМГ в лечебных дозировках, нейроаксиальную анестезию рекомендовано выполнять через 24 часа после последнего введения НМГ [634,658].
УДД 2 УРР В
- Возобновлять подкожное введение НМГ рекомендовано не ранее чем 4 часа после выполнения нейроаксиальной анестезии [652,659].
УДД 5 УРР C
Комментарий: в случае травматичного выполнения пункции межоболочечных пространств спинного мозга следует воздержаться от возобновления введения НМГ на 12 часов [659].
- При использовании низких доз фондапаринукса натрия (2,5 мг) нейроаксиальную анестезию рекомендовано выполнять не ранее, чем через 36 часов после последней его инъекции, при клиренсе креатинина ниже 50 мл/мин – выполнение нейроаксиальных вмешательств рекомендуется выполнять не ранее, чем через 72 часа. При использовании высоких доз – либо воздержаться, либо выполнять вмешательство не ранее, чем через 4 дня после последней инъекции [652,660,661].
УДД 5 УРР С
- Возобновлять введение фондапаринукса натрия после выполнения нейроаксиальной анестезии рекомендуется не ранее чем через 6 часов после манипуляции, в случае травматичного выполнения – не ранее чем через 24 часа [660].
УДД 3 УРР В
- Выполнение нейроаксиальной анестезии у пациентов, принимающих ПОАК, рекомендовано не ранее чем через 5 периодов полувыведения антикоагулянта [662,663].
УДД 5 УРР С
Комментарий: ривароксабан** имеет период полувыведения от 5 до 9 часов, апиксабан** – в среднем 12 часов, эдоксабан от 10 до 14 часов, дабигатрана этексилат** от 12 до 17 часов. Основываясь на этих данных, безопасная пункция межоболочечных пространств спинного мозга возможна через 3-5 дней после последнего приема того или иного антикоагулянта. Необходимо оценивать скорость клубочковой фильтрации, в случае снижения ее ниже 30 мл/мин – рассматривать иные методы анестезии [663]. В ситуациях, когда у пациента высокий риск рецидива ВТЭО рекомендуется рассмотреть переход на НМГ, которые можно отменить за более короткий срок до выполнения пункции. Временные выполнения нейроаксиальной анестезии у пациентов, принимающих АКТ представлены в таблице 23.
- Возобновлять прием ПОАК рекомендуется не ранее, чем через 24 часа после выполнения нейроаксиальной анестезии [635,664,665].
УДД 5 УРР С
- Рекомендуется прекратить прием АВК за 5 дней до планируемой нейроаксиальной анестезии, выполнение которой будет возможно при нормальных показателях МНО [663].
УДД 5 УРР С
- Возобновлять прием АВК рекомендуется не ранее, чем через 24 часа после выполнения нейроаксиальной анестезии [663].
УДД 5 УРР С
Таблица 23. Временные интервалы для выполнения нейроаксиальной анестезии у пациентов, получающих АКТ
|
Антикоагулянт |
Время от последнего приема препарата до выполнения пункции |
Время от выполнения пункции до возобновления приема препарата |
|
Варфарин** |
5 дней |
24 часа |
|
НФГ** в/в |
4-6 часов |
2 часа |
|
НФГ** п/к профилактические дозы |
6 часов |
2 часа |
|
НФГ** (п/к, терапевтические дозы |
12 часов |
2 часа |
|
НМГ, профилактические дозы |
12 часов |
4 часа |
|
НМГ, терапевтические дозы |
24 часа |
4 часа |
|
Фондапаринукс натрия |
4 дня |
6 часов, в случае травматичного выполнения манипуляции – 24 часа |
|
Ривароксабан** |
3 дня |
6 часов |
|
Апиксабан** |
3 дня |
6 часов |
|
Эдоксабан |
3 дня |
6 часов |
|
Дабигатрана этексилат** |
5 дней |
6 часов |
3.8.4. Тактика лечения пациентов онкологического профиля с ТГВ/ТЭЛА
- У пациента с установленным онкологическим диагнозом с активным раком и наличием ТГВ/ТЭЛА рекомендуется проведение антикоагулянтной терапии на протяжении не менее 6 мес. АКТ, до тех пор, пока онкологический процесс не будет излечен, с последующей оценкой баланса риска и пользы продления антикоагуляции [88,280,666,667].
УДД 1 УУР A
Комментарий: под активным раком понимают первичную диагностику рака или любое лечение по поводу рака, начатое в течение 6 мес. до момента диагностики ВТЭО, наличие рецидивного, метастатического рака или заболевания вне ремиссии в момент диагностики ВТЭО [668]. Частота повторных ВТЭО у пациентов со злокачественными новообразованиями в течение 1-го года лечения достигает 20,7% по сравнению с пациентами без онкологических заболеваний, частота больших кровотечений - 12,4% и 4,9%, соответственно [666].
- У пациента с активным раком рекомендуются рассмотреть продление антикоагулянтной терапии сверх 6 мес. до полного излечения заболевания [88,333].
УДД 1 УУР А
Комментарий: под активным раком через 6 мес. лечения антикоагулянтами подразумевают продолжение пациентом специфического лечения (химиотерапия), наличие отдаленных метастазов или местной первичной/рецидивной опухоли [88]. Продленная терапия онко-ассоциированного тромбоза должна проводиться на основании индивидуальной оценки пользы и риска. По данным проведенных исследований и мета-анализов продленная терапия онко-ассоциированного тромбоза характеризуется относительной высокими цифрами рецидива ВТЭО (8-12%) и больших кровотечений (4-7%) [333,334,669,670].
- В качестве начальной и длительной терапии у пациентов с онкологическими заболеваниями и ТГВ/ТЭЛА рекомендуется отдавать предпочтение НМГ вместо АВК [86,215,667,671].
УДД 1 УУР А
Комментарий: по результатам сетевого мета-анализа рандомизированных клинических исследований длительное использование НМГ в качестве альтернативы АВК для лечения онкоассоциированного тромбоза ассоциируется со снижением риска рецидива ВТЭО на 36% без влияния на риск развития больших кровотечений и общую смертность [667]. В соответствии с базовым исследованием CLOT по сравнению эффективности и безопасности применения далтепарина натрия (АТХ: Группа гепарина, B01AB04) и АВК при онкоассоциированной тромбозе, полную терапевтическую дозу НМГ целесообразно использовать на протяжении 1 месяца лечения (далтепарин натрия 200 МЕ/кг в сутки) с последующим переходом на 75% от полной лечебной дозы (далтепарин натрия 150 МЕ/кг в сутки) [672].
- В качестве начальной и длительной терапии у пациентов с онкологическими заболеваниями и ТГВ/ТЭЛА рекомендуется отдавать предпочтение ПОАК вместо АВК [86,215,667].
УДД 1 УУР А
Комментарий: по данным сетевого мета-анализа рандомизированных клинических исследований длительное использование ПОАК в качестве альтернативы АВК для лечения онко-ассоциированного тромбоза ассоциируется со снижением риска рецидива ВТЭО на 54% без влияния на риск развития больших кровотечений и общую смертность [667,673].
- В качестве начальной и длительной терапии у пациентов с онкологическими заболеваниями и ТГВ/ТЭЛА рекомендуется отдавать предпочтение апиксабану** , ривароксабану**, эдоксабану вместо НМГ [86,215,667].
УДД 1 УУР В
Комментарий: эффективность и безопасность применения апиксабана** и ривароксабана**, эдоксабана в сравнении с далтепарином натрия при лечении онко-ассоциированного тромбоза была изучена в рамках специализированных рандомизированных исследований [674–677]. Проведенные позднее мета-анализы, объединяющие названные исследования с аналогичной работой по оценке эффективности и безопасности применения эдоксабана (не зарегистрирован в РФ) продемонстрировали достоверное снижение риска рецидива ВТЭО на 38-41% при отсутствии достоверного влияния на риск большого кровотечения и общей смертности [678–680]. При этом риск развития небольших, но клинически значимых кровотечений был увеличен в 1,45-1,65 раз. В исследованиях ривароксабана** и эдоксабана было отмечено преимущественное увеличение риска желудочно-кишечных кровотечений у пациентов с опухолями желудочно-кишечного тракта. В исследовании апиксабана** риск развития ЖКК не был увеличен в сравнении с терапией далтепарином натрия. Желудочно-кишечные кровотечения заняли около половины всей структуры больших кровотечений как при использовании апиксабана, так и при использовании далтепарина. В исследовании реальной клинической практики было показано, что апиксабан** в сравнении с ривароксабаном** и эноксапарином назначают более возрастным пациентам и больным с умеренным и значительным снижением почечной функции. Это не сказывается на частоте больших кровотечений при раке ЖКТ в целом, но может объяснять тенденцию, не достигшую, тем не менее, уровня статистической значимости, к повышению частоты больших кровотечений у пациентов с внутриполостным раком [681]. Таким образом, у пациентов с полостными опухолями пищеварительного тракта применять ПОАК следует с особой осторожностью на основании индивидуальной оценки пользы и риска. Следует также иметь в виду что во всех исследованиях изучалась эффективность и безопасность только полных лечебных доз апиксабана** и ривароксабана**, поэтому применение редуцированных дозировок в рамках продленной терапии онко-ассоциированного тромбоза не рекомендуется до появления новых данных.
3.8.5. Тромбоз глубоких вен у отдельных групп пациентов
3.8.5.1. Лечение ТГВ у пациентов травматолого-ортопедического профиля
- Всем больным травматологического профиля при верифицированном ТГВ рекомендуется АКТ терапевтическими дозами НФГ**, НМГ, фондапаринукса натрия, ПОАК и АВК, при отсутствии противопоказаний [84,85,122,126,279,341,682,683].
УДД 5 УУР С
- Лечение травматологических больных с ТГВ, которым предполагается хирургическое вмешательство на ОДА, а также которые находятся на ИВЛ, рекомендуется начинать с парентерального введения антикоагулянтов (НФГ**, НМГ) [84,85,126,683].
УДД 5 УУР С
- Пациентам травматологического профиля с ТГВ находящихся в стабильном состоянии, и которым не планируют выполнение оперативного вмешательства на ОДА, препаратами выбора следует считать ПОАК [84,85,122,126,279,341,682,683].
УДД 5 УУР С
- При выявлении в стационаре ТГВ у больного с повреждениями или заболеваниями ОДА и не нуждающегося по этому поводу в экстренном или срочном оперативном вмешательстве, рекомендуется проведение АКТ парентеральными препаратами (лечебные дозы НМГ предпочтительны) и динамический ультразвуковой контроль за состоянием тромба и венозного русла. После стабилизации тромботического процесса, подтверждённого данными УЗАС, и стихания острых клинических проявлений тромбоза (через 3-5 суток) возможно выполнение оперативного вмешательства на ОДА [684–686].
УДД 4 УУР C
- При выявлении в стационаре тромбоза илиокавального сегмента у больного с повреждениями или заболеваниями ОДА и нуждающегося по этому поводу в экстренном или срочном оперативном вмешательстве любой формы, из-за высокой вероятности прогрессирования тромботического процесса рекомендуется имплантация съёмной модели кава-фильтра с последующим выполнением предполагаемого оперативного вмешательства на ОДА [687,688].
УДД 4 УУР С
- При выявлении в стационаре тромба бедренно-подколенного сегмента у больного с повреждениями или заболеваниями ОДА и нуждающегося по этому поводу в экстренном или срочном оперативном вмешательстве, при невозможности имплантации съёмной модели кава-фильтра рекомендуется рассмотреть возможность перевязки (или пликация) поверхностной бедренной вены рассасывающейся лигатурой, с последующим выполнением предполагаемого оперативного вмешательства на ОДА и назначением лечебных доз антикоагулянтов [687–691].
УДД 4 УУР C
- При выявлении в стационаре изолированного ТГВ голени у пациента, нуждающегося в выполнении экстренного или срочного оперативного вмешательства на ОДА, рекомендуется проведение необходимого вмешательства и назначение АКТ в послеоперационном периоде на фоне динамического ультразвукового контроля состояния тромба и венозного русла [687,688].
УДД 4 УУР C
3.8.5.2. Тактика лечения ТГВ у пациентов неврологического профиля
Венозный тромбоз у пациентов неврологического профиля, как правило формируется в глубоких венах голени в ранние сроки основного заболевания и практически во всех случаях не сопровождается типичными клиническими проявлениями, а выявляется только при проведении УЗАС. Преимущественно ТГВ возникает на стороне двигательных нарушений, локализуясь, наиболее часто, в камбаловидных венах. Иногда первым признаком ТГВ является ТЭЛА. АКТ увеличивает риск геморрагической трансформации у пациентов с ишемическим поражением и увеличивает объем интракраниальной гематомы. Поэтому назначение терапевтических доз антикоагулянтов следует отложить на 10-14 дней. В начальном периоде следует использовать профилактические дозы.
- С целью выявления бессимптомного ТГВ у пациентов неврологического профиля рекомендуется определения концентрации Д-димера в крови (A09.05.051.001) на 4 сутки госпитализации и при выявлении его повышенных значений, рекомендуется выполнение триплексного сканирования нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное) (A04.12.015.001) [692].
УДД 4 УУР C
- Пациентам с ОНМК по ишемическому типу лечение ТГВ рекомендуется начинать с профилактических доз антикоагулянтов [693].
УДД 3 УУР В
- Пациентам с внутримозговой гематомой лечение ТГВ рекомендуется начинать с профилактических доз НФГ**. АКТ рекомендуется начинать со второго дня госпитализации при условии стабильного состояния пациента. На 10-14 день возможно рассмотреть вопрос о переводе пациента на прием ПОАК [693].
УДД 3 УУР В
- Пациентам с субарахноидальным кровоизлиянием лечение ТГВ рекомендуется начинать с профилактических доз НФГ**. АКТ рекомендуется начинать со второго дня госпитализации при условии стабильного состояния пациента [693].
УДД 3 УУР В
3.8.5.3. Тактика лечения ТГВ у пациентов с почечной недостаточностью
- Пациентам с 1-3 стадией ХБП при лечении ТГВ рекомендуется отдавать предпочтение ПОАК [341,342,378].
УДД 2 УУР А
Комментарий: результаты современных исследований, продемонстрировали схожую эффективность и безопасность использования ПОАК у пациентов с начальными стадиями ХБП. Следует избегать назначения дабигатрана этексилата** при клиренсе креатинина менее 30 мл/мин, апиксабана** и ривароксабана** - менее 15 мл/мин.
- Пациентам с 4-5 стадией ХБП при лечении ТГВ рекомендуется отдавать предпочтение НФГ** с последующим назначением АВК [694].
УДД 5 УУР C
Комментарий: НФГ** обладает коротким периодом полувыведения, терапию им легко контролировать c помощью АЧТВ, а АВК возможно использовать у пациентов с любой степенью тяжести ХБП
- При назначении НМГ или фондапаринукса натрия у пациентов с 3-4 стадией ХБП рекомендуется следовать инструкции к применению препаратов (таблица 24) [360,695].
УДД 2 УУР В
Таблица 24. Дозировка парентеральных антикоагулянтов в зависимости от степени нарушения почечной функции
|
Профилактическая доза |
Лечебная доза |
|
|
НФГ** |
КлКР <15 мл/мин - 5000 ЕД 2 раза в сутки |
коррекция дозы не предусмотрена, индивидуальная доза под контролем АЧТВ |
|
Эноксапарин натрия ** (АТХ: Группа гепарина, B01AB05) |
КлКР <30 мл/мин - уменьшить до 20 мг х 1 р/сут. |
КлКР <30 мл/мин - уменьшить до 1 мг/кг х 1 р/сут. |
|
Надропарин Кальция (АТХ: группа гепарина, B01AB06) |
КлКР <50 мл/мин - уменьшить дозу на 25-33% |
КлКР от 30 до 50 мл/мин - уменьшить дозу на 25-33% КлКР <30 мл/мин - противопоказан |
|
Далтепарин натрия (АТХ: Группа гепарина, B01AB04) |
КлКР <30 мл/мин – стандартные дозы до 10 сут. |
КлКР <30 мл/мин – индивидуальные дозы под контролем анти-Ха-активности |
|
Парнапарин натрия** (АТХ: группа гепарина, B01AB07) |
КлКР <30 мл/мин – подбор дозы под контролем анти-Ха-активности |
КлКР <30 мл/мин – подбор дозы под контролем анти-Ха-активности |
|
Бемипарин натрия1 (АТХ: группа гепарина, B01AB12) |
КлКР <30 мл/мин – уменьшить дозу до 2500 МЕ Контроль анти-Ха активности |
*КлКР <30 мл/мин – уменьшить дозу до 2500 МЕ Контроль анти-Ха активности |
|
Фондапаринукс Натрия (АТХ группа: прочие антикоагулянты, B01AX05) |
СКФ от 20 до 30 мл/мин - 1,5 мг х 1 р/сут или 2,5 мг через день СКФ <20 мл/мин - противопоказан |
СКФ <30 мл/мин - противопоказан |
1для бемипарина натрия зарегистрирована лечебная доза 3500 МЕ 1 раз в сутки в рамках длительной терапии ВТЭО, но не более 3-х мес.; н/д – нет указаний на коррекцию дозы при нарушении функции почек в официальной инструкции к препарату
3.8.5.4. Тактика лечения ТГВ у пациентов с ожирением
Лечение ТГВ у пациентов с избыточной массой тела представляет собой непростую задачу. В первую очередь это связано с тем, что парентеральные антикоагулянты подбирают по массе тела и у них есть максимально допустимая суточная доза. В настоящее время проведено несколько РКИ, которые продемонстрировали эффективность и безопасность ПОАК у пациентов с ожирением.
- У пациентов с ожирением рекомендуется использовать ПОАК в стандартных дозировках [696,697].
УДД 2 УУР А
Комментарий: по данным мета-анализа, объединяющего результаты 5 исследований, эффективность и безопасность применения ПОАК не отличалась от таковой при использовании НМГ и АВК у пациентов с ИМТ ≥40 кг/м или массой тела ≥10 кг [697].
- У пациентов с ожирением дозу НМГ рекомендуются подбирать по массе тела и/или в соответствии с инструкцией к препарату [122,132].
УДД 2 УУР В
Комментарий: подбор дозы НМГ по актуальной массе тела может требовать однократного назначения необычно большого количества препарата, что может противоречить инструкции: для далтепарина натрия максимальная разовая дневная доза при однократном введении не должна превышать 18000 МЕ, для других НМГ особые указания отсутствуют. Фармакодинамические особенности препаратов порождают опасения при введении больших доз в отношении риска развития кровотечений у пациентов с ожирением [698]. НМГ преимущественно распределяются в плазме крови и высоко васкуляризованных тканях, относительное количество которых уменьшено у лиц с ожирением, что чревато передозировкой. Исследования с оценкой антикоагулянтного ответа по уровню анти-Ха активности не показали различий между пациентами с ожирением и нормальной массой тела для дозы эноксапарина натрия** (максимальный вес 144 кг) и далтепарина натрия (максимальный вес 190 кг), подобранной по актуальной массе тела [699,700]. Исследования с изучением клинических исходов при использовании эноксапарина натрия** и далтепарина натрия в дозах, подобранных на основании актуальной массы тела у пациентов с ожирением, также не обнаружили значительного увеличения риска геморрагических осложнений [701,702]. В рамках подготовки клинических рекомендаций Американского общества гематологов авторы провели систематический обзор и обнаружили 5 исследований, среди которых ни одно напрямую не сравнивало использование доз НМГ, подобранных по актуальной массе тела (без максимальной суточной дозы) и ограниченных верхним пределом (с наличием максимальной суточной дозы). По результатам мета-анализа была выявлена тенденция в пользу доз, подобранных по актуальной массе тела, в виде снижения риска рецидива ВТЭО (ОР, 0,76; 95% ДИ, 0,11-5,45) без влияния на риск кровотечения и общую смертность [132]. Парнапарин натрия** у пациентов с ожирением может использоваться в дозе 0,4 мл (4250 анти -Ха МЕ) 1 раз в сутки в соответствии с пунктом инструкции к препарату, определяющему режим назначения для пациентов с повышенным риском ТГВ. Этот режим в отношении пациентов с ожирением изучен в исследовании BAFLUX [703] . Было продемонстрировано, что даже при наличии выраженного ожирения (индекс массы тела > 45 кг/м2 ) применение профилактической дозы препарата (4250 МЕ подкожно 1 раз в сутки) не менее эффективно, чем использование более высокой дозировки.
- У пациентов с ожирением и высоким риском рецидива ВТЭО или кровотечения рекомендуется рассмотреть подбор дозы НМГ под контролем анти-Ха активности [122,132].
УДД 2 УУР С
Комментарий: мета-анализ 7 исследований, выполненный рамках разработки клинических рекомендаций Американского общества гематологов не выявил преимуществ от подбора дозы НМГ под контролем анти-Ха активности [132]. При использовании подобранных по актуальной массе тела доз эноксапарина натрия** частота обнаружения показателя в целевом диапазоне достигала 45%, а при использовании далтепарина натрия – 71%, что не коррелировало с риском развития осложнений. При использовании лабораторного контроля отмечена недостоверная тенденция к увеличению риска рецидива ВТЭО и кровотечения. На основании полученных данных авторы сделали вывод об отсутствии пользы от подбора дозы НМГ под контролем анти-Ха активности у пациентов с ожирением. Ранее опубликованных рекомендации АССР предполагали возможность индивидуального подбора дозы НМГ у отдельных пациентов с ожирением. При этом целевой диапазон показателя зависит от кратности введения препарата и составляет 0,6-1,0 МЕ/мл через 4 часа после инъекции [122]. Уровень доказательств всеми авторами расценен, как очень низкий. В отсутствие достоверных сведений возможно предположить, что отдельные пациенты с ожирением могут иметь преимущество от контроля анти-Ха активности на фоне применения подобранных по актуальной массе тела доз НМГ.
- При использовании фондапаринукса натрия (АТХ группа: прочие антикоагулянты, B01AX05) рекомендуется применять дозу 10 мг один раз в день [696,704].
УДД 2 УУР А
Комментарий: субанализ исследования Matisse, включившего 4418 пациентов, из которых 11% имели массу тела более 100 кг и 28% имели ИМТ ≥30 кг/м2, изучавшего эффективность и безопасность применения фондапаринукса натрия в сравнении с внутривенной инфузией НФГ** при ТЭЛА или подкожным введением НМГ при ТГВ не выявил достоверных различий по эффективности и безопасности применения всех антикоагулянтов у пациентов с ожирением и без. Максимальный вес пациента в анализе эффективности составил 166 кг, в анализе безопасности – 120 кг [704].
3.8.5.5. Тактика лечения ТГВ у пациентов с тромбофилиями
- У пациентов с наследственной тромбофилией рекомендуется использовать те же подходы к антикоагулянтной терапии, как у пациентов без наследственной тромбофилии [294,705–707].
УДД 1 УУР А
Комментарий: данная рекомендации касается выбора вида, дозы, режима введения и длительности использования антикоагулянтов. Целесообразность тестирования на тромбофилию и длительность терапии антикоагулянтами обсуждаются в соответствующих разделах.
- У пациентов с подтвержденным тройно-позитивным АФС или АФС с наличием тромбозов в артериальном или микроциркуляторном русле не рекомендуется использование ПОАК [335,708,709].
УДД 1 УУР А
Комментарий: по данным мета-анализа 4 РКИ с участием 576 пациентов применение ПОАК в сравнении с АВК у пациентов с АФС, включая тройно-позитивные случаи, ассоциируется с увеличением риска артериальных тромбозов в 5 раз [335].
- У пациентов с подтвержденным АФС рекомендуется длительная АКТ [336,710].
УДД 2 УУР А
- У пациентов с АФС и ТГВ рекомендуется применение НФГ** с последующим переводом на АВК [711,712]
УДД 5 УУР С
- У пациентов с выявленным АФС и рецидивирующим течением ВТЭО на фоне АКТ варфарином** при показателях МНО 2-3 рекомендуется увеличение дозы препарата до целевого интервала МНО до 3,0-4,0 или переход на НМГ [201].
УДД 5 УУР С
3.9. Тромбоз глубоких вен верхних конечностей
3.9.1. Эпидемиология
Тромбозы глубоких вен верхних конечностей (ТГВ ВК) составляют 10-11% от всех острых венозных тромбозов, и встречаются с частотой 4-10 случаев на 100000 населения [713,714].
ТГВ ВК осложняются ТЭЛА в 6-15% случаев, и ассоциируются с развитием посттромботической болезни верхних конечностей у 25-77% пациентов [387,715,716].
Следует различать первичные и вторичные ТГВ ВК. На долю первичных приходится 33% всех ТГВ ВК, к ним относят идиопатические тромбозы, когда провоцирующий фактор выявить не удается и синдром Педжета-Шреттера. Впервые эпоним – синдром Педжета-Шреттера был предложен в 1948 году Hughes E.S., который опубликовал обзор 320 случаев ТГВ ВК [717]. Синдром Педжета-Шреттера или тромбоз усилия развивается в следствии интенсивной физической нагрузки мускулатуры верхнего плечевого пояса у пациентов с наличием синдрома верхней апертуры грудной клетки (СВАГК). Другое название СВАГК – синдром выхода из грудной клетки.
СВАГК - группа клинических синдромов, вызванная врожденной или приобретенной компрессией плечевого сплетения или подключичных сосудов, вследствие их прохождения через верхнюю апертуру грудной клетки. Частота новых случаев СВАГК варьируется от 3 до 80 на 1000 новых случав в год, заболевание встречается чаще у взрослых пациентов в возрасте от 25 до 50 лет, женщины болеют в 3 раза чаще, чем мужчины [718,719]. На долю венозной формы СВАГК приходится только 4%. Чаще, в 95% развивается нейрогенная форма СВАГК, реже в 1% - артериальный СВАГК. Наличие СВАГК опасно не только развитием синдрома Педжета-Шреттера, но и лежит в основе развития синдрома МакКлири (McCleery).
Синдром МакКлири (McCleery) - перемежающаяся обструкция подключичной вены при отсутствии венозного тромбоза клинически проявляется периодически возникающим отеком и нарушением окраски кожного покрова верхней конечности. Именно McCleery R.S. в 1951 г. детально описал синдром и предположил, что его основой является компрессия подключичной вены подключичной связкой и передней лестничной мышцей [720].
Различают следующие причины компрессии подключичной вены: сочленение ключицы и первого ребра, добавочное шейное ребро, гипертрофированная передняя лестничная мышца, удлиненный поперечный отросток 7 шейного позвонка, гипертрофированная подключичная мышца.
На долю вторичных ТГВ ВК приходится 67% всех ТГВ ВК. Вторичный ТГВ ВК чаще связан с наличием внутривенного катетера, но выделяют и другие его причины: наличие искусственного водителя ритма, онкология, иммобилизация, операции на верхних конечностях.
Согласно мета-анализу, опубликованному в 2019 г., частота развития ПТБ была выше у пациентов с неспровоцированным ТГВ ВК, чем у вторичных, тогда как рецидивы отмечали чаще у пациентов с вторичным ТГВ ВК [721].
3.9.2. Критерии диагноза
Наиболее частыми признаками ТГВ ВК служат набухание подкожных вен (усиленный венозный рисунок) как на верхней конечности, так и на передней поверхности грудной клетки (100%), отек верхней конечности (93%), цианоз (77%), боль, усиливающаяся при физической нагрузке (66%). Иногда симптоматическая ТЭЛА может быть первым признаком ТГВ ВК. Клиническая оценка имеет низкую специфичность (30–64%), и диагноз должен быть подтвержден дополнительным диагностическим исследованием [227].
3.9.2.1. Лабораторная диагностика
- Определение концентрации Д-димера в крови (A09.05.051.001) рекомендуется только для исключения тромбоза у амбулаторных пациентов при подозрении на ТГВ ВК [722,723].
УДД 2 УУР А
Комментарий: определение уровня Д-димера в алгоритме диагностики ТГВ ВК имеет ряд существенных ограничений. Во-первых, до настоящего времени место Д-димера в диагностике ТГВ ВК достаточно не изучено. Во-вторых, наличие у пациентов с ТГВ ВК сопутствующих заболеваний, связанных с повышением уровня Д-димера, затрудняет трактовку полученного результата [722]. В исследование Sartori M. вошло 239 пациентов, у которых врачами первичного звена был заподозрен ТГВ ВК. Всем пациентам выполнили определение уровня Д-димера (пороговое значение: ≤500 нг / мл) и УЗАС. При первичном УЗАС ТГВ ВК был обнаружен у 24 (10%) пациентов. Чувствительность и специфичность Д-димера для ТГВ составили 92% (95% ДИ: 73-99%) и 60% (95% ДИ: 52-67%) соответственно, с отрицательной прогностической ценностью 98% (95% ДИ: 93-100%) [723]. Таким образом, при ТГВ ВК определение уровня Д-димера представляет интерес только для исключения тромбоза у амбулаторных пациентов при подозрении на ТГВ ВК.
3.9.2.2. Инструментальная диагностика
- Пациентам с подозрением на ТГВ ВК в качестве первичной инструментальной диагностики рекомендуется дуплексное сканирование вен верхних конечностей (A04.12.005.004) [724–726].
УДД 1 УУР A
- При недостаточной информативности УЗАС, а также для выявления и уточнения источника компрессии вены, пациенту рекомендуется выполнение флебографии (флебография верхней конечности прямая (A06.12.036) или компьютерной томографии (компьютерно-томографическая ангиография сосудов верхних конечностей (A06.12.054)) [727].
УДД 5 УУР С
- Для выявления экстравазального сдавления, как причины тромбоза, рекомендуется использование при ультразвуковом исследовании функциональных проб в виде провокационных маневров с максимальным отведением и ротацией руки кнаружи [728].
УДД 5 УУР С
3.9.3. Тактика лечения
Задачи лечения ТГВ ВК: предотвращение прогрессирования тромбоза и легочной эмболии, развития посттромботической болезни, профилактика рецидива тромбоза. В настоящее время подходы к лечению ТГВ ВК неоднозначны, одни рекомендации настаивают на терапии антикоагулянтами [279], другие предлагают активную хирургическую тактику с обязательным назначением после операции АКТ. Так, согласно рекомендациям Американского Венозного Форума 2017 г., первым этапом в лечении подмышечно-подключичного венозного тромбоза у пациентов с синдромом верхней грудной апертуры должен быть тромболизис с последующим декомпрессионным хирургическим вмешательством [387].
3.9.3.1. Антикоагулянтная терапия
- Пациентам с первичным тромбозом глубоких вен верхних конечностей рекомендуется антикоагулянтная терапия в течение трех месяцев [729–732].
УДД 4 УУР С
Комментарий: все пациенты с ТГВ ВК должны получать АКТ. Схемы применения, дозировки лекарственных препаратов аналогичны таковым при ТГВ в системе НПВ.
- У пациентов с ТГВ ВК, которым выполняется тромболизис, рекомендуется такая же интенсивность и длительность АКТ, что и пациентам с ТГВ ВК, которым тромболизис не проводился [387].
УДД 5 УУР С
3.9.3.2. Ранняя дезобструкция (удаление тромбов)
- Для лечения первичного подмышечно-подключичного венозного тромбоза у пациентов с синдромом верхней грудной апертуры рекомендуется рассмотреть возможность выполнения тромболизиса с последующей декомпрессией верхней грудной апертуры [387,725,733–736].
УДД 2 УУР В
Комментарий: выполнение тромболизиса в острой фазе ТГВ ВК эффективно для удаления тромба и ведет к быстрому купированию симптомов. Проведение системного тромболизиса не показано. Оптимальной стратегией удаления тромба является выполнение КТЛ.
- Рекомендуется выполнять КТЛ в первые 14 дней после развития ТГВ ВК. Организованный тромб старше двух недель менее подвержен тромболизису [227,387,733].
УДД 3 УУР С
3.9.3.3. Хирургическая коррекция синдрома грудного выхода
Активная тактика с выполнением резекции первого ребра после успешного тромболизиса значительно улучшает исходы: полное разрешение симптомов наблюдают в 95%, восстановление проходимости вены при УЗАС в 94% случаев [733].
- Пациентам с ТГВ ВК, перенесших раннюю дезобструкцию, рекомендуется рассмотреть возможность выполнения резекции первого ребра, если есть доказательства синдрома венозного выхода из грудной клетки [387,733].
УДД 3 УУР С
Комментарий: существует несколько хирургических доступов для резекции первого ребра: подмышечный, подключичный и надключичный. Подмышечный доступ обеспечивает хорошую визуализацию реберно-ключичного пространства в месте компрессии и обеспечивает хороший косметический результат. Однако, показания к данному доступу могут быть ограничены необходимостью обширного объема венозной реконструкции и риском повреждения длинного грудного нерва. Применение подключичного доступа обеспечивает превосходную визуализацию первого ребра и вены для выполнения реконструкции [737]. Его дополнительные преимущества - минимальное воздействие на плечевое сплетение, диафрагмальный нерв и подключичную артерию, которые не вовлекаются в синдром верхней грудной апертуры, и возможность придания пациенту положения лежа на спине для выполнения флебографии.
- Стентирование подключичной вены после хирургической декомпрессии при синдроме верхней грудной апертуры рекомендуется при значительных рефрактерных поражениях, но доказательств относительно долгосрочной безопасности этой методики недостаточно [387].
УДД 5 УУР С
- Не рекомендуется рассматривать стентирование подключичной вены при синдроме верхней грудной апертуры в качестве альтернативы открытой декомпрессии [387].
УДД 5 УУР C
Комментарий: в настоящее время нет единого мнения о необходимости эндоваскулярного вмешательства (баллонная ангиопластика и стентирование) после выполнения костной декомпрессии. При принятии решения целесообразно ориентироваться на сохранение симптомов обструкции вен после декомпрессии.
3.10. Катетер-ассоциированный тромбоз глубоких вен
Повреждение сосудистой стенки во время введения катетера, гиперкоагуляция в ответ на повреждение стенки вены, замедление тока крови, наличие катетера в вене могут привести к катетер-ассоциированному тромбозу. Частота симптоматических форм катетер-ассоциированного тромбоза крайне мала и составляет 1-5%.
Факторами риска являются: место пункции и установки центрального венозного катетера, его тип, ВТЭО в анамнезе. Наиболее частой локализацией катетер-ассоциированного тромбоза является бедренная вена [738].
- Пациентам с катетер-ассоциированным тромбозом рекомендуется терапия лечебными дозами антикоагулянтов в течение как минимум трех месяцев [279,739,740].
УДД 3 УУР В
- При ТГВ ВК, связанном с ЦВК, не рекомендуется удалять катетер если в нем есть необходимость, при условии, что он функционирует. АКТ продолжают до удаления ЦВК [741].
УДД 4 УУР С
- У пациентов с тромбозом, связанным с катетером, рекомендуется рассмотреть его удаление в следующих ситуациях: когда в нем нет необходимости; он не работает; антикоагулянты противопоказаны; симптомы не исчезают при назначении АКТ; тромбоз опасен для конечностей или жизни [742].
УДД 5 УУР С
- АКТ рекомендовано проводить минимум 3 месяца после удаления устройства центрального венозного доступа [226,279,741].
УДД 5 УУР С
3.11. Эластичная компрессия
- При ТГВ рекомендуется начать использовать компрессионную терапию с давлением 30-40 мм.рт.ст. в первые 24 часа от момента заболевания для уменьшения боли и отека, ускорения реканализации вен [743–747].
УДД 2 УУР А
Комментарий: применение компрессионного трикотажа в первые сутки после развития ТГВ позволяет уменьшить болевые ощущения и отечность [745].
- При ТГВ рекомендуется раннее назначение компрессионного трикотажа, что в совокупности с АКТ позволяет уменьшить риск прогрессирования тромбоза [745,748].
УДД 2 УУР А
- Рекомендуется применение эластичной компрессии как можно раньше после подтверждения диагноза ТГВ с целью профилактики ПТБ [607,749–752].
УДД 1 УУР А
Комментарий: компрессионная терапия может значительно снизить частоту ПТБ легкой и средней степени тяжести.
- При проксимальном ТГВ использование компрессионного трикотажа ниже колена рекомендуется с целью снижения риска развития ПТБ [746,749,750,753,754].
УДД 2 УУР А
Комментарий: имеющиеся литературные данные поддерживают компрессионную терапию для профилактики ПТБ в клинической практике, по крайней мере, у пациентов с симптомами [607].
- При ТГВ рекомендуется постоянное использование компрессионного трикотажа от 6 до 12 месяцев с последующей оценкой наличия ПТБ и продолжением лечения при сохранении симптомов [607,754–756].
УДД 2 УУР А
- Не рекомендуется использовать компрессионную терапию как единственную меру профилактики рецидива венозного тромбоза [607,754,755].
УДД 2 УУР А
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации, в том числе основанных на использовании природных лечебных факторов
Порядок разработки и реализации индивидуальной программы реабилитации и абилитации инвалида утвержден и осуществляется согласно Приказа Министерства труда и социальной защиты РФ от 13.06.2017 г. №486н. Объем и спектр реабилитационных мероприятий при установленном ТГВ, должен быть строго регламентирован, учитывая высокие риски ТЭЛА, формирования ПТБ. Следует выделить общие принципы реабилитации больных с ТГВ, к соблюдению которых следует стремиться во всех случаях.
Суть реабилитационной программы – комплекс мероприятий, направленных на возмещение (компенсацию) утраченных (нарушенных) функций, ограничений жизнедеятельности. Цель программы – предотвращение развития ТЭЛА, повторного развития ТГВ, предотвращение и минимизация риска развития ПТБ. При ТГВ указанные задачи реализуются с помощью коррекции поведения, образа жизни и дополнительного комплекса лечебно-профилактических медицинских средств.
- Рекомендуется пропаганда культуры мобильности и физической активности для предотвращения ВТЭО [124,757–764].
УДД 2 УУР А
Комментарий: пониженная подвижность является известным фактором риска ВТЭО, однако продолжительность ограниченной подвижности, которая определяет степень риска ВТЭО, неизвестна. Существует корреляция между потерей подвижности на 3 или более дней и наличием ТГВ при дуплексном ультразвуковом исследовании [758,760]. Просвещение пациентов с повышенным риском ТГВ является ключевым фактором снижения риска ВТОЭ и должно проводиться среди пациентов и членов их семей [765]. Темы, которые должны включаться в образовательную программу - факторы риска ТГВ, возможные последствия ТГВ, меры по снижению риска ТГВ, признаки ТГВ и важность обращения за медицинской помощью, если есть подозрение на ТГВ, важность последующего наблюдения, важность приверженности лечению и вопросы, связанные с приемом антикоагулянтов (например, режим, неблагоприятные побочные эффекты и взаимодействия, диетические ограничения).
- Рекомендуется активный двигательный режим у пациентов с ТГВ после достижения терапевтической антикоагуляции [763].
УДД 2 УУР В
Комментарий: ранняя активизация пациентов с ТГВ, получающих антикоагулянты, не увеличивает риск ТЭЛА, в сравнении с постельным режимом, но ассоциируется с тенденцией к уменьшению риска прогрессирования ТГВ.
- Рекомендуется оценить риск падения пациента перед назначением активного двигательного режима [766–772].
УДД 3 УУР С
Комментарий: специалисты должны оценивать риск падения всякий раз, когда пациент принимает антикоагулянтные препараты (АТХ группа: антитромботические средства, В01А), это связано с высоким риском геморрагических осложнений на фоне приема АКТ [766,767]. Возраст считается основным фактором риска падений. Самая высокая частота падений наблюдается у людей в возрасте >75 лет, и каждый третий человек в возрасте >65 лет падает каждый год [773,774].
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
5.1. Диспансерное наблюдение
- Пациенту с ТГВ, получающему длительную АКТ, рекомендуется выполнить клиническое обследование и УЗ-исследование через 3 мес. для принятия решения о завершении лечения [85].
УДД 5 УУР С
- Пациенту с ТГВ, получающему продленную АКТ, рекомендуется проводить клиническую оценку пользы и риска терапии каждые 6 месяцев [85].
УДД 5 УУР С
Комментарий: методика определения индивидуальной пользы и риска от продленной АКТ описана в соответствующем разделе.
5.2. Первичная профилактика ВТЭО (профилактика первого эпизода)
В настоящее время оптимальным следует признать подход, согласно которому профилактику ВТЭО проводят абсолютно всем пациентам, поступающим в стационар. Характер профилактических мер определяется степенью риска.
5.2.1. Оценка степени риска развития ВТЭО
Несмотря на невозможность точного прогнозирования развития венозных тромбоэмболических осложнений, необходимо оценить степень вероятности их развития. Наличие у пациента факторов, предрасполагающих к ВТЭО, служит основанием для отнесения его к той или иной группе риска. Одним из наиболее удобных инструментов определения риска ВТЭО в хирургии служит шкала Каприни (Caprini) (приложение Г6), в то время как для пациентов нехирургического профиля используют шкалы Padua (приложение Г4) IMPROVE VTE (приложение Г5). Стратификация риска зависит от количества баллов в различных клинических ситуациях. Кроме риска развития ВТЭО, следует оценивать риск геморрагических осложнений, соответствующие шкалы подробно описаны во 2 главе. Ориентируясь на полученные данные следует подобрать оптимальную профилактику. При высоком риске геморрагических осложнений следует ограничиться механическими средствами профилактики, во всех остальных следует рассмотреть целесообразность применения фармакологических методов.
5.2.2. Средства профилактики ВТЭО
Для предупреждения ВТЭО прежде всего, следует минимизировать или устранить действие факторов, способствующих тромбообразованию: восстановить объем циркулирующей крови, нормализовать гемодинамику, применить адекватное обезболивание, предупредить развитие инфекционных осложнений. Необходимо стремиться к возможно более ранней мобилизации больного, восстановлению объёма движений в суставах конечностей.
Профилактика ВТЭО включает в себя следующие методы:
немедикаментозные – применяют у всех пациентов с ограниченной двигательной активностью (мобильностью):
- максимальную и возможно более раннюю активизацию больных после операции, включая методы пассивной нагрузки: вертикализация, механотерапия, кинезиотерапия и др.;
- обеспечение максимально возможной активности мышц нижних конечностей пациентов, находящихся на длительном постельном режиме,
- местные процедуры, увеличивающие объемный поток крови через глубокие вены нижних конечностей (эластичная компрессия нижних конечностей, перемежающаяся пневмокомпрессия, электрическая стимуляция мышц голени и т.д.);
- активные и пассивные нагрузки на верхние конечности, улучшающие циркуляцию крови в целом, стимулирующие антитромботическую активность эндотелия;
медикаментозные — проведение фармакологической тромбопрофилактики у пациентов с умеренным и высоким риском развития ВТЭО.
5.2.2.1. Немедикаментозные средства профилактики ВТЭО
К немедикаментозным средствам относят механические способы профилактики, а именно – эластичную компрессию нижних конечностей, последовательную перемежающуюся пневматическую компрессию (ППК), электрическую стимуляцию мышц голени и лечебную физкультуру. Основной целью применения немедикаментозных методов является ускорение венозного кровотока, при этом их использование не увеличивает опасность геморрагических осложнений. Механическую профилактику следует начать до операции, продолжать во время и после нее вплоть до восстановления двигательной активности
Перемежающаяся пневматическая компрессия (ППК) нижних конечностей с помощью специальных манжет и аппарата является наиболее эффективным из механических способов профилактики. Её следует применять в соответствии с инструкцией к аппарату у пациентов, находящихся на постельном режиме.
Эластичная компрессия нижних конечностей обеспечивается с помощью компрессионного трикотажа (чулки, обеспечивающие оптимальное распределение давления на нижние конечности). Специальный профилактический компрессионный трикотаж (чулки дозированной компрессии) самостоятельно поддерживает необходимый градиент давления. Однако он требует предварительного подбора и из-за развивающегося отека не всегда обеспечивает адекватную степень компрессии в ближайшем послеоперационном периоде. Эластичную компрессию продолжают во время операций на нижних конечностях: чулок должен находиться на не оперируемой конечности во время оперативного вмешательства, на оперированную конечность его одевают (накладывают) на операционном столе непосредственно после завершения операции [775].
Электрическая стимуляция мышц голени (ЭМС) – процедура может быть рассмотрена у некоторых пациентов, особенно при отсутствии возможности для назначения медикаментозной профилактики, ППК или трикотажа Проводится с помощью различного рода электронейростимуляторов (стационарных приборов или индивидуальных переносных) согласно прилагаемой инструкции. Необходимым элементом является наличие электродов, накладываемых на икроножные мышцы пациента. Возможно сочетание метода со статической компрессией и ЛФК. Может рассматриваться как альтернатива методу ППК [776].
Лечебную физическую культуру применяют у всех больных. Особое значение имеют движения в голеностопном суставе и пальцах стопы. Лечебная физкультура не может быть заменой медикаментозным и механическим способам профилактики ВТЭО.
5.2.2.2. Медикаментозные средства, их дозы и режимы применения
Антикоагулянты
Группа антикоагулянтов включает в себя препараты НФГ**, НМГ, прямых оральных антикоагулянтов (таблица 25) и антагонистов витамина К. Однако в настоящее время препараты из группы АВК (варфарин**) самостоятельно для профилактики ВТЭО не используют.
Таблица 25. Рекомендуемые дозы и режим введения антикоагулянтов для профилактики ВТЭО в различных клинических ситуациях
|
|
Рекомендуемые дозы и режим введения |
|||
|
Препарат |
Умеренный риск ВТЭО в хирургии |
Высокий риск ВТЭО в хирургии |
Терапевтический профиль |
|
|
НФГ ** (АТХ группа: Группа гепарина, B01AB, гепарин натрия**) |
Подкожно 5000 МЕ за 2-4 часа до операции, затем через 6-8 часов после операции и далее 5000 МЕ 2-3 раза/сут. |
Подкожно 5000 МЕ за 4–6 часов3 до операции, затем 5000 МЕ через 6–8 часов после операции, далее по 5000 МЕ 3 раза/сут. |
Подкожно 5000 МЕ 3 раза в сутки |
|
|
Бемипарин натрия2 (АТХ: группа гепарина, B01AB12) |
Подкожно 2500 МЕ за 2 ч до операции или через 6 ч после операции, затем ежедневно по 2500 МЕ 1 раз/сут. 4 |
Подкожно 3500 МЕ за 2 часа до операции или через 6 часов после операции, затем ежедневно по 3500 МЕ 1 раз/сут. |
Подкожно 3500 МЕ 1 раз в сутки |
|
|
Далтепарин натрия2 (АТХ: Группа гепарина, B01AB04) |
Подкожно 2500 МЕ за 2 часа до операции, затем 2500 МЕ 1 раз/сут. 4 |
(1) подкожно 5000 МЕ вечером накануне операции, затем 5000 МЕ каждый вечер. (2) подкожно 2500 МЕ за 2 часа до операции, затем 2500 МЕ через 8–12 часов (но не ранее чем через 4 часа после окончания операции), затем со следующего дня 5000 МЕ каждое утро. (3) подкожно 2500 МЕ через 4–8 часов после операции, затем со следующего дня 5000 МЕ 1 раз/сут |
Подкожно 3800 МЕ 1 раз в сутки при массе тела ≤70 кг Подкожно 5700 МЕ 1 раз в сутки при массе тела >70 кг |
|
|
Надропарин кальция2 (АТХ: группа гепарина, B01AB06) |
Подкожно 2850 МЕ (0,3 мл) за 2–4 часа до операции, затем 0,3 мл 1 раз/сут. 4 |
Подкожно 38 МЕ/кг за 12 часов до операции, 38 МЕ/кг через 12 ч после окончания операции, затем 38 МЕ/кг 1 раз/сут на 2-е и 3-и сутки после операции, с 4-х суток после операции доза может быть увеличена до 57 МЕ/кг 1 раз/сут. |
Подкожно 5000 МЕ 1 раз в сутки |
|
|
Парнапарин натрия** (АТХ: группа гепарина, B01AB07) |
Подкожно 3200 МЕ (0,3) за 2 часа до операции, затем по 0,3 1 раз/сут. 4 |
Подкожно 0,4 мл (4250 МЕ) за 12 часов до операции, затем 1 раз\сутки |
Не изучено |
|
|
Эноксапарин натрия2** (АТХ: Группа гепарина, B01AB05) |
Подкожно 20 мг за 2 часа до операции, затем 20-40 мг 1 раз/сут. 4 |
Подкожно 40 мг за 12 ч до операции, затем 40 мг 1 раз/сут. или 30 мг 2 раза/сут. через 12-24 часа после операции |
Подкожно 40 мг 1 раз в сутки |
|
|
Фондапаринукс натрия (АТХ группа: прочие антикоагулянты, B01AX05) |
Подкожно 2,5 мг через 6-24 часа после операции, затем 1 раз/сут. |
Подкожно 2,5 мг 1 раз в сутки |
||
|
Апиксабан** (АТХ группа: прямые ингибиторы фактора Xa, B01AF02) |
Перорально по 2,5 мг 2 раза в сутки; первая доза не ранее чем через 12–24 ч после завершения операции по достижении гемостаза |
|||
|
Дабигатрана этексилат** (АТХ группа: ингибиторы тромбина прямые, B01AE07) |
Перорально по 220 мг или по 150 мг (пациентам: старше 75 лет, при умеренном нарушении функции почек – клиренс креатинина 30–50 мл/мин, принимающим амиодарон, верапамил**, хинидин) 1 раз в сутки; первый приём – в половинной суточной дозе не ранее чем через 1–4 часа после завершения операции по достижении гемостаза |
|||
|
Ривароксабан** (АТХ группа: прямые ингибиторы фактора Xa, B01AF01) |
Перорально по 10 мг 1 раз в сутки; первая доза не ранее чем через 6–10 ч после завершения операции по достижении гемостаза |
|||
** - здесь и далее: препарат включен в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2020 год (Приложение № 1к распоряжению Правительства Российской Федерации от 12 октября 2019 г. № 2406-р)
1 - препараты сгруппированы в соответствии с фармакологическими свойствами, НМГ и пероральные антикоагулянты перечислены по алфавиту;
2 - у больных с низкой массой тела (менее 50 кг) разумно уменьшить профилактическую дозу НМГ в 2 раза, а у больных с выраженным ожирением (масса тела более 120 кг, индекс массы тела более 50 кг/м2) – увеличить ее на 25%; у таких пациентов оправдана коррекция дозы НМГ по уровню анти-Ха активности в крови;
3 - время введения НФГ** до операции соответствует мнению экспертов с учетом обширности ортопедических операций, связанных с повышенным риском кровопотери;
4 - данные рекомендации отражают мнение экспертов и основаны на дозах и режиме применения препаратов гепарина в общей хирургии.
При использовании любых антикоагулянтов необходимо активно отслеживать признаки возможных геморрагических осложнений, исходно определить и регулярно контролировать уровень гемоглобина, гематокрит и клиренс креатинина (см. п. 5.4). При введении препаратов гепарина необходимо дополнительно регулярно контролировать количество тромбоцитов в крови.
5.2.3. Профилактика ТГВ при длительных авиаперелетах
Частота венозных тромбозов после длительных авиаперелетов не может быть точно изучена. Это обусловлено, тем что нет четкого определения что такое длительный авиаперелет, нет четкой взаимосвязи временного интервала между перелетом и установлением диагноза ТГВ. По результатам исследований риск развития ТГВ после авиапутешествия сохраняется от 2 до 4 недель после приземления [777,778]. Факторами риска увеличивающих вероятность развития ВТЭО во время авиаперелётов является недавно перенесенное оперативное вмешательство, онкология, тромбофилии, ожирение, оральные контрацептивы (АТХ группа: гормональные контрацептивы системного действия, G03AA, G03AB) или заместительная гормонотерапия [778].
- У пациентов с высоким риском ВТЭО рекомендована двигательная активность во время полета, активизация работы мышечно-венозной помпы, занятие места у прохода [150].
УДД 5 УРР С
- У пациентов с высоким риском ТГВ в качестве профилактики ВТЭО рекомендовано использовать эластическую компрессию I или II класса (15-30 мм.рт.ст.) компрессии [779,780].
УДД 2 УРР А
- Не рекомендуется использовать антитромбоцитарные препараты в качестве профилактики ВТЭО во время авиаперелетов [777,781].
УДД 5 УРР С
- У пациентов с высоким риском ВТЭО во время авиаперелета рекомендуется рассмотреть возможность применения низкомолекулярных гепаринов для профилактики тромбозов глубоких вен только после индивидуальной оценки пользы-риска[781,782].
УДД 5 УРР С
Комментарий: применение #эноксапарина натрия** из расчета дозы 1 мг\кг массы тела за 2-4 часа до полета c целью профилактики развития тромбоза глубоких вен вероятно может уменьшить развитие ВТЭО. Применение ПОАК с целью профилактики вероятнее всего будет обоснованным, учитывая их фармакокинетические и фармакодинамические свойства, тем не менее исследований, посвящённых этому изучению вопроса, в настоящее время нет.
5.2.4. Профилактика у пациентов онкологического профиля
- Пациентам, госпитализированным с онкологическим заболеванием, рекомендуется проводить фармакологическую профилактику ВТЭО [783–785].
УДД 2 УРР А
Комментарий: пациентам с низким риском ВТЭО возможно не проводить антикоагулянтную профилактику ВТЭО. Причем она должна проводиться только в стационаре, после выписки пациента –прекращение фармакологической профилактики.
- Рекомендуется оценивать риск геморрагических осложнений, риск развития ВТЭО у онкопациентов, которым предстоит оперативное вмешательство и на основании полученных данных определять объем профилактики ВТЭО [786–789].
УДД 1 УУР А
Комментарий: у пациентов с высоким риском геморрагических осложнений рекомендовано использовать механические средства профилактики, у пациентов с высоким риском развития ВТЭО и низким или средним риском геморрагических осложнений – использовать комбинацию фармакологических и механических методов профилактики.
- В качестве антикоагулянтов рекомендуется использовать НМГ или фондапаринукс натрия (АТХ группа: прочие антикоагулянты, B01AX05) [787,789,790].
УДД 1 УУР А
Комментарий: применение НФГ** рекомендовано у пациентов с почечной недостаточностью. Применение АВК в качестве средств профилактики ВТЭО невозможно.
- Рекомендуется применение фармакологической профилактики ВТЭО как в предоперационном, так и в послеоперационном периодах [791–794].
УДД 2 УУР А
- Рекомендуется продолжить антикоагулянтную профилактику у пациентов, перенесших оперативное лечение по поводу онкологии после выписки их из стационара на протяжении до 4 недель [795–799].
УДД 1 УУР А
5.2.4.1. Профилактика ВТЭО у пациентов, получающих противоопухолевую лекарственную терапию, лучевую терапию, химиолучевую терапию
- Не рекомендуется рутинное проведение антикоагулянтной профилактики ВТЭО у пациентов, получающих противоопухолевую терапию [170,800,801].
УДД 1 УУР А
- Рекомендуется рассмотреть вопрос о проведении профилактики ВТЭО у пациентов, получающих противоопухолевую терапию, с учетом ожидаемой пользы (на основе анализа индивидуальных факторов риска) и риска развития кровотечений [170,174,800,801].
УДД 1 УУР А
Комментарий: риск ВТЭО у пациентов, получающих противоопухолевую лекарственную терапию, составляет около 3-4%, что не позволяет рекомендовать рутинное использование тромбопрофилактики. Факторами высокого риска развития ВТЭО являются ≥3 баллов по шкале Хорана (Khorana); ограничение мобильности пациента; активная инфекция; компрессия опухолью крупных вен; герминогенная опухоль яичка с метастазами в забрюшинные лимфоузлы размерами свыше 3,5 см; местно-распространенный или метастатический рак поджелудочной железы; местно-распространенный или метастатический рак легких; режимы химиотерапии множественной миеломы, основанные на иммуномодуляторах, ВТЭО в анамнезе.
- Для проведения медикаментозной профилактики ВТЭО у пациентов, получающих противоопухолевую лекарственную терапию, рекомендуется применение НМГ, апиксабана ** или ривароксабана** [65,170,801,802].
УДД 2 УУР А
Комментарий: у больных с высоким риском кровотечения (пациенты с опухолями верхних отделов желудочно-кишечного тракта и мочеполовой системы, больные с нефростомами, центральным венозным катетером, эрозивно-язвенными поражениями желудочно-кишечного тракта, заболеваниями печени, тромбоцитопенией, скоростью клубочковой фильтрации 15–29 мл /мин) предпочтительнее применение НМГ. ПОАК следует осторожно применять в комбинации с препаратами, подавляющими активность CYP3A4 и P-гликопротеина (иматиниб** (АТХ группа: ингибиторы тирозинкиназы BCR-ABL, L01EA01), кризотиниб** (АТХ группа: ингибиторы киназы анапластической лимфомы (ALK), L01ED01), абиратерон** (АТХ группа: другие антагонисты гормонов и родственные соединения, L02BX03), циклоспорин** (АТХ группа: ингибиторы кальциневрина, L04AD01), такролимус** (АТХ группа: ингибиторы кальциневрина, L04AD02 )) или повышающими активность CYP3A4 и P-гликопротеина (паклитаксел** (АТХ группа: таксаны, L01CD01), вемурафениб** (АТХ группа: ингибиторы серин-треонинкиназы B-Raf (BRAF), L01EC01), дазатиниб** (АТХ группа: ингибиторы тирозинкиназы BCR-ABL, L01EA02, циклоспорин, такролимус), поскольку при этом изменяется фармакокинетика ПОАК.
5.2.5. Профилактика ВТЭО у пациентов травматолого-ортопедического профиля
Для предупреждения ВТЭО у пациента с травмой или операцией на опорно-двигательном аппарате (ОДА), прежде всего, следует минимизировать или устранить действие факторов, способствующих тромбообразованию: восстановить объем циркулирующей крови, нормализовать гемодинамику, применить адекватное обезболивание, предупредить развитие инфекционных осложнений. Необходимо стремиться к возможно более ранней мобилизации больного, восстановлению объёма движений в суставах конечностей. При возможности следует стабильно зафиксировать отломки в ранние сроки после перелома. Применение стабильного функционального остеосинтеза, уменьшение травматичности оперативных вмешательств за счёт использования современных технологий закрытого остеосинтеза позволяют сократить время ограничения подвижности пациента с повреждениями и заболеваниями опорно-двигательного аппарата.
- Каждому пациенту с травмой или перед плановой ортопедической операцией рекомендуется оценить и задокументировать степень риска развития ВТЭО [1,803].
УДД 5 УУР С
Комментарии: для оценки риска развития ВЭТО у пациента перед операцией целесообразно использовать шкалы бальной оценки степени риска развития ВТЭО по Каприни (Caprini). Приложение Г5.
- Всем пациентам с ограниченной двигательной активностью (мобильностью) вне зависимости от определенной степени риска развития ВТЭО рекомендуется проводить профилактику ВТЭО механическими методами [804].
УДД 5 УРР С
- Всем пациентам с повреждением и/или травмой ОДА при умеренном или высоком риске развития ВТЭО рекомендуется проводить профилактику ВТЭО медикаментозными (фармакологическими) методами, как правило, до восстановления обычной или ожидаемой двигательной активности больного (табл. 26) [126,804–806].
УДД 1 УРР A
Комментарий: при выборе антикоагулянта необходимо учитывать противопоказания к применению препарата, изложенные в инструкции производителя. Рекомендуется отдавать предпочтение препаратам, имеющим собственные клинические исследования по оценке их эффективности и безопасности, выполненные у данного контингента больных.
Таблица 26. Лекарственные средства, рекомендуемые для профилактики ВТЭО у пациентов травматолого-ортопедического профиля
|
Планируемое лечение |
Рекомендуемые ЛС1 |
Длительность профилактики |
|
Консервативное лечение повреждений и заболеваний ОДА, сопровождающееся длительным ограничением подвижности пациента |
1. НМГ 2. НФГ** 3. Антагонисты витамина К (АТХ группа: антагонисты витамина К, B01AA) |
До восстановления обычной или ожидаемой двигательной активности |
|
Отсроченное оперативное лечение повреждений позвоночника, таза, нижних конечностей (предоперационный период) |
1. НМГ 2. НФГ** |
До дня операции, далее в зависимости от оперативного вмешательства |
|
Остеосинтез бедра |
1. Фондапаринукс натрия 2. НМГ 3. Дабигатрана этексилат**2 или ривароксабан**2 4. НФГ** 5. АВК (варфарин**) |
Не менее 5–6 недель |
|
Эндопротезирование
|
1. НМГ или фондапаринукс натрия или дабигатрана этексилат**, или ривароксабан**, или апиксабан** 2.НФГ** 3.АВК (варфарин**) 4.Ацетилсалициловая кислота**3 |
Не менее 5 недель |
|
- тазобедренного сустава |
||
|
- коленного сустава |
Не менее 2 недель |
|
|
Другие большие ортопедические операции на нижних конечностях |
1. НМГ 2. Дабигатрана этексилат**2 или ривароксабан**2 3. НФГ ** 4. АВК (варфарин**) |
До восстановления обычной или ожидаемой двигательной активности или 6 недель, в зависимости от того, что наступит раньше |
|
Другие операции на опорно-двигательном аппарате4 |
1. НМГ 2. Дабигатрана этексилат**2 3. НФГ |
До восстановления обычной или ожидаемой двигательной активности или 6 недель, в зависимости от того, что наступит раньше |
1 препараты пронумерованы в порядке приоритетности назначения (в соответствии с накопленной доказательной базой и суждением экспертов);
2 эти лекарственные средства изучены при эндопротезировании тазобедренного и коленного сустава, однако, согласно регистрации, в Российской Федерации, могут использоваться и при указанных ортопедических операциях.
3 - только в виде таблеток, покрытых кишечнорастворимой пленочной оболочкой
4 – за исключением острой травмы спинного мозга и тяжелой черепно-мозговой травмы (см. п. 5.4.8)
- Пациентам с умеренным/высоким риском развития ВТЭО, нуждающимся в фармакологической профилактике после травмы или операции на ОДА, при противопоказаниях или отказе от назначения антикоагулянтов, развитии нежелательных явлений на фоне их приема рекомендуется рассмотреть назначение ацетилсалициловой кислоты** в дозировке 100 мг в сутки в сочетании с механическими видами профилактики [647,804].
УДД 5 УРР С
- Пациентам с умеренным или высоким риском развития ВТЭО, которым противопоказана любая фармакологическая профилактика или которые отказываются от назначения лекарственных препаратов, рекомендуется назначение механических видов профилактики [1,775,804,805,807].
УДД 5 УРР С
- Рекомендуется продолжение профилактики ВТЭО до восстановления обычной или ожидаемой двигательной активности больного [775,804,805,808].
УДД 1 УРР B
5.2.5.1. Плановое эндопротезирование тазобедренного или коленного сустава
- Всем пациентам после планового ЭП ТБС или КС рекомендуется фармакологическая профилактика ВТЭО [1,126,806,809].
УДД 1 УУР A
Комментарии: большие ортопедические операции, к которым относят эндопротезирование коленного и тазобедренного сустава, сопровождаются высоким риском развития ВТЭО [126,809].
- Пациентам с риском развития геморрагических осложнений после ЭП ТБС или КС рекомендуется отсрочить первое введение НМГ, дабигатрана этексилата** или ривароксабана** до достижения гемостаза (не менее чем на 8-12 часов после окончания операции) [810,811].
УДД 4 УУР С
Комментарии: для предупреждения послеоперационных геморрагических осложнений целесообразно начать введение #НМГ не позднее 12-и часов до или не ранее 12 часов после эндопротезирования, #НФГ** – не позднее 4-6 часов до или не ранее 12 часов после операции [652,811]. При этом известно, что нет принципиальных различий в эффективности и безопасности фармакологической профилактики при ее начале до или после эндопротезирования [810]. Согласно инструкциям по применению минимальное время после операции, когда можно начать прием препаратов, составляет для половинной дозы дабигатрана этексилата** 1-4 часа, для ривароксабана** – 6-10 часов, для апиксабана** – 12-24 часа, однако, в случае недостигнутого гемостаза прием антикоагулянтов следует отложить. Эффективность дабигатрана этексилата** сопоставима, а ривароксабана** - превосходит эноксапарин натрия** [812], при этом для всех препаратов характерно быстрое достижение С max в кровотоке. Таким образом, по аналогии с отсрочкой первого введения НМГ для снижения риска развития геморрагических осложнений целесообразно отсрочить первый прием ПОАК минимум на 8 часов.
- Пациентам после планового ЭП ТБС или КС при условии ранней активизации и отсутствии других факторов риска развития ВТЭО помимо операции рекомендуется рассмотреть ацетилсалициловой кислоту** как средство профилактики ВТЭО в качестве альтернативы антикоагулянтам [126,647,804,805,813–815].
УДД 1 УУР A
Комментарии: в последние годы в связи со снижением травматичности планового эндопротезирования коленного или тазобедренного сустава и возможности ранней активизации пациентов возрос интерес к применению ацетилсалициловую кислоту** для профилактики ТГВ и ТЭЛА у данной категории пациентов. Опубликованные результаты Датского и Испанского национальных регистров эндопротезирования продемонстрировали на когортах, включающих соответственно 37223 и 58037 пациентов, принимающих ацетилсалициловую кислоту**, частоту ТГВ менее 1% и ТЭЛА 0,3% и менее [816,817]. В 2012 г препарат был внесен в рекомендации American College of Chest Physicians (США) для применения при ЭП ТБС или КС при невозможности назначения прямых антикоагулянтов [809]. Дальнейшие сравнительные исследования и мета-анализы показали сопоставимую частоту тромбозов при приеме ацетилсалициловую кислоту** и варфарина** с целевыми значениями МНО 1,5-1,8 [818], при продленной тромбопрофилактике после 10 дней НМГ с последующим приемом ацетилсалициловой кислоты** или НМГ [819]. Кроме того, сочетание ацетилсалициловую кислоту** с механической профилактикой не показало преимущества в сравнении с только фармакологической профилактикой ацетилсалициловой кислотой** [813]. Рандомизированное исследование тромбопрофилактики у пациентов без дополнительных факторов риска ВТЭО после ЭН КС также не выявило различий между группами сравнения в зависимости от приема ацетилсалициловой кислоты**, дабигатрана этексилата** или ривароксабана** [820]. В 2018 г. ацетилсалициловую кислоту** включили как один из препаратов выбора, наряду с прямыми антикоагулянтами при плановом эндопротезировании ТБС или КС в Британские (NICE), Австралийские и Европейские национальные рекомендации [647,804,805]. Несмотря на имеющийся в публикациях разброс дозировок ацетилсалициловой кислоты**, в РФ дозами, зарегистрированными для профилактики ТГВ и ТЭЛА при длительной иммобилизации в результате обширного хирургического вмешательства, являются 100-200 мг один раз в сутки в виде таблеток, покрытых кишечнорастворимой оболочкой. В отечественном мета-анализе представлены результаты исследования дозы ацетилсалициловой кислоты** 100 мг 1 раз в сутки [821], аналогичный режим приёма указанного антиагреганта рекомендует ASA (Arthroplasty Society of Australia) [804]. Таким образом, на сегодняшний день накоплена большая доказательная база для включения ацетилсалициловой кислоты** в рекомендации по профилактике ВТЭО при плановых вмешательствах у пациентов без выраженной кардиологической или иной соматической патологии, ведущей к высокому риску развития ТГВ и ТЭЛА. Необходимо помнить, что совместное применение антиагрегантов с антикоагулянтами сопровождается повышенным риском развития кровотечения, применение высоких доз ацетилсалициловой кислоты** повышает риск развития язв желудка, что может привести к кровотечению из ЖКТ.
- Пациентам после ЭП ТБС, выполненного в экстренном или срочном порядке по поводу перелома проксимального отдела или шейки бедренной кости, при отсутствии противопоказаний к назначению антикоагулянтов, не рекомендуется применение ацетилсалициловой кислоты** в качестве единственного средства профилактики ВТЭО [813,816,817]
УДД 2 УУР С
- Пациентам после эндопротезирования тазобедренного сустава рекомендуется продолжение профилактики ВТЭО до 5 недель, после эндопротезирования коленного сустава - минимум 2 недели или до восстановления ожидаемой двигательной активности больного, в зависимости от того, что наступит раньше [1,804,805,808].
УДД 5 УУР С
Комментарии: современные национальные руководства определяют продолжительность тромбопрофилактики после эндопротезирования коленного и тазобедренного суставов - минимум 10-14 дней, с продлением до 35-и дней при наличии у пациента дополнительных факторов риска [1,775,807,809]. Указанные сроки назначения антикоагулянтов обусловлены изменениями в системе коагуляции, сохраняющимися в течение нескольких недель после хирургического вмешательства. К ним относят угнетение фибринолитической активности крови, активацию коагуляции и снижение уровня естественных антикоагулянтов, таких как антитромбин III. Из-за сохраняющейся тенденции к сокращению койко-дня возможные ВТЭО чаще развиваются на амбулаторном этапе после выписки из стационара.
5.2.5.2. Переломы таза, шейки бедренной кости и проксимального отдела бедра
- При невозможности выполнения операции в первые сутки, рекомендуется начать медикаментозную профилактику с применением НМГ или НФГ** сразу после госпитализации пациента, при высоком риске или продолжающемся кровотечении проводить профилактику следует немедикаментозными средствами [1,775,809].
УДД 5 УУР С
Комментарии: целесообразно начинать применение антикоагулянтов по достижении первичного гемостаза, после обследования и исключения у пострадавшего возможных противопоказаний (обычно через 6–24 часа после травмы). Если операцию у пациента с травмой планируется выполнить в отсроченном порядке (через несколько суток после повреждения), то медикаментозную профилактику рекомендуется проводить в течение всего предоперационного периода НМГ, при невозможности их назначения – НФГ**. Последнюю дозу до операции рекомендовано вводить не позднее, чем за 12 часов до операции для #НМГ [652,804,805], или за 4-6 часов – для #НФГ** [652,822,823].В случаях, когда введение антикоагулянтов вынужденно откладывается на 24 часа и более, рекомендуется проведение УЗАС для исключения ТГВ [775].
- При оперативном и консервативном ведении пациентов с переломами таза, шейки бедренной кости и проксимального отдела бедра рекомендуется продолжение фармакологической профилактики до восстановления ожидаемой двигательной активности больного, но не менее не менее 5 недель после операции [1,775,805].
УДД 5 УУР С
5.2.5.3. Операции на коленном суставе, за исключением эндопротезирования
- Пациентам, нуждающимся в артроскопических операциях, не рекомендуется рутинное применение профилактики ВТЭО при отсутствии у них дополнительных факторов риска ВТЭО, а также при продолжительности использования турникета менее 45 мин и/или оперативного вмешательства менее 90 мин [775,805].
УДД 5 УУР С
Комментарии: артроскопические реконструкции структур капсульно-связочного аппарата коленного сустава относят к операциям низкой степени риска ВТЭО. Однако надо помнить, что наличие дополнительных отягощающих факторов изменяет степень риска развития ВТЭО в сторону её повышения [824–827].
- В случаях выполнения артроскопии с использованием турникета на 45 мин и более, при продолжительности оперативного вмешательства более 90 мин или высоком риске ВТЭО у пациента (например, ВТЭО и\или ТЭЛА в анамнезе, ожирение с ИМТ≥40 кг/м2 и др.) рекомендуется рассмотреть назначение НМГ через 6-12 часов после операции, с последующим переходом на ПОАК (дабигатрана этексилат** или ривароксабан**) с продлением курса ТП до 10-14 дней [775,805].
УДД 5 УУР С
5.2.5.4. Ортопедические операции на дистальных отделах нижней конечности (лодыжки, голеностопный сустав, стопа)
- Пациентам, нуждающимся в операциях на дистальных отделах нижней конечности, не рекомендуется рутинное применение фармакологической профилактики ВТЭО при отсутствии у них дополнительных факторов риска ВТЭО [828–831].
УДД 2 УУР В
- Рекомендуется рассмотреть возможность назначения фармакологической профилактики ВТЭО пациентам, которым после выполнения операции на стопе или голеностопном суставе (например, артродез, остеосинтез реконструкция ахиллова сухожилия) требуется иммобилизация, при продолжительности анестезии больше чем 90 минут, или при наличии у пациента высокого риска развития ВТЭО, связанного с дополнительными отягчающими факторами [828–831].
УДД 2 УУР В
Комментарий: частота ВТЭО, возникающих после артроскопических операций и открытых хирургических вмешательств на стопе и голеностопном суставе, существенно уступает таковой при хирургическом лечении ряда других областей опорно-двигательной системы. Причем назначение с профилактической целью НМГ после некоторых хирургических вмешательств указанного профиля не оказывает существенного влияния на этот показатель за исключение хирургии повреждений ахиллова сухожилия [828,829,832]. Целесообразно при поступлении пациента принимать решение о методе профилактики ВТЭО исходя из оценки риска их развития с учетом планируемой тактики лечении заболевания или повреждения [828–832]. Известно, что максимальный риск развития ВТЭО имеет иммобилизация конечности после операций на данном сегменте фиксирующей повязкой, либо аппаратом наружной фиксации, а также проведение восстановительных и реконструктивные операции на пяточном сухожилии.
5.2.5.5. Ортопедические операции на верхней конечности
- Рутинно при операциях на верхней конечности под местной или региональной анестезией фармакологическая профилактика ВТЭО не рекомендуется [833,834].
УДД 2 УУР А
- В случаях продолжительности общего наркоза или турникета более 90 минут при вмешательствах на верхней конечности, а также, если операция может существенно затруднить двигательную активность пациента или при наличии эпизодов ВТЭО в анамнезе рекомендуется рассмотреть возможность периоперационной профилактики ВТЭО [835].
УДД 4 УУР С
Комментарии: большие и малые операции на плечевом суставе характеризуются низким риском развития ВТЭО [833–835]. Однако, с учетом роста в популяции числа носителей геномно-обусловленных тромбофилий (дефицит антитромбина III, протеина С, S, полиморфизм гена V фактора свёртываемости крови (Лейден), полиморфизм гена протромбина G20210А и др.), широкого, часто неконтролируемого использования эстрогенов, старения популяции, роста заболеваемости диабетом и другими метаболическими расстройствами, повышающими риск ВТЭО, фармакологическая тромбопрофилактика может быть целесообразна при лечении пациентов с дополнительными факторами риска развития ВТЭО по поводу переломов плеча и предплечья, а также обширной травмы мягких тканей верхних конечностей. Окончательное решение принимает лечащий врач с учетом объема повреждения, характера предполагаемого вмешательства и дополнительных факторов риска ВТЭО со стороны пациента. Возможно периоперационное назначения этой категории пациентов НМГ по схемам и в дозировках, приведенных в таблице 5.3 на срок 7-10 дней (до выписки из стационара) либо в течение нескольких дней до восстановления обычной/ожидаемой двигательной активности.
5.2.5.6. Плановые операции на позвоночнике
- Рекомендуется рассмотреть возможность назначения фармакологической профилактики ВТЭО НМГ при плановых операциях на позвоночнике, в случаях, когда риск ВТЭО превышает риск кровотечения, с учетом индивидуальных особенностей пациента и хирургических факторов (большая длительная операция, операция с комбинированным передне-задним доступом), а также в соответствии с клинической оценкой, проводимой лечащим врачом [804,836–838].
УДД 2 УУР А
- Пациентам с высоким риском кровотечения рекомендуется до операции применять механическую тромбопрофилактику, а первое введение НМГ отложить до достижения гемостаза (12-24 часов после операции) [804,836–838].
УДД 3 УУР С
В случае поступления пациента с ограничением двигательной активности, в том числе по поводу геми- и тетрапареза/-паралича следует рассмотреть возможность проведения фармакологической профилактики ВТЭО в дооперационном периоде [1,775]. Последнюю инъекцию НМГ целесообразно вводить не позднее 12-24 часов до плановой операции на позвоночнике в зависимости от клинической оценки состояния пациента и характера планируемой операции.
5.2.5.7. Тяжелые травмы (множественные и сочетанные, включая черепно-мозговую, спинного мозга, позвоночника, таза/нижних конечностей)
Все пациенты с тяжелыми травмами относятся к группе высокого риска развития ВТЭО.
- При поступлении пациента с тяжелой травмой рекомендуется рассмотреть возможность назначения механической профилактики ВТЭО [804].
УДД 5 УУР С
Комментарий: в зависимости от вида полученных травм механическая профилактика может быть противопоказана пациентам с травмой нижних конечностей. Однако при отсутствии других противопоказаний следует применять механическую профилактику в неповрежденной ноге. При высоком риске кровотечения или активном кровотечении следует использовать только механические методы профилактики, в первую очередь ППК. Возможно также применением электрической стимуляции мышц голени и компрессионного трикотажа [1].
- Пациентам с тяжелой травмой рекомендуется назначение фармакологической профилактики ВТЭО как можно скорее, как только риск ВТЭО превысит риск кровотечения [775,804,805].
УДД 5 УУР С
- При наличии у пациента с тяжелой травмой неполного повреждения спинного мозга, спинальной гематомы или внутричерепного кровоизлияния рекомендуется отложить фармакологическую профилактику до достижения удовлетворительного гемостаза (обычно на 1-3 суток) [804,805].
УДД 5 УУР С
Комментарий: препаратами выбора для проведения фармакопрофилактики в дооперационном периоде при лечении тяжелых травм являются НМГ, в случаях, когда применение НМГ невозможно, используют НФГ**. Из-за медленного появления и прекращения эффекта и недостаточной изученности применение АВК (варфарин**) с целью профилактики ВТЭО в предоперационном периоде нецелесообразно. При черепно-мозговой травме сроки начала фармакологической профилактики следует обсудить с нейрохирургической бригадой. Обычно у пациентов без внутричерепного кровоизлияния фармакологическая профилактика может быть начата немедленно [804].
- Пациентам с тяжелой травмой рекомендуется продолжать фармакологическую тромбопрофилактику до восстановления двигательной активности, но не менее 10-14 суток при отсутствии дополнительных факторов риска [804].
УДД 5 УУР С
Комментарий: угроза развития ВТЭО сохраняется длительное время, пока имеются факторы риска. Исследования показали, что не менее половины ВТЭО развивались после выписки больных из стационара, когда двигательная активность пациентов оставалась ограниченной [775,804,839]. Для продленной тромбопрофилактики в послеоперационном периоде возможен перевод пациента на пероральные препараты: ривароксабан**, АВК (при условии обеспечения адекватного контроля МНО). В случае прохождения пожилыми пациентами реабилитации в стационаре целесообразно рассмотреть возможность продления продолжительности профилактики сверх минимально рекомендуемой продолжительности: до тех пор, пока активность не вернется к ожидаемому или клинически приемлемому уровню или, когда пациент будет выписан из больницы.
5.2.5.8. Онкоортопедия
- Рекомендовано дополнительно оценивать и документировать риск развития ВТЭО у пациентов с учетом основного заболевания и предполагаемого хирургического вмешательства (табл. 26) [212,840].
УДД 5 УУР С
Комментарий: риск тромбоэмболических осложнений в три раза ниже у больных, перенесших оперативное вмешательство по поводу доброкачественных опухолей костей, чем у пациентов со злокачественными новообразованиями. В сравнении со злокачественными при доброкачественных опухолях и опухолеподобных поражениях костей отмечается также статистически значимое снижение частоты геморрагических осложнений. Средней и низкой степенью риска ВТЭО сопровождаются операции при доброкачественных опухолях костей и проведении плоскостных, краевых, внутриочаговых, сегментарных и околосуставных резекций на длинных и коротких костях сегментов, за исключением бедра и костей таза (таблица 27) [841–843].
Таблица 27. Степени риска ВТЭО при операциях по поводу опухолей и опухолеподобных поражений костей в зависимости от характера оперативного вмешательства
|
Степень риска |
Оперативное вмешательство |
|
Высокая |
онкологическое эндопротезирование костей таза, тазобедренного или коленного сустава, онкологическое эндопротезирование бедренной кости расширенная резекция костей таза резекции бедренной кости и замещением дефекта имплантом или костной пластикой спондило- и дискэктомия с замещением имплантатом/передним спондилодезом межподвздошнобрюшное вычленение межлопаточногрудное вычленение |
|
Средняя |
внутриочаговая и сегментарная резекция длинных костей, за исключением бедренной плоскостная резекция подвздошной кости плоскостная резекция дужек, остистых и поперечных отростков позвонков онкологическое эндопротезирование плечевого сустава ампутации и экзартикуляции сегментов, за исключением ампутации бедра |
|
Низкая |
плоскостная или краевая резекция длинных костей внутриочаговая, сегментарная резекции коротких костей с костной пластикой дефекта плоскостная, краевая резекции коротких костей онкологическое эндопротезрование голеностопного, лучезапястного локтевого, межфаланговых суставов |
- Всем больным со злокачественными новообразованиями при проведении хирургического лечения рекомендуется проводить профилактику ВТЭО, формат которой определяется степенью риска ВТЭО и включает медикаментозные и механические способы ТП, при этом ранняя активизация больных целесообразна во всех случаях [212,840].
УДД 5 УУР С
Комментарий: тромбоз глубоких вен часто сопровождает операции по поводу новообразований костей, особенно на тазовых костях, крупных суставах и сегментах [212,840,844–846]. Выбор способа предупреждения и длительности профилактических мер зависит от тяжести онкологического процесса, наличия патологического перелома, анатомической локализации, нозологической единицы, возраста и сопутствующих заболеваний, объема операции, адъювантной химиотерапии, наличия метастазов [1,84,840]. Онкологическим больным, которым планируется хирургическое лечение, рекомендуется выполнить УЗАС максимально близко к дате операции [1,847]. планируя меры профилактики ВТЭО, следует учитывать возможность бессимптомного ТГВ у существенной части онкохирургических больных [1,840,847].
- При невозможности выполнения пациенту операции по поводу патологического перелома бедра в первые сутки, рекомендуется начать медикаментозную профилактику с применением НМГ или НФГ** сразу после постановки диагноза, в случае высокого риска развития или продолжающегося кровотечения проводить профилактику следует немедикаментозными средствами [1,840].
УДД 5 УУР С
- Рекомендуется продление профилактики ВТЭО не только до восстановления прежней или ожидаемой двигательной активности, но и далее с учетом степени риска тромбоза со стороны пациента [840,848].
УДД 5 УУР С
Комментарий: медикаментозная профилактика ВТЭО при умеренном риске должна продолжаться до выписки, но не менее 10-14 сут после операции. У больных с высоким риском ВТЭО целесообразно продление медикаментозной профилактики до 28—35 суток вне зависимости от срока выписки из стационара. После крупных онкоортопедических/ортопедических операций оправдано проведение профилактики до 35 сут. Больные, переносящие хирургическое лечение новообразований скелета, часто имеют высокий риск тромбоэмболических осложнений, который зависит от объективного статуса пациента, анамнеза, сопутствующих заболеваний, ранее полученного лечения. Известно, что риск развития тромбоза глубоких вен у онкологических больных увеличивается в два раза при наличии метастазов, а химиотерапия увеличивает риск венозной тромбоэмболии примерно в шесть-семь раз у пациентов с опухолями костей по сравнению с пациентами без данной патологии [841,849–852].
У онкоортопедических пациентов рекомендовано рассмотреть возможность сокращения длительности использования или отказа от манипуляций, повышающих риск образования тромбов (применение турникета или жгута, проведение общей анестезии, длительная иммобилизация и пр.) [841–843]. Отрицательное влияние отдельных факторов риска может снижаться при отказе от некоторых манипуляций, провоцирующих образование тромбов. Данная цель может быть достигнута при исключении турникета или жгута в операциях на нижней конечности или сокращении времени их применения. Значительный позитивный результат дают предпочтение проводниковой анестезии перед общим обезболиванием, что позволяет мобилизовать пациента в раннем послеоперационном периоде, а также отказ по возможности от постоянной иммобилизации и использование функциональных методов лечения, сокращение времени оперативного вмешательства за счет внедрения высоких технологий.
- Онкологическим пациентам с доброкачественным новообразованием кости и низкой степенью риска развития ВТЭО рекомендуется рассмотреть возможность проведения тромбопрофилактики только механическими способами (эластическая компрессия нижних конечностей, перемежающаяся пневмокомпрессия, миостимуляция мышц голени и т.д.), если иного не требует характер оперативного вмешательства и сопутствующие факторы риска [840].
УДД 5 УУР С
Комментарий: механическая профилактика у онкологических пациентов, при операциях на ОДА также, как и медикаментозная или комбинированная, строго индивидуальна и осуществляется весь период риска тромбоэмболических осложнений, т.к. помимо характера новообразования зависит от выполняемой операции, продолжительности и типа иммобилизации, сроков восстановления двигательной активности и реабилитации функции конечности или сегмента.
5.2.6. Профилактика ВТЭО у больных хирургического профиля
- Для стратификации риска ВТЭО у хирургических пациентов по группам риска развития рекомендуется использовать шкалу Каприни (Caprini) (Приложение Г6) [150,155].
УДД 2 УУР В
- Рекомендуется при оценке риска развития послеоперационных ВТЭО учитывать прием комбинированных оральных контрацептивов (АТХ группа: гормональные контрацептивы системного действия, G03AA, G03AB) или проведение менопаузальной гормональной терапии (МГТ) как 1 балл по шкале Каприни (Caprini) [617,853–855].
УДД 5 УУР С
Комментарий: прием КОК или препаратов для МГТ учитывается в шкале Каприни при общей оценке риска послеоперационных ВТЭО. При повышенном риске тромбопрофилактика обеспечивается не отменой КОК или МГТ, а назначением антикоагулянтов, которые полностью нивелируют протромботический эффект гормональных препаратов. Отмена КОК или МГТ при хирургических вмешательствах не требуется.
- Всем пациентам, перенесшим хирургическое вмешательство, вне зависимости от индивидуального риска ВТЭО, рекомендуется ранняя активизация, адекватная гидратация [853,854].
УДД 5 УУР С
Комментарий: на сегодняшний день отсутствует достоверная доказательная база о значении ранней активизации для предотвращения развития послеоперационных ВТЭО. С точки зрения физиологии активизация мышечно-венозной помпы голени представляется эффективным средством профилактики тромбоза [856]. В рамках исследования MEDENOX, изучавшего эффективность и безопасность применения профилактических доз эноксапарина натрия** было показано, что активизация пациентов с возможностью самостоятельно пройти более 10 метров ассоциировалась с достоверным снижением риска ВТЭО [857].
- У пациентов с низким риском развития послеоперационных ВТЭО (0-2 балла по шкале Каприни (Caprini)) рекомендуется рассмотреть целесообразность применения эластичной компрессии с целью профилактики ВТЭО только при ограничении подвижности [617,853,854].
УДД 1 УУР А
Комментарий: по данным мета-анализа 20 РКИ с участием 1681 пациента, использование эластичной компрессии у пациентов хирургического и терапевтического профиля снижает риск развития ВТЭО на 65%, проксимального ТГВ – на 74%, ТЭЛА – на 62% [617]. Следует иметь в виду, что пациенты с низким риском развития ВТЭО не включались в проведенные исследования, поэтому объективно оценить пользу от использования эластичной компрессии у них не представляется возможным. В рамках систематического обзора литературы по изучению пользы и риска от эластичной компрессии у пациентов с низким риском развития ВТЭО было найдено только одно исследование, на основании которого невозможно сформулировать выводы [858].
- У госпитализированных пациентов с умеренным риском развития послеоперационных ВТЭО (3-4 балла по шкале Каприни (Caprini)) рекомендуется использование фармакологической профилактики, которая может быть дополнена эластической компрессией [618,619,853,854,859,860].
УДД 2 УУР А
Комментарий: по данным мета-анализа 75 РКИ с участием 15598 пациентов применение НФГ** в сравнении с отсутствием фармакопрофилактики ассоциируется с достоверным снижением риска развития ТГВ, ТЭЛА, фатальной ТЭЛА и общей смертности [618]. С точки зрения преимуществ НМГ перед НФГ** существуют противоречивые результаты мета-анализов [619,620,622]. На первый взгляд НМГ обладают большей эффективностью, но если ограничить анализ только двойными-слепыми плацебо-контролируемыми исследованиями, то различия исчезают [619]. Как бы то ни было, но удобство применения НМГ является их неоспоримым преимуществом. Препараты назначают в дозах для группы умеренного риска ВТЭО (Таблица 25). По данным исследования GAPS у пациентов с умеренным риском ВТЭО, подвергающихся плановым оперативным вмешательствам, дополнительное использование эластичной компрессии на фоне введения профилактических доз НМГ не имеет преимуществ, поэтому от ее использования можно отказаться [859].
- У амбулаторных пациентов с умеренным риском развития послеоперационных ВТЭО (3-4 балла по шкале Каприни (Caprini)) рекомендуется рассмотреть использование фармакологической профилактики, которая может быть дополнена эластической компрессией [944].
УДД 4 УУР С
Комментарий. Рекомендация фармакотерапии пациентам с умеренным риском по Каприни (больше 2 баллов) основана на исследованиях по госпитальной хирургии и не может быть экстраполирована на амбулаторную хирургию. Риски ВТЭО для малоинвазивных амбулаторных вмешательств (термооблитерация и т.п.) по многим свидетельствам относятся к очень низким (менее 0,5%) для общей массы пациентов. По данным Malgor R. с соавт. инцидентность ТГВ, ТЭЛА и фатальных исходов после эндовенозной термооблитерации составляет 1:2500, 1:10000 и 1:50000 соответственно [944].
- У пациентов с высоким риском развития послеоперационных ВТЭО (5-8 баллов по шкале Каприни (Caprini)) рекомендуется использование фармакологической профилактики в сочетании с эластичной компрессии [853,854,859,861,862].
УДД 1 УУР C
Комментарий: сведения об эффективности совместного применения фармакологической профилактики и эластичной компрессии у пациентов с высоким риском развития ВТЭО носят ограниченный характер. Мета-анализ 19 РКИ по оценке эффективности различных подходов к профилактике ВТЭО после колоректальной хирургии продемонстрировал преимущество сочетания эластичной компрессии и введения гепаринов [861]. Мета-анализ РКИ по оценке эффективности ППК в дополнение к фармакологической профилактике также демонстрирует достоверные преимущества комбинированного подхода, которые ограниченным образом могут быть экстраполированы на использование эластичной компрессии [862]. Результаты исследования GAPS, в котором около 70% пациентов имели балл Caprini ≥5 свидетельствуют, что при плановых оперативных вмешательствах возможно отказаться от эластичной компрессии на фоне введения профилактических доз антикоагулянтов у пациентов со стандартно высоким риском ВТЭО [859]. Препараты назначают в дозах для группы высокого риска ВТЭО (Таблица 25).
- У пациентов с очень высоким риском развития послеоперационных ВТЭО (9-10 баллов по шкале Caprini) рекомендуется использование сочетания фармакологической и механической профилактики, преимущественно ППК, или ЭМС, или эластичной компрессии [853,854,862].
УДД 1 УУР А
Комментарий: мета-анализ 34 РКИ с участием 14,931 пациентов продемонстрировал снижение риска ТЭЛА на 54% и ТГВ – на 3% без влияния на угрозу кровотечения при использовании ППК в дополнение с фармакологической терапии в сравнении с изолированной фармакопрофилактикой [862]. При отсутствии доступа к ППК альтернативой может служить ЭМС. Несмотря на то, что проведенный мета-анализ демонстрирует отсутствие преимуществ ЭМС перед другими методами профилактики [863], отдельные исследования утверждают пользу от комбинации метода с введением гепаринов и эластичной компрессией [864]. При отсутствии возможности применения ППК и ЭМС возможно ограничиться применением эластичной компрессии на основании экстраполяции данных о пользе фармако-механического подхода к профилактике ВТЭО. Препараты назначают в дозах для группы высокого риска ВТЭО (Таблица 25).
- У пациентов чрезвычайно высоким риском развития послеоперационных ВТЭО (11 и более баллов по шкале Каприни (Caprini)) рекомендуется использование сочетания фармакологической профилактики, ППК и эластичной компрессии [853,854,862,865].
УДД 2 УУР A
Комментарий: по результатам РКИ IPC SUPER подобная комбинация позволила снизить риск развития венозного тромбоза с 16,7% до 0,5% у пациентов с наличием 11 и более баллов по шкале Каприни (Caprini) [865]. При отсутствии доступа к ППК возможно использование ЭМС в качестве альтернативы. При отсутствии доступа к активным методам ускорения кровотока целесообразно проводить динамическое УЗ-исследование каждые 3-5 дня для своевременного выявления бессимптомных венозных тромбозов и начала терапии.
- У пациентов чрезвычайно высоким риском развития послеоперационных ВТЭО (11 и более баллов по шкале Каприни (Caprini)) рекомендуется рассмотреть индивидуальный подбор дозы НФГ** и НМГ [866].
УДД 2 УУР B
Комментарий: по результатам сравнительного исследования использование повышенных доз НФГ** (300 ЕД/кг в сутки, разбитые на 3 инъекции, в среднем 7500 ЕД 3 раза в сутки) у пациентов с высоким риском развития ВТЭО (средний балл Каприни (Caprini) – 12) в сочетании с эластичной компрессией позволило достоверно уменьшить частоту регистрации послеоперационных венозных тромбозов с 19% до 5% без увеличения числа больших кровотечений [866]. По данным отдельных исследований использования стандартных профилактических доз НМГ может быть недостаточным для достижения целевого диапазона анти-Ха активности (0,3-0,5 МЕ/мл) после экстренных хирургических вмешательств [867], колоректальной хирургии [868], торакальной хирургии [869], пластической хирургии [870], бариатрической хирургии [871,872], а сохранение выраженной гиперкоагуляции по данным теста тромбодинамики предсказывает развитие послеоперационных ВТЭО у пациентов с колоректальным раком [164]. Существуют отдельные сведения, что контроль анти-Ха активности с последующей коррекцией дозы НМГ позволяет увеличить числа пациентов, находящихся в целевом диапазоне анти-Ха активности после пластических и реконструктивных вмешательств, экстренной хирургии и при лечении ожогов [870,873,874]. Целевым диапазоном анти-Ха активности считают 0,2-0,5 МЕ/мл при исследовании через 3-4 часа после очередной инъекции и 0,1-0,2 МЕ/мл при исследовании через 12 часов после очередной инъекции [875,876].
- У пациентов с высоким риском геморрагических осложнений, которым предстоит большое оперативное вмешательство и невозможно назначить антикоагулянтную терапию, рекомендуется использовать механические методы профилактики ВТЭО [615,877–880].
УДД 1 УУР А
Комментарий: ППК является единственным методом, который по своей эффективности сопоставим с фармакологической профилактикой и может считаться полноценной ей альтернативой [615].
- Для решения вопроса об объеме профилактики рекомендуется оценить риск геморрагических осложнений, риск развития ВТЭО, объем хирургического пособия [614,615,788,877,881–883].
УДД 1 УУР А
- Не рекомендуется выполнять имплантацию кава-фильтра в качестве меры профилактики ВТЭО [884,885].
УДД 2 УУР А
- Рекомендуется проводить продленную фармакологическую профилактику у пациентов с высоким риском развития ВТЭО [633,798,799,883,886–890].
УДД 1 УУР А
Комментарий: продленная профилактика (2-6 недель) показана больным с высоким риском развития ВТЭО. По данным мета-анализа 7 РКИ с участием 1728 пациентов после больших вмешательств на органах брюшной полости и малого таза, продленная фармакопрофилактика (более 14 дней) у таких пациентов ассоциируется с достоверным снижением риска развития ВТЭО без увеличения риска кровотечения [799].
- Пациентам, которым предстоит хирургическое вмешательство на органах грудной клетки, брюшной полости и малого таза рекомендуется проводить профилактику ВТЭО по общим принципам [619,891–893].
УДД 1 УУР А
- Пациентам, которым предстоит большое оперативное вмешательство на органах грудной клетки, органах брюшной полости и малого таза в качестве антикоагулянтных средств рекомендуется использовать НМГ или НФГ** [619,790,894].
УДД 1 УУР А
- У пациентов, которым предстоит бариатрическая операция, рекомендуется использовать НМГ в профилактических дозировках, подобранных по массе тела с целью профилактики развития тромбозов глубоких вен [696,895,896].
УДД 2 УУР А
Комментарий: при использовании #эноксапарина натрия** у пациентов с ИМТ меньше 40 кг/м2 следует использовать 40 мг один раз в день, при более высоком ИМТ нужно увеличить кратность инъекций до 2 раз в сутки.
- У пациентов с ожирением, которым предстоит небариатрическая операция, рекомендуется использовать #эноксапарин натрия** в дозе 0,5 мг/кг один или два раза в сутки с целью профилактики развития тромбоза глубоких вен в послеоперационном периоде. [696,895].
УДД 2 УУР А
- Пациентам, которым планируется операция на магистральных сосудах рекомендуется рассмотреть проведение профилактики ВТЭО по общим принципам [897–900].
УДД 2 УУР A
Комментарий: по данным мета-анализа 42 исследований применение профилактических мероприятий при вмешательствах на периферических сосудах ассоциируется с недостоверным снижением риска ВТЭО (ОР, 0,704 95% ДИ, 0,26-1,87) [900].
- Пациентам, которым планируется кардиохирургическое пособие или операция на магистральных сосудах рекомендуется проведение профилактики ВТЭО по общим принципам применение фармакологической профилактики ВТЭО [901].
УДД 2 УУР B
Комментарий: по данным мета-анализа 68 исследований использование профилактических мероприятий ассоциируется со снижением риска ТЭЛА на 55% и симптоматического ВТЭО на 56% [901].
- Пациентам, перенесшим оперативное гинекологическое вмешательство рекомендуется проводить профилактику ВТЭО по общим принципам [882,891,902–905].
УДД 2 УУР A
- Пациентам, которым планируется пластическое или реконструктивное вмешательство, рекомендуется рассмотреть проведение профилактики ВТЭО по общим принципам с учетом коррекции групп риска по баллам Каприни (Caprini) [854,906].
УДД 2 УУР B
Комментарий: в рекомендациях АССР 2012 года была предложена следующая стратификация пациентов по риску ВТЭО при реконструктивных и пластических вмешательствах: очень низкий риск: 0-2 балла; низкий риск: 3-4 балла; умеренный риск: 5-6 баллов; высокий риск: 7-8 баллов [854]. По результатам мета-анализа польза от адъювантной фармакологической профилактики при пластической и реконструктивной хирургии имеется только у пациентов с наличием >8 баллов Каприни (Caprini) при условии использования механической профилактики, преимущественно методом ППК [906]. С учетом ограниченной доступности методов ППК в РФ целесообразно рассмотреть использование фармакологической профилактики у всех пациентов с риском ВТЭО выше умеренного (5 и более баллов).
5.2.7. Профилактика ВТЭО у пациентов терапевтического профиля
- Пациентам с острым заболеванием, госпитализированным в терапевтический стационар, рекомендуется рассмотреть проведение фармакологической профилактики на основании индивидуальной оценки пользы и риска [907].
УДД 1 УУР С
Комментарий: для оценки индивидуального риска развития ВТЭО у пациентов терапевтического профиля рекомендуется использование шкалы Padua и IMPROVE, которые представлены в соответствующих разделах. При наличии ≥4 баллов по шкале Padua, или ≥4 баллов по шкале IMPROVE, или 2-3 баллов по шкале IMPROVE в сочетании с увеличением Д-димера в 2 и более раза, рекомендуется рассмотреть фармакологическую профилактику с помощью НФГ**, НМГ или фондапаринукса натрия в дозах, приведенных в таблице 25. ПОАК не зарегистрированы для первичной профилактики в терапевтическом стационаре. По результатам мета-анализа, проведенного в рамках разработки рекомендаций Американского общества гематологов, фармакологическая профилактика ассоциируется с достоверным снижением риска ТЭЛА на 41% без влияния на риск ТГВ, кровотечения и общую смертность. По результатам другого мета-анализа в рамках разработки тех же рекомендации применение ПОАК в сравнении с НМГ ассоциировалось увеличением риска больших кровотечений в 1,7 (11,02-2,82) раз [907].
- Пациентам с острым заболеванием, госпитализированным в терапевтический стационар, не рекомендуется использовать механическую профилактику в качестве самостоятельного метода или в дополнение к фармакологической профилактике [907].
УДД 1 УУР С
Комментарий: по результатам мета-анализа, проведенного в рамках разработки клинических рекомендаций Американского общества гематологов, авторы не смогли получить убедительных доказательств того, что механическая профилактика не уступает фармакологической по своей эффективности и безопасности у терапевтических пациентов. Также не было найдено преимущество от совместного использования механической и фармакологической профилактики в терапевтическом стационаре [907].
- Пациентам с острым заболеванием, госпитализированным в терапевтический стационар, рекомендуется рассмотреть применение механической профилактики при наличии противопоказаний к введению антикоагулянтов [907]
УДД 1 УУР С
Комментарий: по результатам мета-анализа, проведенного в рамках разработки клинических рекомендаций Американского общества гематологов, авторы обнаружили только одно РКИ, не продемонстрировавшее достоверных преимуществ механической профилактики у терапевтических пациентов. При этом наблюдалась тенденция к снижению риска развития ТЭЛА (ОР, 0,73; 95% ДИ, 0,51-1,04) и проксимального ТГВ (ОР, 0,82; 95% ДИ, 0,61-1,1), что может поддержать использование механической профилактики у отдельных пациентов с повышенным риском развития ВТЭО [907].
- Пациентам с острым заболеванием, госпитализированным в терапевтический стационар, не рекомендуется рутинное использование продленной фармакологической профилактики после выписки [907].
УДД 1 УУР С
Комментарий: по результатам мета-анализа, проведенного в рамках разработки клинических рекомендаций Американского общества гематологов, авторы не обнаружили достоверного снижения риска развития ТЭЛА, но выявили достоверное уменьшение риска развития проксимального ТГВ (ОР, 0,54; 95% ДИ, 0,32-0,91) и увеличение риска большого кровотечения в 2,09 (1,33-3,27) раза при использовании продленной фармакопрофилактики после выписки из стационара в сравнении с краткосрочным введением антикоагулянтов в период стационарного лечения. На основании полученных данных рутинное применение антикоагулянтов после выписки из стационара не может быть рекомендовано, но может быть рассмотрено у отдельных пациентов с индивидуально высоким риском развития ВТЭО и низким риском развития кровотечения [907].
5.2.8. Профилактика ВТЭО у пациентов с ОНМК
- У пациентов с ОНМК не рекомендуется использовать эластичную компрессию для профилактики ВТЭО [908,909].
УДД 2 УУР A
Комментарий: результаты исследований свидетельствуют, что использование эластичной компрессии не влияет на летальность, частоту ТГВ или ТЭЛА во время лечения, но статистически значимо увеличивает частоту повреждения кожного покрова.
- В качестве механических средств профилактики у пациентов с ОНМК рекомендуется рассмотреть возможность применения перемежающейся пневмокомпрессии [910–912].
УДД 2 УУР C
- У иммобилизованных пациентов, перенесших ОНМК, рекомендуется применение антикоагулянтных средств для профилактики ВТЭО, в том случае, когда польза от их применения будет выше риска геморрагических осложнений [913–921].
УДД 2 УУР А
Комментарий: назначение в профилактических дозах антикоагулянтных препаратов не влияет на летальность пациентов, но статистически значимо снижает частоту ТЭЛА. В ряде наблюдений регистрируется увеличение частоты внутричерепного кровоизлияния. Таким образом, необходима регулярная оценка пользы-риска применения фармакологических методов профилактики ВТЭО.
- У пациентов с внутричерепным кровоизлиянием рекомендуется назначение антикоагулянтов в профилактических дозах не ранее, чем через 48 часов после геморрагического ОНМК [659,922,923].
УДД 2 УУР А
Комментарий: у пациентов, перенесших внутримозговое кровоизлияние назначение профилактических доз антикоагулянтов через 48 часов после события, не привело к прогрессированию интракраниальной гематомы, увеличению летальности.
- В качестве средств для профилактики ВТЭО у пациентов, перенесших ОНМК рекомендуется использовать НФГ**, НМГ в профилактических дозах [924–927].
УДД 2 УУР А
Комментарий: применение НМГ ассоциировано с большим снижением ТГВ, комфортом для пациента, меньшей нагрузкой на медицинский персонал, но с более высоким риском экстракраниальных кровотечений, более высокой стоимостью лекарственного препарата.
5.2.9. Профилактика ВТЭО в ОРИТ
- У пациентов, находящихся в ОРИТ, рекомендуется проводить фармакологическую профилактику. В качестве лекарственных средств следует использовать НФГ**, НМГ или фондапаринукс натрия [621,928–941].
УДД 1 УУР B
Комментарий: применение антикоагулянтных средств в профилактических дозах у пациентов отделения реанимации не влияет на летальность, но уменьшает вероятность развития симптоматического ТГВ и ТЭЛА. Предпочтение следует отдавать НМГ или фондапаринуксу натрия, которые по сравнению с НФГ** уменьшают частоту ТЭЛА, симптоматических тромбозов, больших кровотечений и гепарин-индуцированной тромбоцитопении. [621,928,929,931,937,939].
- У пациентов отделения реанимации, которым не назначена фармакологическая профилактика ВТЭО рекомендуется использовать механические средства профилактики, преимущественно ППК [933,942].
УДД 1 УУР A
Комментарий: эластичная компрессия и ППК демонстрируют эффективность для профилактики ВТЭО в рамках мета-анализа смешанной популяции пациентов [615,617]. В рамках самостоятельного сетевого мета-анализа, сфокусированного на пациентах в ОРИТ, была продемонстрирована тенденция к снижению риска развития ТГВ (ОР, 0,85% 95% ДИ, 0,50-1,50) при использовании ППК в сравнении с отсутствием профилактики (комбинация отсутствия профилактики, введения плацебо и эластичной компрессии), которая не достигла статистической значимости [933].
- У пациентов ОРИТ хирургического профиля рекомендуется продолжить антикоагулянтную профилактику после выписки из стационара на протяжении 30-40 дней [907].
УДД 5 УУР C
5.2.10. Профилактика ВТЭО во время беременности и в послеродовом периоде
- Рекомендуется тактику профилактики ТГВ/ВТЭО во время беременности определять в соответствии с приложением Г19 [583].
УДД 5 УУР C
- Рекомендуется тактику профилактики ТГВ/ВТЭО в послеродовом периоде определять в соответствии с приложением Г20, дозировки антикоагулянтных препаратов представлены в приложении А3 [583].
УДД 5 УУР C
- Не рекомендуется применение компрессионной терапии с целью профилактики развития ВТЭО во время беременности и в послеродовом периоде вместо или в дополнение к антикоагулянтной профилактике у пациенток без ограничения подвижности [607,943].
УДД 5 УУР С
Комментарий: при повышенном риске развития ВТЭО основным методом профилактики является применение антикоагулянтов. Основное назначение компрессионной терапии – уменьшение или устранение «венозных» симптомов и отеков. На сегодняшний день нет данных по ряду вопросов профилактического применения компрессионной терапии:
- снижает ли риск развития ВТЭО во время беременности или в послеродовом периоде добавление компрессионной терапии к антикоагулянтной профилактике
- снижает ли риск развития ВТЭО во время беременности или в послеродовом периоде компрессионная терапия сама по себе
- какая компрессия (выше или ниже колена, степень компрессии, вид компрессионных изделий (бандаж, трикотаж) требуется для достижения поставленной цели компрессионной терапии
- снижает ли риск развития ВТЭО применение компрессии во время естественных родов
- снижает ли риск развития ВТЭО применение так называемого «госпитального» («противоэмболического» трикотажа)
Эффективность компрессионной терапии в профилактике ВТЭО у беременных без ограничения подвижности на сегодняшний день не доказана [943]. Компрессионные изделия не рассматриваются в качестве средств профилактики ВТЭО в рекомендациях профессиональных сообществ [84,598–602].
- Рекомендовано использование доступных компрессионных средств (компрессионный трикотаж, перемежающаяся пневмокомпрессия и др.) у пациенток с высоким риском кровотечения (которые не могут получать фармакологическую тромбопрофилактику), при наличии противопоказаний к антикоагулянтной тромбопрофилактике, или в качестве дополнения к антикоагулянтной тромбопрофилактике у хирургических пациентов [583,589].
УДД 5 УУР C
6. Организация оказания медицинской помощи
Организация оказания медицинской помощи пациентам с ВТЭО регламентирована действующим приказом Министерства Здравоохранения Российской Федерации (от 15 ноября 2012 г. N 922н) и оказывается в соответствии с установленным порядком. Медицинская помощь лицам с венозными тромбозами или их осложнениями, а также при подозрении на указанные состояния может осуществляться в виде первичной медико-санитарной помощи, скорой, в том числе скорой специализированной, медицинской помощи, специализированной, в том числе высокотехнологичной, медицинской помощи. Медицинская помощь может оказываться в амбулаторно (то есть в условиях, не предусматривающих круглосуточного медицинского наблюдения и лечения); стационарно (при наличии показаний для обеспечения круглосуточного медицинского наблюдения и лечения), либо в условиях дневного стационара (в условиях, предусматривающих медицинское наблюдение и лечение в дневное время, не требующих круглосуточного медицинского наблюдения и лечения).
Для большинства пациентов с установленным диагнозом тромбоза глубоких вен возможно амбулаторное лечение. Решение о необходимости госпитализации должно приниматься лечащим врачом индивидуально, исходя из наличия возможности неотложного проведения ультразвукового исследования вен нижних конечностей, риска прогрессирования тромбоза и вероятности развития тромбоэмболии легочных артерий, наличия сопутствующей патологии, возможностей проведения адекватной антикоагулянтной терапии в амбулаторных условиях и отсутствия противопоказаний к ней, комплаентности пациента к назначениям, а также возможности динамического клинического и ультразвукового контроля за течением заболевания.
В некоторых случаях при тромбозах подвздошной и нижней полой вен следует рассмотреть вопрос о возможности госпитализации пациента в специализированные отделения для проведения манипуляций, направленных на дезобструкцию пораженного венозного сегмента (фармакомеханический тромболизис, катетерный тромболизис, механическая тромбэктомия).
Беременным женщинам с тромбозом глубоких вен рекомендована госпитализация в стационар для дальнейшего решения вопроса о лечебной тактике. Согласно рекомендациям РОАГ (2021) амбулаторное лечение возможно только после осмотра сосудистого хирурга.
Решение о выписке пациентов с ТГВ из стационара и перевода на амбулаторное лечение должно приниматься индивидуально, исходя из отсутствия отрицательной динамики и возможности пролонгирования антикоагулянтной терапии в амбулаторных условиях. Амбулаторные пациенты с ТГВ подлежат регулярному наблюдению.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Факторы, влияющие на исход заболевания, а также состояние пациента подробно изложены во 2 главе
Критерии оценки качества медицинской помощи
|
№ |
Критерии качества |
УДД |
УРР |
Да/Нет |
|
Этап постановки диагноза |
||||
|
Выполнено клиническое обследование пациента (сбор анамнеза, физикальный осмотр дыхательной и сердечно-сосудистой системы, осмотр, пальпация нижних конечностей). |
1 |
А |
||
|
|
Проведено ультразвуковое ангиосканирование с оценкой состояния поверхностных и глубоких вен обеих нижних конечностей |
1 |
А |
|
|
|
Выполнен тест на Д–димер (при наличии клинического подозрения на наличие ТГВ и низкой вероятности ТГВ) |
1 |
В |
|
|
|
Выполнено определение показателей крови (гемоглобин, тромбоциты) |
5 |
С |
|
|
Этап консервативного и хирургического лечения |
||||
|
Назначена антикоагулянтная терапия (АТХ группа: антитромботические средства B01A) |
1 |
А |
||
|
|
Назначена эластическая компрессия |
2 |
А |
|
|
Этап контроля |
||||
|
Проведена профилактика рецидива ВТЭО |
2 |
В |
||
Список литературы
- Бокерия Л.А., Затевахин И.И., Кириенко А.И. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО) // Флебология. 2015. Vol. 2, № 4. P. 2.
- Perrin M., Eklof B., Maleti O. The vein glossary // J Vasc Surg Venous Lymphat Disord. 2018. Vol. 6, № 5. P. 11–217.
- Engelmann B., Massberg S. Thrombosis as an intravascular effector of innate immunity. // Nat. Rev. Immunol. Nature Publishing Group, 2013. Vol. 13, № 1. P. 34–45.
- Diaz J.A. et al. Choosing a mouse model of venous thrombosis: a consensus assessment of utility and application. // J. Thromb. Haemost. Am Heart Assoc, 2019. Vol. 17, № 4. P. 699–707.
- von Brühl M.-L. et al. Monocytes, neutrophils, and platelets cooperate to initiate and propagate venous thrombosis in mice in vivo. // J. Exp. Med. The Rockefeller University Press, 2012. Vol. 209, № 4. P. 819–835.
- Kumar N.G. et al. Fibrinolytic activity of endothelial cells from different venous beds. // J. Surg. Res. Elsevier, 2015. Vol. 194, № 1. P. 297–303.
- Gupta N., Zhao Y.-Y., Evans C.E. The stimulation of thrombosis by hypoxia. // Thromb. Res. Elsevier, 2019. Vol. 181. P. 77–83.
- Xu J. et al. Extracellular histones are major mediators of death in sepsis. // Nat. Med. Nature Publishing Group, 2009. Vol. 15, № 11. P. 1318–1321.
- Wakefield T.W., Myers D.D., Henke P.K. Role of selectins and fibrinolysis in VTE. // Thromb. Res. Elsevier, 2009. Vol. 123 Suppl. P. S35-40.
- Laurance S. et al. Gas6 Promotes Inflammatory (CCR2hiCX3CR1lo) Monocyte Recruitment in Venous Thrombosis. // Arterioscler. Thromb. Vasc. Biol. American Society of Hematology Washington, DC, 2017. Vol. 37, № 7. P. 1315–1322.
- Swystun L.L., Liaw P.C. The role of leukocytes in thrombosis. // Blood. American Society of Hematology Washington, DC, 2016. Vol. 128, № 6. P. 753–762.
- Barranco-Medina S. et al. Histone H4 promotes prothrombin autoactivation. // J. Biol. Chem. ASBMB, 2013. Vol. 288, № 50. P. 35749–35757.
- Fuchs T.A. et al. Extracellular DNA traps promote thrombosis. // Proc. Natl. Acad. Sci. U. S. A. National Acad Sciences, 2010. Vol. 107, № 36. P. 15880–15885.
- Ammollo C.T. et al. Extracellular histones increase plasma thrombin generation by impairing thrombomodulin-dependent protein C activation. // J. Thromb. Haemost. Wiley Online Library, 2011. Vol. 9, № 9. P. 1795–1803.
- Ward C.M. et al. Binding of the von Willebrand factor A1 domain to histone. // Thromb. Res. Elsevier, 1997. Vol. 86, № 6. P. 469–477.
- Semeraro F. et al. Extracellular histones promote thrombin generation through platelet-dependent mechanisms: involvement of platelet TLR2 and TLR4. // Blood. American Society of Hematology Washington, DC, 2011. Vol. 118, № 7. P. 1952–1961.
- Okano M. et al. In Vivo Imaging of Venous Thrombus and Pulmonary Embolism Using Novel Murine Venous Thromboembolism Model. // JACC. Basic to Transl. Sci. American College of Cardiology Foundation Washington DC, 2020. Vol. 5, № 4. P. 344–356.
- Cooley B.C. In vivo fluorescence imaging of large-vessel thrombosis in mice // Arterioscler. Thromb. Vasc. Biol. Am Heart Assoc, 2011. Vol. 31, № 6. P. 1351–1356.
- Shaya S.A. et al. Comparison of the effect of dabigatran and dalteparin on thrombus stability in a murine model of venous thromboembolism. // J. Thromb. Haemost. Wiley Online Library, 2016. Vol. 14, № 1. P. 143–152.
- Shaya S.A. et al. Factor XIII Prevents Pulmonary Emboli in Mice by Stabilizing Deep Vein Thrombi. // Thromb. Haemost. Georg Thieme Verlag KG, 2019. Vol. 119, № 6. P. 992–999.
- Deroo S., Deatrick K.B., Henke P.K. The vessel wall: A forgotten player in post thrombotic syndrome. // Thromb. Haemost. Schattauer GmbH, 2010. Vol. 104, № 4. P. 681–692.
- Modarai B. et al. The role of neovascularisation in the resolution of venous thrombus. // Thromb. Haemost. Schattauer GmbH, 2005. Vol. 93, № 5. P. 801–809.
- Fineschi V. et al. Histological age determination of venous thrombosis: a neglected forensic task in fatal pulmonary thrombo-embolism. // Forensic Sci. Int. Elsevier, 2009. Vol. 186, № 1–3. P. 22–28.
- Lee Y.-U. et al. Histological and biomechanical changes in a mouse model of venous thrombus remodeling. // Biorheology. IOS Press, 2015. Vol. 52, № 3. P. 235–245.
- Comerota A.J. et al. A histological and functional description of the tissue causing chronic postthrombotic venous obstruction. // Thromb. Res. Elsevier, 2015. Vol. 135, № 5. P. 882–887.
- Aguilera C.M. et al. Relationship between type IV collagen degradation, metalloproteinase activity and smooth muscle cell migration and proliferation in cultured human saphenous vein. // Cardiovasc. Res. Elsevier Science, 2003. Vol. 58, № 3. P. 679–688.
- Nicklas J.M., Gordon A.E., Henke P.K. Resolution of Deep Venous Thrombosis: Proposed Immune Paradigms. // Int. J. Mol. Sci. Multidisciplinary Digital Publishing Institute, 2020. Vol. 21, № 6. P. 2080.
- Adelman B. et al. Plasmin effect on platelet glycoprotein Ib-von Willebrand factor interactions. // Blood. 1985. Vol. 65, № 1. P. 32–40.
- Singh I. et al. Failure of thrombus to resolve in urokinase-type plasminogen activator gene-knockout mice: rescue by normal bone marrow-derived cells. // Circulation. Am Heart Assoc, 2003. Vol. 107, № 6. P. 869–875.
- Suzuki Y. et al. Surface-retained tPA is essential for effective fibrinolysis on vascular endothelial cells. // Blood. American Society of Hematology Washington, DC, 2011. Vol. 118, № 11. P. 3182–3185.
- Baldwin J.F. et al. The role of urokinase plasminogen activator and plasmin activator inhibitor-1 on vein wall remodeling in experimental deep vein thrombosis. // J. Vasc. Surg. Elsevier, 2012. Vol. 56, № 4. P. 1089–1097.
- Weitz J.I., Leslie B., Hirsh J. α2-Antiplasmin supplementation inhibits tissue plasminogen activator- induced fibrinogenolysis and bleeding with little effect on thrombolysis // J. Clin. Invest. Am Soc Clin Investig, 1993. Vol. 91, № 4. P. 1343–1350.
- Urano T., Castellino F.J., Suzuki Y. Regulation of plasminogen activation on cell surfaces and fibrin. // J. Thromb. Haemost. Wiley Online Library, 2018. Vol. 16, № 8. P. 1487–1497.
- Fields G.B. Interstitial collagen catabolism. // J. Biol. Chem. ASBMB, 2013. Vol. 288, № 13. P. 8785–8793.
- Mosevoll K.A. et al. Altered plasma levels of cytokines, soluble adhesion molecules and matrix metalloproteases in venous thrombosis. // Thromb. Res. Elsevier, 2015. Vol. 136, № 1. P. 30–39.
- Nguyen K.P. et al. Matrix Metalloproteinase 9 (MMP-9) Regulates Vein Wall Biomechanics in Murine Thrombus Resolution. // PLoS One. Public Library of Science San Francisco, CA USA, 2015. Vol. 10, № 9. P. e0139145.
- Nosaka M. et al. Time-dependent appearance of intrathrombus neutrophils and macrophages in a stasis-induced deep vein thrombosis model and its application to thrombus age determination. // Int. J. Legal Med. Springer, 2009. Vol. 123, № 3. P. 235–240.
- Kirsch R. et al. Fibrinogen is degraded and internalized during incubation with neutrophils, and fibrinogen products localize to electron lucent vesicles. // Biochem. J. Portland Press Ltd., 2002. Vol. 364, № Pt 2. P. 403–412.
- McGuinness C.L. et al. Recruitment of labelled monocytes by experimental venous thrombi. // Thromb. Haemost. Schattauer GmbH, 2001. Vol. 85, № 6. P. 1018–1024.
- Nathan C., Ding A. Nonresolving inflammation. // Cell. Elsevier, 2010. Vol. 140, № 6. P. 871–882.
- Chang C.-F. et al. Erythrocyte efferocytosis modulates macrophages towards recovery after intracerebral hemorrhage. // J. Clin. Invest. Am Soc Clin Investig, 2018. Vol. 128, № 2. P. 607–624.
- Dewyer N.A. et al. Divergent effects of Tlr9 deletion in experimental late venous thrombosis resolution and vein wall injury. // Thromb. Haemost. Schattauer GmbH, 2015. Vol. 114, № 5. P. 1028–1037.
- Fleetwood A.J. et al. Urokinase plasminogen activator is a central regulator of macrophage three-dimensional invasion, matrix degradation, and adhesion. // J. Immunol. Am Assoc Immnol, 2014. Vol. 192, № 8. P. 3540–3547.
- Meznarich J. et al. Urokinase Plasminogen Activator Induces Pro-Fibrotic/M2 Phenotype in Murine Cardiac Macrophages // PLoS One / ed. Frangogiannis N. Public Library of Science San Francisco, USA, 2013. Vol. 8, № 3. P. e57837.
- Sheng J. et al. M2 macrophage-mediated interleukin-4 signalling induces myofibroblast phenotype during the progression of benign prostatic hyperplasia. // Cell Death Dis. Nature Publishing Group, 2018. Vol. 9, № 7. P. 755.
- Lin F., Wang N., Zhang T. The role of endothelial-mesenchymal transition in development and pathological process. // IUBMB Life. Wiley Online Library, 2012. Vol. 64, № 9. P. 717–723.
- Piera-Velazquez S., Jimenez S.A. Endothelial to Mesenchymal Transition: Role in Physiology and in the Pathogenesis of Human Diseases. // Physiol. Rev. American Physiological Society Bethesda, MD, 2019. Vol. 99, № 2. P. 1281–1324.
- Privratsky J.R., Newman D.K., Newman P.J. PECAM-1: conflicts of interest in inflammation. // Life Sci. Elsevier, 2010. Vol. 87, № 3–4. P. 69–82.
- Lertkiatmongkol P. et al. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31). // Curr. Opin. Hematol. NIH Public Access, 2016. Vol. 23, № 3. P. 253–259.
- Li W.-D., Li X.-Q. Endothelial progenitor cells accelerate the resolution of deep vein thrombosis. // Vascul. Pharmacol. Elsevier, 2016. Vol. 83. P. 10–16.
- Podor T.J. et al. Vimentin exposed on activated platelets and platelet microparticles localizes vitronectin and plasminogen activator inhibitor complexes on their surface. // J. Biol. Chem. ASBMB, 2002. Vol. 277, № 9. P. 7529–7539.
- Diaz J.A. et al. P-selectin inhibition therapeutically promotes thrombus resolution and prevents vein wall fibrosis better than enoxaparin and an inhibitor to von Willebrand factor. // Arterioscler. Thromb. Vasc. Biol. Am Heart Assoc, 2015. Vol. 35, № 4. P. 829–837.
- Heit J.A., Spencer F.A., White R.H. The epidemiology of venous thromboembolism. // J. Thromb. Thrombolysis. Springer, 2016. Vol. 41, № 1. P. 3–14.
- Heit J.A. Epidemiology of venous thromboembolism // Nat. Rev. Cardiol. Nature Publishing Group, 2015. Vol. 12, № 8. P. 464–474.
- Spencer F.A. et al. The Worcester Venous Thromboembolism study: a population-based study of the clinical epidemiology of venous thromboembolism. // J. Gen. Intern. Med. Wiley Online Library, 2006. Vol. 21, № 7. P. 722–727.
- Silverstein M.D. et al. Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study. // Arch. Intern. Med. American Medical Association, 1998. Vol. 158, № 6. P. 585–593.
- Naess I.A. et al. Incidence and mortality of venous thrombosis: a population-based study. // J. Thromb. Haemost. Wiley Online Library, 2007. Vol. 5, № 4. P. 692–699.
- Roach R.E.J. et al. Differential risks in men and women for first and recurrent venous thrombosis: the role of genes and environment: reply. // J. Thromb. Haemost. Wiley Online Library, 2015. Vol. 13, № 5. P. 886–887.
- Kane E. V et al. A population-based study of venous thrombosis in pregnancy in Scotland 1980-2005. // Eur. J. Obstet. Gynecol. Reprod. Biol. Elsevier, 2013. Vol. 169, № 2. P. 223–229.
- Heit J.A. et al. Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30-year population-based study. // Ann. Intern. Med. American College of Physicians, 2005. Vol. 143, № 10. P. 697–706.
- White R.H., Zhou H., Romano P.S. Incidence of idiopathic deep venous thrombosis and secondary thromboembolism among ethnic groups in California. // Ann. Intern. Med. American College of Physicians, 1998. Vol. 128, № 9. P. 737–740.
- Zakai N.A., McClure L.A., Judd S.E. Racial and regional differences in venous thromboembolism in the United States in 3 cohorts // Circulation. Am Heart Assoc, 2014. Vol. 129, № 14. P. 1502–1509.
- Cheuk B.L.Y., Cheung G.C.Y., Cheng S.W.K. Epidemiology of venous thromboembolism in a Chinese population. // Br. J. Surg. Oxford University Press, 2004. Vol. 91, № 4. P. 424–428.
- Hooper W.C. et al. Venous thromboembolism hospitalizations among American Indians and Alaska Natives. // Thromb. Res. Elsevier, 2002. Vol. 108, № 5–6. P. 273–278.
- Khan F. et al. Long term risk of symptomatic recurrent venous thromboembolism after discontinuation of anticoagulant treatment for first unprovoked venous thromboembolism event: systematic review and meta-analysis. // BMJ. British Medical Journal Publishing Group, 2019. Vol. 366. P. l4363.
- Schulman S. et al. Post-thrombotic syndrome, recurrence, and death 10 years after the first episode of venous thromboembolism treated with warfarin for 6 weeks or 6 months. // J. Thromb. Haemost. Wiley Online Library, 2006. Vol. 4, № 4. P. 734–742.
- van Dongen C.J.J. et al. The incidence of recurrent venous thromboembolism after treatment with vitamin K antagonists in relation to time since first event: a meta-analysis. // Arch. Intern. Med. American Medical Association, 2003. Vol. 163, № 11. P. 1285–1293.
- Franchini M., Mannucci P.M. ABO blood group and thrombotic vascular disease. // Thromb. Haemost. Schattauer GmbH, 2014. Vol. 112, № 6. P. 1103–1109.
- Bank I. et al. Prothrombin 20210A mutation: a mild risk factor for venous thromboembolism but not for arterial thrombotic disease and pregnancy-related complications in a family study. // Arch. Intern. Med. American Medical Association, 2004. Vol. 164, № 17. P. 1932–1937.
- Olaf M., Cooney R. Deep Venous Thrombosis. // Emerg. Med. Clin. North Am. Elsevier, 2017. Vol. 35, № 4. P. 743–770.
- Томченко А.И. et al. Группы крови AB0 и тромбоз глубоких вен нижних конечностей у пациентов пожилого и старческого возраста. // Флебология. 2021. Vol. 15, № 1.
- Чечулова А.В. et al. Оценка ген-генных взаимодействий ряда факторов плазменного звена гемостаза у пациентов с ранним дебютом венозных тромбоэмболических осложнений. // Флебология. 2021. Vol. 15, № 1.
- Гаврилов Е.К. et al. Возможное значение наследственных тромбофилий в возникновении и осложненном течении идиопатических острых венозных тромбозов нижних конечностей // Флебология. Общество с ограниченной ответственностью Издательство Медиа Сфера, 2020. Vol. 14, № 2. P. 83–88.
- van Stralen K.J. et al. Mechanisms of the factor V Leiden paradox. // Arterioscler. Thromb. Vasc. Biol. Am Heart Assoc, 2008. Vol. 28, № 10. P. 1872–1877.
- Meissner M.H. Epidemiology and risk factors of acute venous thrombosis // Handbook of Venous and Lymphatic Disorders. CRC Press, 2017. P. 107–119.
- van Hylckama Vlieg A., Middeldorp S. Hormone therapies and venous thromboembolism: where are we now? // J. Thromb. Haemost. Wiley Online Library, 2011. Vol. 9, № 2. P. 257–266.
- de Bastos M. et al. Combined oral contraceptives: venous thrombosis. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2014. № 3. P. CD010813.
- Roderick P. Epidemiology of Venous Thromboembolism // Clin. Risk. Elsevier, 1997. Vol. 3, № 3. P. 69–74.
- Ay C. et al. Prediction of venous thromboembolism in cancer patients. // Blood. American Society of Hematology Washington, DC, 2010. Vol. 116, № 24. P. 5377–5382.
- Sciascia S. et al. Thrombotic risk assessment in antiphospholipid syndrome: the role of new antibody specificities and thrombin generation assay. // Clin. Mol. Allergy. Springer, 2016. Vol. 14, № 1. P. 6.
- Gris J.-C. et al. Thrombosis and paroxysmal nocturnal haemoglobinuria // Thromb. Updat. Elsevier, 2021. Vol. 5. P. 100074.
- Mazzolai L. et al. Second consensus document on diagnosis and management of acute deep vein thrombosis: updated document elaborated by the ESC Working Group on aorta and peripheral vascular diseases and the ESC Working Group on pulmonary circulation and right ventricular fu // Eur. J. Prev. Cardiol. 2022. Vol. 29, № 8. P. 1248–1263.
- Kearon C. et al. Categorization of patients as having provoked or unprovoked venous thromboembolism: guidance from the SSC of ISTH. // J. Thromb. Haemost. 2016. Vol. 14, № 7. P. 1480–1483.
- Konstantinides S. V., Meyer G., Galié N. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS) // Eur. Respir. J. European Respiratory Society, 2019. Vol. 54, № 3.
- Kakkos S., Gohel M., Baekgaard N. Editor’s Choice - European Society for Vascular Surgery (ESVS) 2021 Clinical Practice Guidelines on the Management of Venous Thrombosis // Eur. J. Vasc. Endovasc. Surg. Eur J Vasc Endovasc Surg, 2021. Vol. 61, № 1. P. 9–82.
- Stevens S.M. et al. Antithrombotic Therapy for VTE Disease: Second Update of the CHEST Guideline and Expert Panel Report. // Chest. Elsevier, 2021. Vol. 160, № 6. P. e545–e608.
- Prins M.H. et al. Risk of recurrent venous thromboembolism according to baseline risk factor profiles. // Blood Adv. American Society of Hematology Washington, DC, 2018. Vol. 2, № 7. P. 788–796.
- Key N.S. et al. Venous Thromboembolism Prophylaxis and Treatment in Patients With Cancer: ASCO Clinical Practice Guideline Update. // J. Clin. Oncol. American Society of Clinical Oncology, 2020. Vol. 38, № 5. P. 496–520.
- Iorio A. et al. Risk of recurrence after a first episode of symptomatic venous thromboembolism provoked by a transient risk factor: a systematic review. // Arch. Intern. Med. American Medical Association, 2010. Vol. 170, № 19. P. 1710–1716.
- Alhabouni S. et al. PP88. Lower Extremity Occlusive vs Non-occlusive DVT and the Risk of Pulmonary Embolism // J. Vasc. Surg. Elsevier, 2009. Vol. 49, № 5. P. S40.
- Pacouret G. Free-Floating Thrombus and Embolic Risk in Patients With Angiographically Confirmed Proximal Deep Venous Thrombosis. A Prospective Study // Arch. Intern. Med. American Medical Association, 1997. Vol. 157, № 3. P. 305.
- Ortel T.L. et al. American Society of Hematology 2020 guidelines for management of venous thromboembolism: treatment of deep vein thrombosis and pulmonary embolism. // Blood Adv. American Society of Hematology Washington, DC, 2020. Vol. 4, № 19. P. 4693–4738.
- Robert-Ebadi H., Righini M. Should we diagnose and treat distal deep vein thrombosis? // Hematol. Am. Soc. Hematol. Educ. Progr. American Society of Hematology Washington, DC, 2017. Vol. 2017, № 1. P. 231–236.
- Крутько В.С., Потейко П.И., Ходош Э.М. Наружные симптомы у больных с тромбоэмболией легочной артерии // Медицина неотложных состояний. ФЛП «Заславский Александр Юрьевич», 2013. № 2 (49).
- Небылицин Ю.С., Сушков С.А. Диагностика тромбоза глубоких вен нижних конечностей // Новости хирургии. Учреждение образования «Витебский государственный ордена Дружбы народов …, 2007. Vol. 15, № 3.
- Бойко В.В., Криворотько И.В. Стратегия хирургического лечения местнораспространенных опухолей малого таза с применением эвисцераций. Сообщение 3. Рак прямой кишки, матки, яичников, предстательной железы, тератоидные опухоли малого таза // Международный медицинский журнал. Інститут проблем кріобіології і кріомедицини НАН України, 2008.
- Greer I.A. CLINICAL PRACTICE. Pregnancy Complicated by Venous Thrombosis. // N. Engl. J. Med. Mass Medical Soc, 2015. Vol. 373, № 6. P. 540–547.
- Chan W.-S., Spencer F.A., Ginsberg J.S. Anatomic distribution of deep vein thrombosis in pregnancy. // CMAJ. Can Med Assoc, 2010. Vol. 182, № 7. P. 657–660.
- Wells P.S. Integrated strategies for the diagnosis of venous thromboembolism. // J. Thromb. Haemost. Wiley Online Library, 2007. Vol. 5 Suppl 1. P. 41–50.
- Wells P.S. et al. Does this patient have deep vein thrombosis? // JAMA. American Medical Association, 2006. Vol. 295, № 2. P. 199–207.
- Páramo J.A., Bounameaux H., Levi M. Scores and Algorithms in Haemostasis and Thrombosis. 2014.
- Geersing G.J. et al. Exclusion of deep vein thrombosis using the Wells rule in clinically important subgroups: individual patient data meta-analysis. // BMJ. British Medical Journal Publishing Group, 2014. Vol. 348. P. g1340.
- Wells P.S., Anderson D.R., Rodger M. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer // Thromb. Haemost. Schattauer GmbH, 2000. Vol. 83, № 03. P. 416–420.
- Shen J.-H. et al. Comparison of the Wells score with the revised Geneva score for assessing suspected pulmonary embolism: a systematic review and meta-analysis. // J. Thromb. Thrombolysis. Springer, 2016. Vol. 41, № 3. P. 482–492.
- Le Gal G. et al. Prediction of pulmonary embolism in the emergency department: the revised Geneva score. // Ann. Intern. Med. American College of Physicians, 2006. Vol. 144, № 3. P. 165–171.
- Tritschler T. et al. Venous Thromboembolism: Advances in Diagnosis and Treatment. // JAMA. American Medical Association, 2018. Vol. 320, № 15. P. 1583–1594.
- Cuker A. et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: heparin-induced thrombocytopenia // Blood Adv. American Society of Hematology Washington, DC, 2018. Vol. 2, № 22. P. 3360–3392.
- Bernardi E., Camporese G. Diagnosis of deep-vein thrombosis. // Thromb. Res. Elsevier, 2018. Vol. 163. P. 201–206.
- Michiels J.J. et al. Duplex ultrasound, clinical score, thrombotic risk, and D-dimer testing for evidence based diagnosis and management of deep vein thrombosis and alternative diagnoses in the primary care setting and outpatient ward. // Int. Angiol. 2014. Vol. 33, № 1. P. 1–19.
- Streiff M.B. et al. Guidance for the treatment of deep vein thrombosis and pulmonary embolism. // J. Thromb. Thrombolysis. Springer, 2016. Vol. 41, № 1. P. 32–67.
- Ye F. et al. Venothromboembolic signs and medical eponyms: Part II. // Thromb. Res. Elsevier, 2019. Vol. 182. P. 205–213.
- Goodacre S., Sutton A.J., Sampson F.C. Meta-analysis: The value of clinical assessment in the diagnosis of deep venous thrombosis. // Ann. Intern. Med. American College of Physicians, 2005. Vol. 143, № 2. P. 129–139.
- Michiels J.J. et al. A critical appraisal of non-invasive diagnosis and exclusion of deep vein thrombosis and pulmonary embolism in outpatients with suspected deep vein thrombosis or pulmonary embolism: how many tests do we need? // Int. Angiol. Edizioni Minerva Medica, 2005. Vol. 24, № 1. P. 27–39.
- Sartori M. et al. The Wells rule and D-dimer for the diagnosis of isolated distal deep vein thrombosis. // J. Thromb. Haemost. Wiley Online Library, 2012. Vol. 10, № 11. P. 2264–2269.
- Al-Khafaji R.A., Schierbeck L. Deep Venous Thrombosis in a Patient with a Moderate Pretest Probability and a Negative D-Dimer Test: A Review of the Diagnostic Algorithms // J. Blood Med. Dove Press, 2020. Vol. Volume 11. P. 173–184.
- Huisman M. V, Klok F.A. Diagnostic management of acute deep vein thrombosis and pulmonary embolism. // J. Thromb. Haemost. Wiley Online Library, 2013. Vol. 11, № 3. P. 412–422.
- Le Gal G., Righini M. Controversies in the diagnosis of venous thromboembolism. // J. Thromb. Haemost. Wiley Online Library, 2015. Vol. 13 Suppl 1. P. S259-65.
- Stone J. et al. Deep vein thrombosis: pathogenesis, diagnosis, and medical management. // Cardiovasc. Diagn. Ther. AME Publications, 2017. Vol. 7, № Suppl 3. P. S276–S284.
- Hargett C.W., Tapson V.F. Clinical probability and D-dimer testing: how should we use them in clinical practice? // Semin. Respir. Crit. Care Med. © Thieme Medical Publishers, 2008. Vol. 29, № 1. P. 15–24.
- Hirsh J. et al. Parenteral anticoagulants: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). // Chest. 2008. Vol. 133, № 6 Suppl. P. 141S-159S.
- Hong J. et al. Updated recommendations for the treatment of venous thromboembolism. // Blood Res. Korean Society of Hematology; Korean Society of Blood and Marrow …, 2021. Vol. 56, № 1. P. 6–16.
- Garcia D.A. et al. Parenteral anticoagulants: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. // Chest. Elsevier, 2012. Vol. 141, № 2 Suppl. P. e24S-e43S.
- DeWald T.A., Washam J.B., Becker R.C. Anticoagulants: Pharmacokinetics, Mechanisms of Action, and Indications. // Neurosurg. Clin. N. Am. Elsevier, 2018. Vol. 29, № 4. P. 503–515.
- Guyatt G.H. et al. Executive summary: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. // Chest. 2012. Vol. 141, № 2 Suppl. P. 7S-47S.
- Chen A., Stecker E., A Warden B. Direct Oral Anticoagulant Use: A Practical Guide to Common Clinical Challenges. // J. Am. Heart Assoc. Am Heart Assoc, 2020. Vol. 9, № 13. P. e017559.
- Guyatt G.H., Akl E.A., Crowther M. Executive summary: antithrombotic therapy and prevention of thrombosis: American College of Chest Physicians evidence-based clinical practice guidelines // Chest. American College of Chest Physicians, 2012. Vol. 141, № 2 Suppl. P. 7S.
- Wu T. et al. The effect of anti‐Xa monitoring on the safety and efficacy of low‐molecular‐weight heparin anticoagulation therapy: A systematic review and meta‐analysis // J. Clin. Pharm. Ther. Wiley Online Library, 2020. Vol. 45, № 4. P. 602–608.
- Hutt Centeno E., Militello M., Gomes M.P. Anti-Xa assays: What is their role today in antithrombotic therapy? // Cleve. Clin. J. Med. 2019. Vol. 86, № 6. P. 417–425.
- Kufel W.D. et al. Clinical Feasibility of Monitoring Enoxaparin Anti-Xa Concentrations: Are We Getting It Right? // Hosp. Pharm. SAGE Publications Sage CA: Los Angeles, CA, 2017. Vol. 52, № 3. P. 214–220.
- Smythe M.A. et al. Guidance for the practical management of the heparin anticoagulants in the treatment of venous thromboembolism. // J. Thromb. Thrombolysis. Springer, 2016. Vol. 41, № 1. P. 165–186.
- Verhoeff K. et al. Relationship between anti-Xa level achieved with prophylactic low-molecular weight heparin and venous thromboembolism in trauma patients: A systematic review and meta-analysis. // J. Trauma Acute Care Surg. 2022. Vol. 93, № 2. P. e61–e70.
- Witt D.M. et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: optimal management of anticoagulation therapy. // Blood Adv. American Society of Hematology Washington, DC, 2018. Vol. 2, № 22. P. 3257–3291.
- Zuker-Herman R. et al. Comparison between two-point and three-point compression ultrasound for the diagnosis of deep vein thrombosis. // J. Thromb. Thrombolysis. Springer, 2018. Vol. 45, № 1. P. 99–105.
- Needleman L. et al. Ultrasound for Lower Extremity Deep Venous Thrombosis: Multidisciplinary Recommendations From the Society of Radiologists in Ultrasound Consensus Conference. // Circulation. Am Heart Assoc, 2018. Vol. 137, № 14. P. 1505–1515.
- Lim W., Le Gal G., Bates S.M. American Society of Hematology 2018 guidelines for management of venous thromboembolism: diagnosis of venous thromboembolism // Blood Adv. American Society of Hematology Washington, DC, 2018. Vol. 2, № 22. P. 3226–3256.
- Maufus M. et al. Diagnosis of deep vein thrombosis recurrence: Ultrasound criteria. // Thromb. Res. Elsevier, 2018. Vol. 161. P. 78–83.
- Goodacre S. et al. Systematic review and meta-analysis of the diagnostic accuracy of ultrasonography for deep vein thrombosis. // BMC Med. Imaging. Springer, 2005. Vol. 5, № 1. P. 6.
- Righini M. et al. Clinical relevance of distal deep vein thrombosis. Review of literature data. // Thromb. Haemost. Schattauer GmbH, 2006. Vol. 95, № 1. P. 56–64.
- Kraaijpoel N. et al. Diagnostic accuracy of three ultrasonography strategies for deep vein thrombosis of the lower extremity: A systematic review and meta-analysis. // PLoS One. Public Library of Science San Francisco, CA USA, 2020. Vol. 15, № 2. P. e0228788.
- Bernardi E. et al. Serial 2-point ultrasonography plus D-dimer vs whole-leg color-coded Doppler ultrasonography for diagnosing suspected symptomatic deep vein thrombosis: a randomized controlled trial. // JAMA. American Medical Association, 2008. Vol. 300, № 14. P. 1653–1659.
- Gibson N.S. et al. Safety and sensitivity of two ultrasound strategies in patients with clinically suspected deep venous thrombosis: a prospective management study. // J. Thromb. Haemost. Wiley Online Library, 2009. Vol. 7, № 12. P. 2035–2041.
- Hull R.D. et al. The diagnosis of acute, recurrent, deep-vein thrombosis: a diagnostic challenge. // Circulation. Am Heart Assoc, 1983. Vol. 67, № 4. P. 901–906.
- Tzoran I. et al. Silent pulmonary embolism in patients with proximal deep vein thrombosis in the lower limbs. // J. Thromb. Haemost. Wiley Online Library, 2012. Vol. 10, № 4. P. 564–571.
- Stein P.D. et al. Silent pulmonary embolism in patients with deep venous thrombosis: a systematic review. // Am. J. Med. Elsevier, 2010. Vol. 123, № 5. P. 426–431.
- Girard P. et al. Diagnosis of pulmonary embolism in patients with proximal deep vein thrombosis: specificity of symptoms and perfusion defects at baseline and during anticoagulant therapy. // Am. J. Respir. Crit. Care Med. American Thoracic Society New York, NY, 2001. Vol. 164, № 6. P. 1033–1037.
- García-Fuster M.J. et al. Should we look for silent pulmonary embolism in patients with deep venous thrombosis? // BMC Cardiovasc. Disord. Springer, 2014. Vol. 14, № 1. P. 178.
- Hughes M.J., Stein P.D., Matta F. Silent pulmonary embolism in patients with distal deep venous thrombosis: systematic review. // Thromb. Res. Elsevier, 2014. Vol. 134, № 6. P. 1182–1185.
- Kakkos S.K., Kirkilesis G.I., Tsolakis I.A. Editor’s Choice - efficacy and safety of the new oral anticoagulants dabigatran, rivaroxaban, apixaban, and edoxaban in the treatment and secondary prevention of venous thromboembolism: a systematic review and meta-analysis of phase III trials. // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2014. Vol. 48, № 5. P. 565–575.
- Barbar S. et al. A risk assessment model for the identification of hospitalized medical patients at risk for venous thromboembolism: the Padua Prediction Score. // J. Thromb. Haemost. Wiley Online Library, 2010. Vol. 8, № 11. P. 2450–2457.
- Whitlock R.P., Sun J.C., Fremes S.E. Prevention of VTE in nonsurgical patients: antithrombotic therapy and prevention of thrombosis: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines // Chest. Elsevier, 2012. Vol. 141, № 2. P. e44S-e88S.
- Pandor A. et al. Risk assessment models for venous thromboembolism in hospitalised adult patients: a systematic review // BMJ Open. Schattauer GmbH, 2021. Vol. 11, № 7. P. e045672.
- Raskob G.E. et al. The MARINER trial of rivaroxaban after hospital discharge for medical patients at high risk of VTE. Design, rationale, and clinical implications. // Thromb. Haemost. Citeseer, 2016. Vol. 115, № 6. P. 1240–1248.
- Gibson C.M. et al. The IMPROVEDD VTE Risk Score: Incorporation of D-Dimer into the IMPROVE Score to Improve Venous Thromboembolism Risk Stratification. // TH open companion J. to Thromb. Haemost. Georg Thieme Verlag KG, 2017. Vol. 1, № 1. P. e56–e65.
- Spyropoulos A.C. et al. Predictive and associative models to identify hospitalized medical patients at risk for VTE. // Chest. Elsevier, 2011. Vol. 140, № 3. P. 706–714.
- Pannucci C.J. et al. Individualized Venous Thromboembolism Risk Stratification Using the 2005 Caprini Score to Identify the Benefits and Harms of Chemoprophylaxis in Surgical Patients: A Meta-analysis. // Ann. Surg. LWW, 2017. Vol. 265, № 6. P. 1094–1103.
- Hanh B.M. et al. Determination of Risk Factors for Venous Thromboembolism by an Adapted Caprini Scoring System in Surgical Patients. // J. Pers. Med. Multidisciplinary Digital Publishing Institute, 2019. Vol. 9, № 3. P. 36.
- Cramer J.D. et al. Risk of Venous Thromboembolism Among Otolaryngology Patients vs General Surgery and Plastic Surgery Patients // JAMA Otolaryngol. Neck Surg. American Medical Association, 2017. Vol. 144, № 1. P. 9–17.
- Grant P.J. et al. Assessing the Caprini Score for Risk Assessment of Venous Thromboembolism in Hospitalized Medical Patients. // Am. J. Med. Elsevier, 2016. Vol. 129, № 5. P. 528–535.
- Лобастов К.В. et al. Шкала Caprini как инструмент для индивидуальной стратификации риска развития послеоперационных венозных тромбоэмболий в группе высокого риска // Хирургия. Журнал им. НИ Пирогова. Общество с ограниченной ответственностью Издательство Медиа Сфера, 2014. № 12. P. 16–23.
- Pannucci C.J. et al. Postoperative enoxaparin prevents symptomatic venous thromboembolism in high-risk plastic surgery patients. // Plast. Reconstr. Surg. NIH Public Access, 2011. Vol. 128, № 5. P. 1093–1103.
- Shuman A.G. et al. Stratifying the risk of venous thromboembolism in otolaryngology. // Otolaryngol. Head. Neck Surg. SAGE Publications Sage CA: Los Angeles, CA, 2012. Vol. 146, № 5. P. 719–724.
- Obi A.T., Pannucci C.J., Nackashi A. Validation of the Caprini venous thromboembolism risk assessment model in critically ill surgical patients // JAMA Surg. American Medical Association, 2015. Vol. 150, № 10. P. 941–948.
- Yarlagadda B.B. et al. Venous thromboembolism in otolaryngology surgical inpatients receiving chemoprophylaxis. // Head Neck. Wiley Online Library, 2014. Vol. 36, № 8. P. 1087–1093.
- Lobastov K. et al. Utilization of the Caprini score in conjunction with thrombodynamic testing reduces the number of unpredicted postoperative venous thromboembolism events in patients with colorectal cancer. // J. Vasc. surgery. Venous Lymphat. Disord. Elsevier, 2020. Vol. 8, № 1. P. 31–41.
- Lobastov K. et al. Validation of the Caprini risk assessment model for venous thromboembolism in high-risk surgical patients in the background of standard prophylaxis. // J. Vasc. surgery. Venous Lymphat. Disord. Elsevier, 2016. Vol. 4, № 2. P. 153–160.
- Paz Rios L.H. et al. Validation of a Patient-Completed Caprini Risk Assessment Tool for Spanish, Arabic, and Polish Speakers. // Clin. Appl. Thromb. Hemost. SAGE Publications Sage CA: Los Angeles, CA, 2018. Vol. 24, № 3. P. 502–512.
- Fuentes H.E. et al. Validation of a Patient-Completed Caprini Risk Score for Venous Thromboembolism Risk Assessment. // TH open companion J. to Thromb. Haemost. Georg Thieme Verlag KG, 2017. Vol. 1, № 2. P. e106–e112.
- Chen X. et al. Clinical Validation of the Chinese Version of Patient Completed Caprini Risk Assessment Form // Clin. Appl. Thromb. SAGE Publications Sage CA: Los Angeles, CA, 2020. Vol. 26. P. 107602962094503.
- Лобастов К.В., Саутина Е.В. К.А.В. Конкурентная валидация русскоязычной версии пациент-ориентированного опросника на основе шкалы Каприни у хирургических пациентов // Флебология. 2022. Vol. 1, № 16. P. 6–15.
- Khorana A.A. et al. Development and validation of a predictive model for chemotherapy-associated thrombosis. // Blood. American Society of Hematology Washington, DC, 2008. Vol. 111, № 10. P. 4902–4907.
- Verso M. et al. A modified Khorana risk assessment score for venous thromboembolism in cancer patients receiving chemotherapy: the Protecht score. // Intern. Emerg. Med. Springer Nature BV, 2012. Vol. 7, № 3. P. 291–292.
- Pelzer U. et al. Primary pharmacological prevention of thromboembolic events in ambulatory patients with advanced pancreatic cancer treated with chemotherapy? // DMW - Dtsch. Medizinische Wochenschrift. 2013. Vol. 138, № 41. P. 2084–2088.
- van Es N. et al. Comparison of risk prediction scores for venous thromboembolism in cancer patients: a prospective cohort study. // Haematologica. Ferrata Storti Foundation, 2017. Vol. 102, № 9. P. 1494–1501.
- van Es N. et al. The Khorana score for prediction of venous thromboembolism in cancer patients: An individual patient data meta-analysis. // J. Thromb. Haemost. Wiley Online Library, 2020. Vol. 18, № 8. P. 1940–1951.
- Eichinger S. et al. Risk assessment of recurrence in patients with unprovoked deep vein thrombosis or pulmonary embolism: the Vienna prediction model. // Circulation. Am Heart Assoc, 2010. Vol. 121, № 14. P. 1630–1636.
- Ensor J. et al. Systematic review of prognostic models for recurrent venous thromboembolism (VTE) post-treatment of first unprovoked VTE. // BMJ Open. British Medical Journal Publishing Group, 2016. Vol. 6, № 5. P. e011190.
- Tosetto A. et al. Predicting disease recurrence in patients with previous unprovoked venous thromboembolism: a proposed prediction score (DASH). // J. Thromb. Haemost. Wiley Online Library, 2012. Vol. 10, № 6. P. 1019–1025.
- van Hylckama Vlieg A., Baglin T.P. The risk of a first and a recurrent venous thrombosis associated with an elevated D-dimer level and an elevated thrombin potential: results of the THE-VTE study: reply. // J. Thromb. Haemost. Wiley Online Library, 2015. Vol. 13, № 12. P. 2286–2287.
- Rodger M.A. et al. Identifying unprovoked thromboembolism patients at low risk for recurrence who can discontinue anticoagulant therapy. // CMAJ. Can Med Assoc, 2008. Vol. 179, № 5. P. 417–426.
- Rodger M.A. et al. Validating the HERDOO2 rule to guide treatment duration for women with unprovoked venous thrombosis: multinational prospective cohort management study. // BMJ. British Medical Journal Publishing Group, 2017. Vol. 356. P. j1065.
- Pisters R. et al. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. // Chest. Elsevier, 2010. Vol. 138, № 5. P. 1093–1100.
- Brown J.D. et al. Risk Stratification for Bleeding Complications in Patients With Venous Thromboembolism: Application of the HAS-BLED Bleeding Score During the First 6 Months of Anticoagulant Treatment. // J. Am. Heart Assoc. Am Heart Assoc, 2018. Vol. 7, № 6. P. e007901.
- Kooiman J. et al. The HAS-BLED Score Identifies Patients with Acute Venous Thromboembolism at High Risk of Major Bleeding Complications during the First Six Months of Anticoagulant Treatment. // PLoS One. Public Library of Science San Francisco, CA USA, 2015. Vol. 10, № 4. P. e0122520.
- Zhu W., He W., Guo L. The HAS-BLED score for predicting major bleeding risk in anticoagulated patients with atrial fibrillation: A systematic review and meta-analysis // Clinical Cardiology. Wiley Online Library, 2015. Vol. 38, № 9. P. 555–561.
- Santise G. et al. The HAS-BLED Score is Associated With Major Bleeding in Patients After Cardiac Surgery. // J. Cardiothorac. Vasc. Anesth. Elsevier, 2019. Vol. 33, № 6. P. 1601–1606.
- Castini D. et al. Utility of the HAS-BLED score for risk stratification of patients with acute coronary syndrome. // Heart Vessels. Springer, 2019. Vol. 34, № 10. P. 1621–1630.
- Kresoja K.-P. et al. Prediction and prognostic importance of in-hospital major bleeding in a real-world cohort of patients with pulmonary embolism. // Int. J. Cardiol. Elsevier, 2019. Vol. 290. P. 144–149.
- Klok F.A. et al. Prediction of bleeding events in patients with venous thromboembolism on stable anticoagulation treatment. // Eur. Respir. J. Eur Respiratory Soc, 2016. Vol. 48, № 5. P. 1369–1376.
- Klok F.A. et al. Predictive value of venous thromboembolism (VTE)-BLEED to predict major bleeding and other adverse events in a practice-based cohort of patients with VTE: results of the XALIA study. // Br. J. Haematol. Wiley Online Library, 2018. Vol. 183, № 3. P. 457–465.
- Ruíz-Giménez N. et al. Predictive variables for major bleeding events in patients presenting with documented acute venous thromboembolism. Findings from the RIETE Registry. // Thromb. Haemost. Schattauer GmbH, 2008. Vol. 100, № 1. P. 26–31.
- Palareti G. et al. The American College of Chest Physician score to assess the risk of bleeding during anticoagulation in patients with venous thromboembolism. // J. Thromb. Haemost. Wiley Online Library, 2018. Vol. 16, № 10. P. 1994–2002.
- Klarin D. et al. Genome-wide association analysis of venous thromboembolism identifies new risk loci and genetic overlap with arterial vascular disease. // Nat. Genet. Nature Publishing Group, 2019. Vol. 51, № 11. P. 1574–1579.
- Lindström S. et al. Genomic and transcriptomic association studies identify 16 novel susceptibility loci for venous thromboembolism. // Blood. American Society of Hematology, 2019. Vol. 134, № 19. P. 1645–1657.
- Stevens S.M. et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. // J. Thromb. Thrombolysis. Springer, 2016. Vol. 41, № 1. P. 154–164.
- Hirmerova J., Seidlerova J., Subrt I. The association of factor V Leiden with various clinical patterns of venous thromboembolism-the factor V Leiden paradox. // QJM. Oxford University Press, 2014. Vol. 107, № 9. P. 715–720.
- Poort S.R. et al. A common genetic variation in the 3’-untranslated region of the prothrombin gene is associated with elevated plasma prothrombin levels and an increase in venous thrombosis. // Blood. 1996. Vol. 88, № 10. P. 3698–3703.
- Emmerich J. et al. Combined effect of factor V Leiden and prothrombin 20210A on the risk of venous thromboembolism--pooled analysis of 8 case-control studies including 2310 cases and 3204 controls. Study Group for Pooled-Analysis in Venous Thromboembolism. // Thromb. Haemost. Schattauer GmbH, 2001. Vol. 86, № 3. P. 809–816.
- Wolberg A.S. Fibrinogen and factor XIII: Newly recognized roles in venous thrombus formation and composition // Current Opinion in Hematology. NIH Public Access, 2018. Vol. 25, № 5. P. 358–364.
- Ahmad A. et al. Risk prediction of recurrent venous thromboembolism: a multiple genetic risk model. // J. Thromb. Thrombolysis. Springer, 2019. Vol. 47, № 2. P. 216–226.
- Решетняк Т.М. Рекомендации по лечению антифосфолипидного синдрома // Москва. 2013.
- Tektonidou M.G. et al. EULAR recommendations for the management of antiphospholipid syndrome in adults. // Ann. Rheum. Dis. BMJ Publishing Group Ltd, 2019. Vol. 78, № 10. P. 1296–1304.
- Кулагин А.Д., Лисуков И.А., Птушкин В.В. Национальные клинические рекомендации по диагностике и лечению пароксизмальной ночной гемоглобинурии // Онкогематология. Общество с ограниченной ответственностью «Издательский дом «АБВ-пресс», 2014. № 2.
- NICE G. Venous thromboembolic diseases: diagnosis, management and thrombophilia testing. NICE London, 2015.
- Baglin T., Luddington R., Brown K. Incidence of recurrent venous thromboembolism in relation to clinical and thrombophilic risk factors: prospective cohort study // Lancet (London, England). Lancet, 2003. Vol. 362, № 9383. P. 523–526.
- Weingarz L. et al. Prevalence of thrombophilia according to age at the first manifestation of venous thromboembolism: results from the MAISTHRO registry. // Br. J. Haematol. Wiley Online Library, 2013. Vol. 163, № 5. P. 655–665.
- Chechulova A. V et al. Genetic Markers of Hereditary Thrombophilia and the Clinical Course for Venous Thromboembolism in Young Patients from the North-West of Russian Federation // Flebologiia. 2020. Vol. 14, № 1. P. 6.
- Coppens M., Reijnders J.H., Middeldorp S. Testing for inherited thrombophilia does not reduce the recurrence of venous thrombosis // J. Thromb. Haemost. Wiley Online Library, 2008. Vol. 6, № 9. P. 1474–1477.
- Connors J.M. Thrombophilia testing and venous thrombosis // N. Engl. J. Med. Mass Medical Soc, 2017. Vol. 377, № 12. P. 1177–1187.
- Garcia-Horton A. et al. Impact of thrombophilia screening on venous thromboembolism management practices. // Thromb. Res. Elsevier, 2017. Vol. 149. P. 76–80.
- Moll S. Thrombophilia: clinical-practical aspects. // J. Thromb. Thrombolysis. Springer, 2015. Vol. 39, № 3. P. 367–378.
- Ortel T.L. et al. Recurrent thrombosis in patients with antiphospholipid antibodies and an initial venous or arterial thromboembolic event: A systematic review and meta‐analysis // J. Thromb. Haemost. Wiley Online Library, 2020. Vol. 18, № 9. P. 2274–2286.
- Сомонова О.В., Антух Э.А., Елизарова А.Л. Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных // Злокачественные опухоли. Благотворительный фонд содействия профилактике, диагностике и лечению …, 2017. Vol. 7, № 3-S2. P. 553–558.
- Zhou M. et al. Extensive screening for occult malignancy in unprovoked venous thromboembolism: A meta-analysis. // Thromb. Res. Elsevier, 2017. Vol. 157. P. 147–153.
- Jara-Palomares L. et al. Development of a Risk Prediction Score for Occult Cancer in Patients With VTE. // Chest. Elsevier, 2017. Vol. 151, № 3. P. 564–571.
- Lyman G.H. et al. American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with cancer. // Blood Adv. American Society of Hematology Washington, DC, 2021. Vol. 5, № 4. P. 927–974.
- Klein A. et al. Screening for occult cancer in idiopathic venous thromboembolism - Systemic review and meta-analysis. // Eur. J. Intern. Med. Elsevier, 2017. Vol. 42. P. 74–80.
- Kleinjan A. et al. Limitations of screening for occult cancer in patients with idiopathic venous thromboembolism. // Neth. J. Med. 2012. Vol. 70, № 7. P. 311–317.
- Robertson L. et al. Effect of testing for cancer on cancer- or venous thromboembolism (VTE)-related mortality and morbidity in people with unprovoked VTE // Cochrane Database Syst. Rev. John Wiley & Sons, Ltd, 2021. Vol. 2021, № 10.
- Калинин Р.Е., Сучков И.А., Землянухин С.П. Идиопатический тромбоз глубоких вен: определение стратегии скрининга скрытого рака // Флебология. 2020. Vol. 14, № 2.
- Эрлих А.Д. et al. Тромбоэмболия легочных артерий у пациентов с онкологическими заболеваниями. Данные регистра СИРЕНА. // Флебология. 2021. Vol. 15, № 3.
- Ploton G. et al. A STROBE cohort study of 755 deep and superficial upper-extremity vein thrombosis. // Medicine (Baltimore). Wolters Kluwer Health, 2020. Vol. 99, № 6. P. e18996.
- Heil J. et al. Deep Vein Thrombosis of the Upper Extremity. // Dtsch. Arztebl. Int. Deutscher Arzte-Verlag GmbH, 2017. Vol. 114, № 14. P. 244–249.
- Major K.M. et al. Internal jugular, subclavian, and axillary deep venous thrombosis and the risk of pulmonary embolism. // Vascular. SAGE Publications Sage UK: London, England, 2008. Vol. 16, № 2. P. 73–79.
- Mustafa S. et al. Upper extremity deep venous thrombosis. // Chest. Elsevier, 2003. Vol. 123, № 6. P. 1953–1956.
- Joffe H. V, Goldhaber S.Z. Upper-extremity deep vein thrombosis. // Circulation. Am Heart Assoc, 2002. Vol. 106, № 14. P. 1874–1880.
- Sajid M.S. et al. Upper limb deep vein thrombosis: a literature review to streamline the protocol for management. // Acta Haematol. Karger Publishers, 2007. Vol. 118, № 1. P. 10–18.
- Grant J.D. et al. Diagnosis and management of upper extremity deep-vein thrombosis in adults. // Thromb. Haemost. Schattauer GmbH, 2012. Vol. 108, № 6. P. 1097–1108.
- Flinterman L.E. et al. Current perspective of venous thrombosis in the upper extremity. // J. Thromb. Haemost. Wiley Online Library, 2008. Vol. 6, № 8. P. 1262–1266.
- Martinelli I. et al. Risk factors and recurrence rate of primary deep vein thrombosis of the upper extremities. // Circulation. Am Heart Assoc, 2004. Vol. 110, № 5. P. 566–570.
- Hendler M.F. et al. Primary upper-extremity deep vein thrombosis: high prevalence of thrombophilic defects. // Am. J. Hematol. Wiley Online Library, 2004. Vol. 76, № 4. P. 330–337.
- Prandoni P. et al. Upper-extremity deep vein thrombosis. Risk factors, diagnosis, and complications. // Arch. Intern. Med. American Medical Association, 1997. Vol. 157, № 1. P. 57–62.
- Di Nisio M. et al. Accuracy of diagnostic tests for clinically suspected upper extremity deep vein thrombosis: a systematic review. // J. Thromb. Haemost. Wiley Online Library, 2010. Vol. 8, № 4. P. 684–692.
- Douma R.A. et al. Performance of 4 clinical decision rules in the diagnostic management of acute pulmonary embolism: a prospective cohort study. // Ann. Intern. Med. American College of Physicians, 2011. Vol. 154, № 11. P. 709–718.
- Wells P.S. et al. Excluding pulmonary embolism at the bedside without diagnostic imaging: management of patients with suspected pulmonary embolism presenting to the emergency department by using a simple clinical model and d-dimer. // Ann. Intern. Med. American College of Physicians, 2001. Vol. 135, № 2. P. 98–107.
- PIOPED Investigators. Value of the ventilation/perfusion scan in acute pulmonary embolism. Results of the prospective investigation of pulmonary embolism diagnosis (PIOPED). // JAMA. 1990. Vol. 263, № 20. P. 2753–2759.
- Lucassen W. et al. Clinical decision rules for excluding pulmonary embolism: a meta-analysis. // Ann. Intern. Med. American College of Physicians, 2011. Vol. 155, № 7. P. 448–460.
- van Belle A. et al. Effectiveness of managing suspected pulmonary embolism using an algorithm combining clinical probability, D-dimer testing, and computed tomography. // JAMA. 2006. Vol. 295, № 2. P. 172–179.
- Musset D. et al. Diagnostic strategy for patients with suspected pulmonary embolism: a prospective multicentre outcome study. // Lancet (London, England). Elsevier, 2002. Vol. 360, № 9349. P. 1914–1920.
- Perrier A. et al. Non-invasive diagnosis of venous thromboembolism in outpatients. // Lancet (London, England). Elsevier, 1999. Vol. 353, № 9148. P. 190–195.
- Sostman H.D. et al. Acute pulmonary embolism: sensitivity and specificity of ventilation-perfusion scintigraphy in PIOPED II study. // Radiology. Radiological Society of North America, 2008. Vol. 246, № 3. P. 941–946.
- Righini M. et al. Diagnosis of pulmonary embolism by multidetector CT alone or combined with venous ultrasonography of the leg: a randomised non-inferiority trial. // Lancet (London, England). Elsevier, 2008. Vol. 371, № 9621. P. 1343–1352.
- Anderson D.R. et al. Computed tomographic pulmonary angiography vs ventilation-perfusion lung scanning in patients with suspected pulmonary embolism: a randomized controlled trial. // JAMA. American Medical Association, 2007. Vol. 298, № 23. P. 2743–2753.
- Perrier A. et al. Diagnosing pulmonary embolism in outpatients with clinical assessment, D-dimer measurement, venous ultrasound, and helical computed tomography: a multicenter management study. // Am. J. Med. Elsevier, 2004. Vol. 116, № 5. P. 291–299.
- Di Nisio M. et al. Diagnostic accuracy of D-dimer test for exclusion of venous thromboembolism: a systematic review. // J. Thromb. Haemost. Wiley Online Library, 2007. Vol. 5, № 2. P. 296–304.
- Stein P.D. et al. D-dimer for the exclusion of acute venous thrombosis and pulmonary embolism: a systematic review. // Ann. Intern. Med. American College of Physicians, 2004. Vol. 140, № 8. P. 589–602.
- Ceriani E. et al. Clinical prediction rules for pulmonary embolism: a systematic review and meta-analysis // J. Thromb. Haemost. Wiley Online Library, 2010. Vol. 8, № 5. P. 957–970.
- Patel S., Kazerooni E.A., Cascade P.N. Pulmonary embolism: optimization of small pulmonary artery visualization at multi-detector row CT. // Radiology. Radiological Society of North America, 2003. Vol. 227, № 2. P. 455–460.
- Ghaye B. et al. Peripheral pulmonary arteries: how far in the lung does multi-detector row spiral CT allow analysis? // Radiology. Radiological Society of North America, 2001. Vol. 219, № 3. P. 629–636.
- Carrier M. et al. Subsegmental pulmonary embolism diagnosed by computed tomography: incidence and clinical implications. A systematic review and meta-analysis of the management outcome studies. // J. Thromb. Haemost. Wiley Online Library, 2010. Vol. 8, № 8. P. 1716–1722.
- Patel P. et al. Systematic review and meta-analysis of test accuracy for the diagnosis of suspected pulmonary embolism // Blood Adv. American Society of Hematology Washington, DC, 2020. Vol. 4, № 18. P. 4296–4311.
- Qanadli S.D. et al. Pulmonary embolism detection: prospective evaluation of dual-section helical CT versus selective pulmonary arteriography in 157 patients. // Radiology. Radiological Society of North America, 2000. Vol. 217, № 2. P. 447–455.
- Stein P.D. et al. Complications and validity of pulmonary angiography in acute pulmonary embolism. // Circulation. Am Heart Assoc, 1992. Vol. 85, № 2. P. 462–468.
- Engelberger R.P., Kucher N. Catheter-based reperfusion treatment of pulmonary embolism. // Circulation. Am Heart Assoc, 2011. Vol. 124, № 19. P. 2139–2144.
- Reid J.H. et al. Is the lung scan alive and well? Facts and controversies in defining the role of lung scintigraphy for the diagnosis of pulmonary embolism in the era of MDCT. // Eur. J. Nucl. Med. Mol. Imaging. Springer, 2009. Vol. 36, № 3. P. 505–521.
- Roy P.-M. et al. Systematic review and meta-analysis of strategies for the diagnosis of suspected pulmonary embolism. // BMJ. British Medical Journal Publishing Group, 2005. Vol. 331, № 7511. P. 259.
- van Es J. et al. Accuracy of X-ray with perfusion scan in young patients with suspected pulmonary embolism. // Thromb. Res. Elsevier, 2015. Vol. 136, № 2. P. 221–224.
- Kucher N. et al. Novel management strategy for patients with suspected pulmonary embolism. // Eur. Heart J. Oxford University Press, 2003. Vol. 24, № 4. P. 366–376.
- Elliott C.G. et al. Chest radiographs in acute pulmonary embolism. Results from the International Cooperative Pulmonary Embolism Registry. // Chest. Elsevier, 2000. Vol. 118, № 1. P. 33–38.
- Shopp J.D. et al. Findings From 12-lead Electrocardiography That Predict Circulatory Shock From Pulmonary Embolism: Systematic Review and Meta-analysis. // Acad. Emerg. Med. Wiley Online Library, 2015. Vol. 22, № 10. P. 1127–1137.
- Revel M.P. et al. Diagnostic accuracy of magnetic resonance imaging for an acute pulmonary embolism: results of the “IRM-EP” study. // J. Thromb. Haemost. Wiley Online Library, 2012. Vol. 10, № 5. P. 743–750.
- Stein P.D. et al. Gadolinium-enhanced magnetic resonance angiography for pulmonary embolism: a multicenter prospective study (PIOPED III). // Ann. Intern. Med. American College of Physicians, 2010. Vol. 152, № 7. P. 434–443, W142-3.
- Trujillo-Santos J. et al. A prognostic score to identify low-risk outpatients with acute deep vein thrombosis in the lower limbs. // Am. J. Med. Elsevier, 2015. Vol. 128, № 1. P. 90.e9-15.
- Othieno R., Okpo E., Forster R. Home versus in-patient treatment for deep vein thrombosis. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2018. Vol. 1, № 1. P. CD003076.
- Lozano F. et al. Home versus in-hospital treatment of outpatients with acute deep venous thrombosis of the lower limbs. // J. Vasc. Surg. Elsevier, 2014. Vol. 59, № 5. P. 1362-7.e1.
- Лобастов К.В., Воронцова А.В., Барганджия А.Б. Амбулаторное лечение тромбоза глубоких вен ривароксабаном: опыт работы в одном центре // Флебология. 2020. Vol. 14, № 2. P. 99–106.
- Barco S. et al. Early discharge and home treatment of patients with low-risk pulmonary embolism with the oral factor Xa inhibitor rivaroxaban: an international multicentre single-arm clinical trial. // Eur. Heart J. Oxford University Press, 2020. Vol. 41, № 4. P. 509–518.
- Broderick C., Watson L., Armon M.P. Thrombolytic strategies versus standard anticoagulation for acute deep vein thrombosis of the lower limb. // Cochrane database Syst. Rev. Cochrane Database Syst Rev, 2021. Vol. 1, № 1. P. CD002783.
- Lu Y. et al. Catheter-Directed Thrombolysis Versus Standard Anticoagulation for Acute Lower Extremity Deep Vein Thrombosis: A Meta-Analysis of Clinical Trials. // Clin. Appl. Thromb. Hemost. SAGE Publications Sage CA: Los Angeles, CA, 2018. Vol. 24, № 7. P. 1134–1143.
- Foegh P. et al. Editor’s Choice - Factors Associated with Long-Term Outcome in 191 Patients with Ilio-Femoral DVT Treated With Catheter-Directed Thrombolysis. // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2017. Vol. 53, № 3. P. 419–424.
- Безлепкин Ю.А. et al. Сравнение отдаленных результатов регионарного катетерного тромболизиса и стандартного консервативного лечения при проксимальных тромбозах глубоких вен нижних конечностей // Флебология. 2020. Vol. 14, № 1.
- Razavi M.K. et al. Correlation between Post-Procedure Residual Thrombus and Clinical Outcome in Deep Vein Thrombosis Patients Receiving Pharmacomechanical Thrombolysis in a Multicenter Randomized Trial. // J. Vasc. Interv. Radiol. Elsevier, 2020. Vol. 31, № 10. P. 1517-1528.e2.
- Huang C., Zhang W., Liang H. A retrospective comparison of thrombectomy followed by stenting and thrombectomy alone for the management of deep vein thrombosis with May-Thurner syndrome. // J. Vasc. surgery. Venous Lymphat. Disord. Elsevier, 2021. Vol. 9, № 3. P. 635–642.
- Лобастов К.В. et al. Диагностика и лечение хронической венозной обструкции: согласованное мнение российских экспертов (часть 2) // Хирург. Общество с ограниченной ответственностью Издательский дом Панорама, 2020. № 7–8. P. 22–55.
- Comerota A.J. et al. Endovascular Thrombus Removal for Acute Iliofemoral Deep Vein Thrombosis. // Circulation. Am Heart Assoc, 2019. Vol. 139, № 9. P. 1162–1173.
- Kearon C. et al. Pharmacomechanical Catheter-Directed Thrombolysis in Acute Femoral–Popliteal Deep Vein Thrombosis: Analysis from a Stratified Randomized Trial // Thromb. Haemost. Georg Thieme Verlag KG, 2019. Vol. 119, № 04. P. 633–644.
- Notten P., Ten Cate H., Ten Cate-Hoek A.J. Postinterventional antithrombotic management after venous stenting of the iliofemoral tract in acute and chronic thrombosis: A systematic review. // J. Thromb. Haemost. Wiley Online Library, 2021. Vol. 19, № 3. P. 753–796.
- Sebastian T. et al. Cessation of anticoagulation therapy following endovascular thrombus removal and stent placement for acute iliofemoral deep vein thrombosis. // Vasa. Hogrefe AG, 2019. Vol. 48, № 4. P. 331–339.
- Limone B.L. et al. Timing of recurrent venous thromboembolism early after the index event: a meta-analysis of randomized controlled trials. // Thromb. Res. Elsevier, 2013. Vol. 132, № 4. P. 420–426.
- Kearon C. et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. // Chest. Elsevier, 2016. Vol. 149, № 2. P. 315–352.
- Kearon C., Kahn S.R. Long-term treatment of venous thromboembolism. // Blood. American Society of Hematology Washington, DC, 2020. Vol. 135, № 5. P. 317–325.
- Heit J.A. et al. Predictors of venous thromboembolism recurrence, adjusted for treatments and interim exposures: a population-based case-cohort study. // Thromb. Res. Elsevier, 2015. Vol. 136, № 2. P. 298–307.
- Douketis J. et al. Patient-level meta-analysis: effect of measurement timing, threshold, and patient age on ability of D-dimer testing to assess recurrence risk after unprovoked venous thromboembolism. // Ann. Intern. Med. American College of Physicians, 2010. Vol. 153, № 8. P. 523–531.
- Kearon C. et al. D-dimer testing to select patients with a first unprovoked venous thromboembolism who can stop anticoagulant therapy: a cohort study. // Ann. Intern. Med. American College of Physicians, 2015. Vol. 162, № 1. P. 27–34.
- Donadini M.P. et al. Prognostic significance of residual venous obstruction in patients with treated unprovoked deep vein thrombosis: a patient-level meta-analysis. // Thromb. Haemost. Schattauer GmbH, 2014. Vol. 111, № 1. P. 172–179.
- Prandoni P. et al. Residual venous thrombosis as a predictive factor of recurrent venous thromboembolism. // Ann. Intern. Med. American College of Physicians, 2002. Vol. 137, № 12. P. 955–960.
- Prandoni P. et al. Recanalization rate in patients with proximal vein thrombosis treated with the direct oral anticoagulants. // Thromb. Res. Elsevier, 2017. Vol. 153. P. 97–100.
- Siragusa S. et al. Residual vein thrombosis to establish duration of anticoagulation after a first episode of deep vein thrombosis: the Duration of Anticoagulation based on Compression UltraSonography (DACUS) study. // Blood. American Society of Hematology Washington, DC, 2008. Vol. 112, № 3. P. 511–515.
- Lobastov K. et al. Electrical calf muscle stimulation in patients with post-thrombotic syndrome and residual venous obstruction after anticoagulation therapy. // Int. Angiol. 2018. Vol. 37, № 5. P. 400–410.
- Zhu T., Martinez I., Emmerich J. Venous thromboembolism: Risk factors for recurrence // Arterioscler. Thromb. Vasc. Biol. Am Heart Assoc, 2009. Vol. 29, № 3. P. 298–310.
- Palareti G. Recurrent venous thromboembolism: what is the risk and how to prevent it. // Scientifica (Cairo). 2012. Vol. 2012. P. 391734.
- Ho W.K. et al. Risk of recurrent venous thromboembolism in patients with common thrombophilia: a systematic review. // Arch. Intern. Med. American Medical Association, 2006. Vol. 166, № 7. P. 729–736.
- Áinle F.N., Kevane B. Which patients are at high risk of recurrent venous thromboembolism (deep vein thrombosis and pulmonary embolism)? // Blood Adv. American Society of Hematology Washington, DC, 2020. Vol. 4, № 21. P. 5595–5606.
- Mannucci P.M., Franchini M. Classic thrombophilic gene variants. // Thromb. Haemost. Schattauer GmbH, 2015. Vol. 114, № 5. P. 885–889.
- Croles F.N. et al. Pregnancy, thrombophilia, and the risk of a first venous thrombosis: systematic review and bayesian meta-analysis // BMJ. British Medical Journal Publishing Group, 2017. Vol. 359. P. j4452.
- van Vlijmen E.F.W. et al. Combined oral contraceptives, thrombophilia and the risk of venous thromboembolism: a systematic review and meta-analysis. // J. Thromb. Haemost. Wiley Online Library, 2016. Vol. 14, № 7. P. 1393–1403.
- Campello E. et al. Thrombophilia, risk factors and prevention. // Expert Rev. Hematol. Taylor & Francis, 2019. Vol. 12, № 3. P. 147–158.
- Marcucci M. et al. Risk of recurrence after a first unprovoked venous thromboembolism: external validation of the Vienna Prediction Model with pooled individual patient data. // J. Thromb. Haemost. Wiley Online Library, 2015. Vol. 13, № 5. P. 775–781.
- Klok F.A., Huisman M. V. How I assess and manage the risk of bleeding in patients treated for venous thromboembolism. // Blood. American Society of Hematology Washington, DC, 2020. Vol. 135, № 10. P. 724–734.
- Marques Antunes M. et al. The high-risk bleeding category of different scores in patients with venous thromboembolism: Systematic review and meta-analysis. // Eur. J. Intern. Med. Elsevier, 2021. Vol. 94. P. 45–55.
- Hindricks G. et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the Europea // Eur. Heart J. Oxford University Press, 2021. Vol. 42, № 5. P. 373–498.
- Steffel J., Heidbüchel H. 2021 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation: comment—Authors’ reply // EP Eur. 2021. Vol. 23, № 10. P. 1685–1686.
- Schulman S. et al. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in surgical patients. // J. Thromb. Haemost. Wiley Online Library, 2010. Vol. 8, № 1. P. 202–204.
- Schulman S., Kearon C., Subcommittee on Control of Anticoagulation of the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. // J. Thromb. Haemost. 2005. Vol. 3, № 4. P. 692–694.
- Kaatz S. et al. Definition of clinically relevant non-major bleeding in studies of anticoagulants in atrial fibrillation and venous thromboembolic disease in non-surgical patients: communication from the SSC of the ISTH. // J. Thromb. Haemost. 2015. Vol. 13, № 11. P. 2119–2126.
- Boutitie F. et al. Influence of preceding length of anticoagulant treatment and initial presentation of venous thromboembolism on risk of recurrence after stopping treatment: analysis of individual participants’ data from seven trials. // BMJ. British Medical Journal Publishing Group, 2011. Vol. 342, № may24 2. P. d3036.
- Nieto J.A. et al. Thirty-day outcomes in patients with proximal deep vein thrombosis who discontinued anticoagulant therapy prematurely. // Thromb. Res. Elsevier, 2020. Vol. 189. P. 61–68.
- Middeldorp S., Prins M.H., Hutten B.A. Duration of treatment with vitamin K antagonists in symptomatic venous thromboembolism. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2014. Vol. 2014, № 8. P. CD001367.
- Punthakee X., Doobay J., Anand S.S. Oral-anticoagulant-related intracerebral hemorrhage. // Thromb. Res. Elsevier, 2002. Vol. 108, № 1. P. 31–36.
- Linkins L.-A., Choi P.T., Douketis J.D. Clinical impact of bleeding in patients taking oral anticoagulant therapy for venous thromboembolism: a meta-analysis. // Ann. Intern. Med. 2003. Vol. 139, № 11. P. 893–900.
- Carrier M. et al. Systematic review: case-fatality rates of recurrent venous thromboembolism and major bleeding events among patients treated for venous thromboembolism. // Ann. Intern. Med. American College of Physicians, 2010. Vol. 152, № 9. P. 578–589.
- Ebraheem M. et al. Extended DOAC therapy in patients with VTE and potential risk of recurrence: A systematic review and meta-analysis. // J. Thromb. Haemost. Wiley Online Library, 2020. Vol. 18, № 9. P. 2308–2317.
- Петриков А.С. et al. Прогресс реканализации глубоких вен нижних конечностей на фоне пролонгированной антитромботической терапии и содержание D-димеров, C-реактивного белка и гомоцистеина. // Флебология. 2020. Vol. 14, № 3.
- Agnelli G. et al. Apixaban for extended treatment of venous thromboembolism. // N. Engl. J. Med. Mass Medical Soc, 2013. Vol. 368, № 8. P. 699–708.
- Weitz J.I. et al. Rivaroxaban or Aspirin for Extended Treatment of Venous Thromboembolism. // N. Engl. J. Med. Mass Medical Soc, 2017. Vol. 376, № 13. P. 1211–1222.
- Brighton T.A. et al. Low-dose aspirin for preventing recurrent venous thromboembolism. // N. Engl. J. Med. Mass Medical Soc, 2012. Vol. 367, № 21. P. 1979–1987.
- Becattini C. et al. Aspirin for preventing the recurrence of venous thromboembolism. // N. Engl. J. Med. Mass Medical Soc, 2012. Vol. 366, № 21. P. 1959–1967.
- Simes J. et al. Aspirin for the prevention of recurrent venous thromboembolism: the INSPIRE collaboration. // Circulation. 2014. Vol. 130, № 13. P. 1062–1071.
- Королева В. et al. Место ривароксабана в лечении и продленной профилактике рецидивов ВТЭО у пациентов с тромбоэмболией легочных артерий. // Флебология. 2021. Vol. 15, № 3.
- Mai V. et al. Extended anticoagulation for the secondary prevention of venous thromboembolic events: An updated network meta-analysis. // PLoS One / ed. Dias S. Public Library of Science San Francisco, CA USA, 2019. Vol. 14, № 4. P. e0214134.
- Jiang Q.-J. et al. Sulodexide for Secondary Prevention of Recurrent Venous Thromboembolism: A Systematic Review and Meta-Analysis. // Front. Pharmacol. Frontiers, 2018. Vol. 9. P. 876.
- Franco L. et al. Anticoagulation in patients with isolated distal deep vein thrombosis: a meta-analysis. // J. Thromb. Haemost. Wiley Online Library, 2017. Vol. 15, № 6. P. 1142–1154.
- Bradbury C. et al. A randomised controlled trial of extended anticoagulation treatment versus standard treatment for the prevention of recurrent venous thromboembolism (VTE) and post-thrombotic syndrome in patients being treated for a first episode of unprovoked VTE (the Ex // Br. J. Haematol. Wiley Online Library, 2020. Vol. 188, № 6. P. 962–975.
- Aziz D. et al. Long‐term risk of recurrent venous thromboembolism after a first contraceptive‐related event: Data from REVERSE cohort study // J. Thromb. Haemost. Wiley Online Library, 2021. Vol. 19, № 6. P. 1526–1532.
- White R.H., Murin S., Wun T. Recurrent venous thromboembolism after surgery-provoked versus unprovoked thromboembolism // J. Thromb. Haemost. Schattauer GmbH, 2010. Vol. 8, № 5. P. 987–997.
- Le Gal G. et al. Risk of recurrent venous thromboembolism after a first oestrogen-associated episode. Data from the REVERSE cohort study. // Thromb. Haemost. Schattauer GmbH, 2010. Vol. 104, № 3. P. 498–503.
- Vaillant-Roussel H. et al. Risk factors for recurrence of venous thromboembolism associated with the use of oral contraceptives. // Contraception. Elsevier, 2011. Vol. 84, № 5. P. e23-30.
- Martinelli I., Lensing A.W.A., Middeldorp S. Recurrent venous thromboembolism and abnormal uterine bleeding with anticoagulant and hormone therapy use // Blood. American Society of Hematology Washington, DC, 2016. Vol. 127, № 11. P. 1417–1425.
- Ageno W. et al. Provoked versus unprovoked venous thromboembolism: Findings from GARFIELD-VTE. // Res. Pract. Thromb. Haemost. Wiley Online Library, 2021. Vol. 5, № 2. P. 326–341.
- Djulbegovic M., Lee A.I., Chen K. Which patients with unprovoked venous thromboembolism should receive extended anticoagulation with direct oral anticoagulants? A systematic review, network meta‐analysis, and decision analysis // J. Eval. Clin. Pract. Wiley Online Library, 2020. Vol. 26, № 1. P. 7–17.
- Kahn S.R.S., Julian J.J.A., Kearon C. Quality of life after pharmacomechanical catheter-directed thrombolysis for proximal deep venous thrombosis // J. Vasc. Surg. Venous Lymphat. Disord. Elsevier, 2020. Vol. 8, № 1. P. 8–23.
- Robertson L., Yeoh S.E., Ramli A. Secondary prevention of recurrent venous thromboembolism after initial oral anticoagulation therapy in patients with unprovoked venous thromboembolism. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2017. Vol. 12, № 12. P. CD011088.
- Schulman S. et al. The duration of oral anticoagulant therapy after a second episode of venous thromboembolism. The Duration of Anticoagulation Trial Study Group. // N. Engl. J. Med. Mass Medical Soc, 1997. Vol. 336, № 6. P. 393–398.
- Kahale L.A. et al. Anticoagulation for the long-term treatment of venous thromboembolism in people with cancer. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2018. Vol. 6, № 6. P. CD006650.
- Marshall A. et al. Treatment of cancer-associated venous thromboembolism: 12-month outcomes of the placebo versus rivaroxaban randomization of the SELECT-D Trial (SELECT-D: 12m). // J. Thromb. Haemost. Wiley Online Library, 2020. Vol. 18, № 4. P. 905–915.
- Dufrost V., Wahl D., Zuily S. Direct oral anticoagulants in antiphospholipid syndrome: Meta-analysis of randomized controlled trials. // Autoimmun. Rev. Elsevier, 2021. Vol. 20, № 1. P. 102711.
- Schulman S., Svenungsson E., Granqvist S. Anticardiolipin antibodies predict early recurrence of thromboembolism and death among patients with venous thromboembolism following anticoagulant therapy. Duration of Anticoagulation Study Group. // Am. J. Med. Elsevier, 1998. Vol. 104, № 4. P. 332–338.
- Kirkilesis G. et al. Treatment of distal deep vein thrombosis. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2020. Vol. 4, № 4. P. CD013422.
- Hokusai-VTE Investigators et al. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism. // N. Engl. J. Med. Mass Medical Soc, 2013. Vol. 369, № 15. P. 1406–1415.
- Pesavento R. et al. Fondaparinux in the initial and long-term treatment of venous thromboembolism // Thromb. Res. Elsevier, 2015. Vol. 135, № 2. P. 311–317.
- Cohen A.T. et al. Comparison of the Novel Oral Anticoagulants Apixaban, Dabigatran, Edoxaban, and Rivaroxaban in the Initial and Long-Term Treatment and Prevention of Venous Thromboembolism: Systematic Review and Network Meta-Analysis. // PLoS One. Public Library of Science San Francisco, CA USA, 2015. Vol. 10, № 12. P. e0144856.
- Agnelli G. et al. Oral apixaban for the treatment of acute venous thromboembolism. // N. Engl. J. Med. Mass Medical Soc, 2013. Vol. 369, № 9. P. 799–808.
- EINSTEIN Investigators et al. Oral rivaroxaban for symptomatic venous thromboembolism. // N. Engl. J. Med. Mass Medical Soc, 2010. Vol. 363, № 26. P. 2499–2510.
- EINSTEIN–PE Investigators et al. Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. // N. Engl. J. Med. Mass Medical Soc, 2012. Vol. 366, № 14. P. 1287–1297.
- Schulman S. et al. Treatment of acute venous thromboembolism with dabigatran or warfarin and pooled analysis. // Circulation. Am Heart Assoc, 2014. Vol. 129, № 7. P. 764–772.
- Amin A. et al. Evaluation of medical costs associated with use of new oral anticoagulants compared with standard therapy among venous thromboembolism patients // J. Med. Econ. Taylor & Francis, 2014. Vol. 17, № 11. P. 763–770.
- Law S. et al. A pharmacoeconomic study of traditional anticoagulation versus direct oral anticoagulation for the treatment of venous thromboembolism in the emergency department. // CJEM. Cambridge University Press, 2016. Vol. 18, № 5. P. 340–348.
- Amin A. et al. Real-World Medical Cost Avoidance When New Oral Anticoagulants are Used Versus Warfarin for Venous Thromboembolism in the United States // Clin. Appl. Thromb. SAGE Publications Sage CA: Los Angeles, CA, 2016. Vol. 22, № 1. P. 5–11.
- Millar C.M., Laffan M.A. Drug therapy in anticoagulation: which drug for which patient? // Clin. Med. Royal College of Physicians, 2017. Vol. 17, № 3. P. 233–244.
- Smith S.B. et al. Early anticoagulation is associated with reduced mortality for acute pulmonary embolism. // Chest. Elsevier, 2010. Vol. 137, № 6. P. 1382–1390.
- Quinlan D.J., McQuillan A., Eikelboom J.W. Low-molecular-weight heparin compared with intravenous unfractionated heparin for treatment of pulmonary embolism: a meta-analysis of randomized, controlled trials. // Ann. Intern. Med. American College of Physicians, 2004. Vol. 140, № 3. P. 175–183.
- Robertson L., Jones L.E. Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for the initial treatment of venous thromboembolism. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2017. Vol. 2, № 2. P. CD001100.
- Robertson L., Strachan J. Subcutaneous unfractionated heparin for the initial treatment of venous thromboembolism. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2017. Vol. 2, № 2. P. CD006771.
- Cossette B., Pelletier M.-È., Carrier N. Evaluation of bleeding risk in patients exposed to therapeutic unfractionated or low-molecular weight heparin: a cohort study in the context of a quality improvement initiative // Ann. Pharmacother. SAGE Publications Sage CA: Los Angeles, CA, 2010. Vol. 44, № 6. P. 994–1002.
- Prandoni P. et al. The incidence of heparin-induced thrombocytopenia in medical patients treated with low-molecular-weight heparin: a prospective cohort study. // Blood. American Society of Hematology, 2005. Vol. 106, № 9. P. 3049–3054.
- Meyer G. et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism. // N. Engl. J. Med. Mass Medical Soc, 2014. Vol. 370, № 15. P. 1402–1411.
- Vedantham S. et al. Quality improvement guidelines for the treatment of lower-extremity deep vein thrombosis with use of endovascular thrombus removal. // J. Vasc. Interv. Radiol. Elsevier Inc., 2014. Vol. 25, № 9. P. 1317–1325.
- Graif A. et al. Safety of Therapeutic Anticoagulation with Low-Molecular-Weight Heparin or Unfractionated Heparin Infusion during Catheter-Directed Thrombolysis for Acute Pulmonary Embolism. // J. Vasc. Interv. Radiol. Elsevier, 2020. Vol. 31, № 4. P. 537–543.
- Li Y., Wang J., He R. Feasibility of anticoagulation using low molecular-weight heparin during catheter-directed thrombolysis for lower extremity deep venous thrombosis // Thromb. J. Springer, 2021. Vol. 19, № 1. P. 1–7.
- Hull R.D. et al. Relation between the time to achieve the lower limit of the APTT therapeutic range and recurrent venous thromboembolism during heparin treatment for deep vein thrombosis. // Arch. Intern. Med. American Medical Association, 1997. Vol. 157, № 22. P. 2562–2568.
- Büller H.R. et al. Fondaparinux or enoxaparin for the initial treatment of symptomatic deep venous thrombosis: a randomized trial. // Ann. Intern. Med. American College of Physicians, 2004. Vol. 140, № 11. P. 867–873.
- Warkentin T.E., Maurer B.T., Aster R.H. Heparin-Induced Thrombocytopenia associated with fondaparinux // N. Engl. J. Med. 2007. Vol. 356, № 25. P. 2653–2655.
- Konstantinides S. V et al. 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism: The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) // Eur. Heart J. Oxford University Press, 2014. Vol. 35, № 43. P. 3033–3080.
- Barginear M.F. et al. Investigating the benefit of adding a vena cava filter to anticoagulation with fondaparinux sodium in patients with cancer and venous thromboembolism in a prospective randomized clinical trial. // Support. Care Cancer. Springer, 2012. Vol. 20, № 11. P. 2865–2872.
- Bhatt V.R. et al. Fondaparinux-associated heparin-induced thrombocytopenia. // Eur. J. Haematol. Wiley Online Library, 2013. Vol. 91, № 5. P. 437–441.
- Savi P. et al. Effect of fondaparinux on platelet activation in the presence of heparin-dependent antibodies: a blinded comparative multicenter study with unfractionated heparin. // Blood. American Society of Hematology, 2005. Vol. 105, № 1. P. 139–144.
- Warkentin T.E. et al. Fondaparinux treatment of acute heparin-induced thrombocytopenia confirmed by the serotonin-release assay: a 30-month, 16-patient case series. // J. Thromb. Haemost. Wiley Online Library, 2011. Vol. 9, № 12. P. 2389–2396.
- Schindewolf M. et al. Frequent off-label use of fondaparinux in patients with suspected acute heparin-induced thrombocytopenia (HIT)--findings from the GerHIT multi-centre registry study. // Thromb. Res. Elsevier, 2014. Vol. 134, № 1. P. 29–35.
- Kang M. et al. Fondaparinux for the treatment of suspected heparin-induced thrombocytopenia: a propensity score-matched study. // Blood. American Society of Hematology Washington, DC, 2015. Vol. 125, № 6. P. 924–929.
- Lobo B. et al. Fondaparinux for the treatment of patients with acute heparin-induced thrombocytopenia. // Thromb. Haemost. Schattauer GmbH, 2008. Vol. 99, № 1. P. 208–214.
- Benken S.T. et al. A retrospective evaluation of fondaparinux for confirmed or suspected heparin-induced thrombocytopenia in left-ventricular-assist device patients. // J. Cardiothorac. Surg. BioMed Central, 2014. Vol. 9, № 1. P. 55.
- Cegarra-Sanmartín V. et al. Fondaparinux as a safe alternative for managing heparin-induced thrombocytopenia in postoperative cardiac surgery patients. // J. Cardiothorac. Vasc. Anesth. Elsevier, 2014. Vol. 28, № 4. P. 1008–1012.
- Posters Abstracts // Res. Pract. Thromb. Haemost. 2020. Vol. 4, № S1. P. 1–1311.
- Воробьева Н.А., Воробьева А.И., Шемякина Н.Я. Пациент-ориентированный подход как основа повышения эффективности и безопасности антитромботической терапии у коморбидных пациентов. Роль антикоагулянтных кабинетов // Клиническая геронтология. Общество с ограниченной ответственностью «Медико-технологическое предприятие …, 2019. Vol. 25, № 11–12.
- Liu M., Zhang F. Administration routes affect thrombolytic effect of catheter-directed thrombolysis with pro-urokinase in treating deep vein thrombosis. // Ann. Transl. Med. AME Publications, 2018. Vol. 6, № 16. P. 322.
- Kearon C. et al. A comparison of three months of anticoagulation with extended anticoagulation for a first episode of idiopathic venous thromboembolism. // N. Engl. J. Med. Mass Medical Soc, 1999. Vol. 340, № 12. P. 901–907.
- Ridker P.M. et al. Long-term, low-intensity warfarin therapy for the prevention of recurrent venous thromboembolism. // N. Engl. J. Med. Mass Medical Soc, 2003. Vol. 348, № 15. P. 1425–1434.
- Raskob G. et al. Extended duration of anticoagulation with edoxaban in patients with venous thromboembolism: a post-hoc analysis of the Hokusai-VTE study. // Lancet. Haematol. Elsevier, 2016. Vol. 3, № 5. P. e228-36.
- Schulman S. et al. Extended use of dabigatran, warfarin, or placebo in venous thromboembolism. // N. Engl. J. Med. Mass Medical Soc, 2013. Vol. 368, № 8. P. 709–718.
- Andreozzi G.M. et al. Sulodexide for the Prevention of Recurrent Venous Thromboembolism // Circulation. Am Heart Assoc, 2015. Vol. 132, № 20. P. 1891–1897.
- Andras A., Sala Tenna A., Stewart M. Vitamin K antagonists versus low-molecular-weight heparin for the long term treatment of symptomatic venous thromboembolism // Cochrane Database Syst. Rev. John Wiley & Sons, Ltd, 2017. Vol. 2017, № 7. P. CD002001.
- Iorio A., Guercini F., Pini M. Low-molecular-weight heparin for the long-term treatment of symptomatic venous thromboembolism: meta-analysis of the randomized comparisons with oral anticoagulants. // J. Thromb. Haemost. Wiley Online Library, 2003. Vol. 1, № 9. P. 1906–1913.
- Hull R.D., Liang J., Townshend G. Long-term low-molecular-weight heparin and the post-thrombotic syndrome: a systematic review. // Am. J. Med. Elsevier, 2011. Vol. 124, № 8. P. 756–765.
- Wawrzyńska L. et al. Changes in bone density during long-term administration of low-molecular-weight heparins or acenocoumarol for secondary prophylaxis of venous thromboembolism. // Pathophysiol. Haemost. Thromb. Karger Publishers, 2003. Vol. 33, № 2. P. 64–67.
- Linkins L.-A. et al. Treatment and prevention of heparin-induced thrombocytopenia: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. // Chest. Elsevier, 2012. Vol. 141, № 2 Suppl. P. e495S-e530S.
- Pompilio G. et al. Comparative Efficacy and Safety of Sulodexide and Other Extended Anticoagulation Treatments for Prevention of Recurrent Venous Thromboembolism: A Bayesian Network Meta-analysis // TH Open. Georg Thieme Verlag KG, 2020. Vol. 04, № 02. P. e80–e93.
- Савельев В.С., Гологорский В.А., Кириенко А.И. Флебология. 2001.
- Gloviczki P. Handbook of venous and lymphatic disorders: guidelines of the American Venous Forum. CRC Press, 2017.
- Kearon C. et al. Noninvasive diagnosis of deep venous thrombosis. McMaster Diagnostic Imaging Practice Guidelines Initiative. // Ann. Intern. Med. American College of Physicians, 1998. Vol. 128, № 8. P. 663–677.
- Messina L.M. et al. Clinical significance of routine imaging of iliac and calf veins by color flow duplex scanning in patients suspected of having acute lower extremity deep venous thrombosis. // Surgery. 1993. Vol. 114, № 5. P. 921–927.
- Sampson F., Goodacre S., Thomas S. The accuracy of MRI in diagnosis of suspected deep vein thrombosis: systematic review and meta-analysis // Eur. Radiol. Eur Radiol, 2007. Vol. 17, № 1. P. 175–181.
- Thomas S., Goodacre S., Sampson F. Diagnostic value of CT for deep vein thrombosis: results of a systematic review and meta-analysis // Clin. Radiol. Clin Radiol, 2008. Vol. 63, № 3. P. 299–304.
- AbuRahma A.F.A. et al. Iliofemoral deep vein thrombosis: conventional therapy versus lysis and percutaneous transluminal angioplasty and stenting // Ann. Surg. Lippincott, Williams, and Wilkins, 2001. Vol. 233, № 6. P. 752.
- Baekgaard N. et al. Long-term results using catheter-directed thrombolysis in 103 lower limbs with acute iliofemoral venous thrombosis. // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2010. Vol. 39, № 1. P. 112–117.
- Notten P. et al. Ultrasound-accelerated catheter-directed thrombolysis versus anticoagulation for the prevention of post-thrombotic syndrome (CAVA): a single-blind, multicentre, randomised trial. // Lancet. Haematol. 2020. Vol. 7, № 1. P. e40–e49.
- Enden T., Haig Y., Kløw N.N.-E. Long-term outcome after additional catheter-directed thrombolysis versus standard treatment for acute iliofemoral deep vein thrombosis (the CaVenT study): a randomised controlled trial // Lancet (London, England). Lancet, 2012. Vol. 379, № 9810. P. 31–38.
- Sharifi M., Bay C., Mehdipour M. Thrombus Obliteration by Rapid Percutaneous Endovenous Intervention in Deep Venous Occlusion (TORPEDO) trial: midterm results // J. Endovasc. Ther. J Endovasc Ther, 2012. Vol. 19, № 2. P. 273–280.
- Vedantham S., Goldhaber S.S.Z., Julian J.J.A. Pharmacomechanical catheter-directed thrombolysis for deep-vein thrombosis // N. Engl. J. Med. Mass Medical Soc, 2017. Vol. 377, № 23. P. 2240–2252.
- Sharifi M., Mehdipour M., Bay, CSmith G. Endovenous therapy for deep venous thrombosis: the TORPEDO trial // Catheter. Cardiovasc. Interv. Catheter Cardiovasc Interv, 2010. Vol. 76, № 3. P. 316–325.
- Protack C.D. et al. Long-term outcomes of catheter directed thrombolysis for lower extremity deep venous thrombosis without prophylactic inferior vena cava filter placement. // J. Vasc. Surg. Elsevier, 2007. Vol. 45, № 5. P. 992–997; discussion 997.
- Mewissen M.W. et al. Catheter-directed thrombolysis for lower extremity deep venous thrombosis: report of a national multicenter registry. // Radiology. Radiological Society of North America, 1999. Vol. 211, № 1. P. 39–49.
- Lin P.P.H., Zhou W., Dardik A. Catheter-direct thrombolysis versus pharmacomechanical thrombectomy for treatment of symptomatic lower extremity deep venous thrombosis // Am. J. Surg. Elsevier, 2006. Vol. 192, № 6. P. 782–788.
- Arko F.R., Davis C.C.M., Murphy E.E.H. Aggressive percutaneous mechanical thrombectomy of deep venous thrombosis: early clinical results // Arch. Surg. American Medical Association, 2007. Vol. 142, № 6. P. 513–518.
- Martinez Trabal J., Comerota A.A.J., LaPorte F.F.B.F. The quantitative benefit of isolated, segmental, pharmacomechanical thrombolysis (ISPMT) for iliofemoral venous thrombosis // J. Vasc. Surg. Elsevier, 2008. Vol. 48, № 6. P. 1532–1537.
- Tsai J., Georgiades C.C.S., Hong K. Presumed pulmonary embolism following power-pulse spray thrombectomy of upper extremity venous thrombosis // Cardiovasc. Intervent. Radiol. Springer, 2006. Vol. 29, № 4. P. 678–680.
- Eklof B., Mclafferty R.B. Surgical thrombectomy and percutaneous mechanical thrombectomy for treatment of acute iliofemoral venous thrombosis // Handbook of Venous Disorders: Guidelines of the American Venous Forum Third Edition. CRC Press, 2008. P. 255.
- Vedantham S. et al. Quality improvement guidelines for the treatment of lower-extremity deep vein thrombosis with use of endovascular thrombus removal. // J. Vasc. Interv. Radiol. 2014. Vol. 25, № 9. P. 1317–1325.
- Ashrafi M. et al. Treatment Strategies for Proximal Deep Vein Thrombosis: A Network Meta-analysis of Randomised Controlled Trials. // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2022. Vol. 63, № 2. P. 323–334.
- Casey E.T. et al. Treatment of acute iliofemoral deep vein thrombosis. // J. Vasc. Surg. J Vasc Surg, 2012. Vol. 55, № 5. P. 1463–1473.
- Лебедев И.С. et al. Фармакомеханическая реканализация магистральных вен при синей флегмазии, вызванной эмболической окклюзией кава-фильтра // Флебология. 2020. Vol. 14, № 1.
- Plate G., Eklöf B., Norgren L. Venous thrombectomy for iliofemoral vein thrombosis--10-year results of a prospective randomised study // Eur. J. Vasc. Endovasc. Surg. Eur J Vasc Endovasc Surg, 1997. Vol. 14, № 5. P. 367–374.
- Rodríguez L., Aboukheir-Aboukheir A., Figueroa-Vicente R. Hybrid operative thrombectomy is noninferior to percutaneous techniques for the treatment of acute iliofemoral deep venous thrombosis // J. Vasc. surgery. Venous Lymphat. Disord. J Vasc Surg Venous Lymphat Disord, 2017. Vol. 5, № 2. P. 177–184.
- Karthikesalingam A. et al. A systematic review of percutaneous mechanical thrombectomy in the treatment of deep venous thrombosis. // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2011. Vol. 41, № 4. P. 554–565.
- Blättler W., Heller G., Largiadèr J. Combined regional thrombolysis and surgical thrombectomy for treatment of iliofemoral vein thrombosis // J. Vasc. Surg. Elsevier, 2004. Vol. 40, № 4. P. 620–625.
- Comerota A.A.J., Gale S.S. Technique of contemporary iliofemoral and infrainguinal venous thrombectomy // J. Vasc. Surg. Elsevier, 2006. Vol. 43, № 1. P. 185–191.
- Hölper P. et al. Longterm results after surgical thrombectomy and simultaneous stenting for symptomatic iliofemoral venous thrombosis. // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2010. Vol. 39, № 3. P. 349–355.
- Husmann M.J. et al. Stenting of common iliac vein obstructions combined with regional thrombolysis and thrombectomy in acute deep vein thrombosis. // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2007. Vol. 34, № 1. P. 87–91.
- Lindow C. et al. Long-term results after transfemoral venous thrombectomy for iliofemoral deep venous thrombosis. // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2010. Vol. 40, № 1. P. 134–138.
- Schwarzbach M.H.M. et al. Surgical Thrombectomy Followed by Intraoperative Endovascular Reconstruction for Symptomatic Ilio-femoral Venous Thrombosis // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2005. Vol. 29, № 1. P. 58–66.
- Lichtenberg M.K.W. et al. Endovascular mechanical thrombectomy versus thrombolysis in patients with iliofemoral deep vein thrombosis - a systematic review and meta-analysis. // Vasa. Hogrefe AG, 2021. Vol. 50, № 1. P. 59–67.
- Hull R.D. et al. Quantitative assessment of thrombus burden predicts the outcome of treatment for venous thrombosis: a systematic review. // Am. J. Med. 2005. Vol. 118, № 5. P. 456–464.
- Haig Y. et al. Post-thrombotic syndrome after catheter-directed thrombolysis for deep vein thrombosis (CaVenT): 5-year follow-up results of an open-label, randomised controlled trial. // Lancet. Haematol. Elsevier, 2016. Vol. 3, № 2. P. e64-71.
- Engelberger R.P. et al. Ultrasound-assisted versus conventional catheter-directed thrombolysis for acute iliofemoral deep vein thrombosis: 1-year follow-up data of a randomized-controlled trial. // J. Thromb. Haemost. Am Heart Assoc, 2017. Vol. 15, № 7. P. 1351–1360.
- Garcia M., Lookstein R., Malhotra R. Endovascular Management of Deep Vein Thrombosis with Rheolytic Thrombectomy: Final Report of the Prospective Multicenter PEARL (Peripheral Use of AngioJet Rheolytic Thrombectomy with a Variety of Catheter Lengths) Registry // J. Vasc. Interv. Radiol. J Vasc Interv Radiol, 2015. Vol. 26, № 6. P. 777–785.
- Goldhaber S.Z. et al. Pooled analyses of randomized trials of streptokinase and heparin in phlebographically documented acute deep venous thrombosis. // Am. J. Med. Elsevier, 1984. Vol. 76, № 3. P. 393–397.
- Schwieder G. et al. Intermittent regional therapy with rt-PA is not superior to systemic thrombolysis in deep vein thrombosis (DVT)--a German multicenter trial. // Thromb. Haemost. Schattauer GmbH, 1995. Vol. 74, № 5. P. 1240–1243.
- Watson L., Broderick C., Armon M.P. Thrombolysis for acute deep vein thrombosis. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2016. Vol. 11, № 11. P. CD002783.
- Vedantham S., Thorpe P.P.E., Cardella J.J.F. Quality improvement guidelines for the treatment of lower extremity deep vein thrombosis with use of endovascular thrombus removal // J. Vasc. Interv. Radiol. Elsevier Inc., 2009. Vol. 20, № 7 Suppl. P. 227–239.
- Bækgaard N., Klitfod L., Broholm R. Safety and efficacy of catheter-directed thrombolysis // Phlebology. SAGE Publications Sage UK: London, England, 2012. Vol. 27, № 1_suppl. P. 149–154.
- Bækgaard N., Klitfod L., Jørgensen M. Should catheter-directed thrombolysis be monitored? // Phlebology. SAGE Publications Sage UK: London, England, 2016. Vol. 31, № 1_suppl. P. 5–10.
- Chaar C.I.O. Current Management of Venous Diseases / ed. Chaar C.I.O. Cham: Springer International Publishing, 2018.
- Kohi M.M.P., Kohlbrenner R., Kolli K.K.P. Catheter directed interventions for acute deep vein thrombosis // Cardiovasc. Diagn. Ther. AME Publications, 2016. Vol. 6, № 6. P. 599.
- Watson L., Armon M. Thrombolysis for acute deep vein thrombosis // Cochrane database Syst. Rev. Cochrane Database Syst Rev, 2004. № 4.
- Jeyabalan G. et al. Inflow thrombosis does not adversely affect thrombolysis outcomes of symptomatic iliofemoral deep vein thrombosis. // J. Vasc. Surg. Elsevier, 2011. Vol. 54, № 2. P. 448–453.
- Grunwald M.R., Hofmann L. V. Comparison of urokinase, alteplase, and reteplase for catheter-directed thrombolysis of deep venous thrombosis. // J. Vasc. Interv. Radiol. Elsevier, 2004. Vol. 15, № 4. P. 347–352.
- Sugimoto K., Hofmann L.V.L., Razavi M.M.K. The safety, efficacy, and pharmacoeconomics of low-dose alteplase compared with urokinase for catheter-directed thrombolysis of arterial and venous occlusions // J. Vasc. Surg. Elsevier, 2003. Vol. 37, № 3. P. 512–517.
- Sillesen H. et al. Catheter directed thrombolysis for treatment of ilio-femoral deep venous thrombosis is durable, preserves venous valve function and may prevent chronic venous insufficiency. // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2005. Vol. 30, № 5. P. 556–562.
- Verhaeghe R. et al. Catheter-directed lysis of iliofemoral vein thrombosis with use of rt-PA. // Eur. Radiol. Springer, 1997. Vol. 7, № 7. P. 996–1001.
- Engelberger R.P. et al. Fixed low-dose ultrasound-assisted catheter-directed thrombolysis followed by routine stenting of residual stenosis for acute ilio-femoral deep-vein thrombosis. // Thromb. Haemost. Schattauer GmbH, 2014. Vol. 111, № 6. P. 1153–1160.
- Comerota A.J. The ATTRACT Trial: Rationale for Early Intervention for Iliofemoral DVT // Perspect. Vasc. Surg. Endovasc. Ther. Sage Publications Sage CA: Los Angeles, CA, 2009. Vol. 21, № 4. P. 221–225.
- Semba C.P. et al. Alteplase as an alternative to urokinase. Advisory Panel on Catheter-Directed Thrombolytic Therapy. // J. Vasc. Interv. Radiol. 2000. Vol. 11, № 3. P. 279–287.
- Ogawa T., Hoshino S., Midorikawa H. Intermittent pneumatic compression of the foot and calf improves the outcome of catheter-directed thrombolysis using low-dose urokinase in patients with acute proximal venous thrombosis of the leg // J. Vasc. Surg. Elsevier, 2005. Vol. 42, № 5. P. 940–944.
- Vedantham S. et al. Pharmacomechanical thrombolysis and early stent placement for iliofemoral deep vein thrombosis. // J. Vasc. Interv. Radiol. Elsevier, 2004. Vol. 15, № 6. P. 565–574.
- Bush R.L. et al. Pharmacomechanical thrombectomy for treatment of symptomatic lower extremity deep venous thrombosis: safety and feasibility study. // J. Vasc. Surg. Elsevier, 2004. Vol. 40, № 5. P. 965–970.
- Kim H.S. et al. Adjunctive percutaneous mechanical thrombectomy for lower-extremity deep vein thrombosis: clinical and economic outcomes. // J. Vasc. Interv. Radiol. Elsevier, 2006. Vol. 17, № 7. P. 1099–1104.
- Diniz J., Coelho A., Mansilha A. Endovascular treatment of iliofemoral deep venous thrombosis: is there enough evidence to support it? A systematic review with meta-analysis // Int. Angiol. 2020. Vol. 39, № 2.
- Escobar G.A.G., Burks D., Abate M.M.R.M. Risk of acute kidney injury after percutaneous pharmacomechanical thrombectomy using AngioJet in venous and arterial thrombosis // Ann. Vasc. Surg. Elsevier, 2017. Vol. 42. P. 238–245.
- Shen Y., Wang X., Jin S.S. Increased risk of acute kidney injury with percutaneous mechanical thrombectomy using AngioJet compared with catheter-directed thrombolysis // J. Vasc. Surg. Venous Lymphat. Disord. Elsevier, 2019. Vol. 7, № 1. P. 29–37.
- Morrow K.K.L., Kim A.A.H., Plato S. Increased risk of renal dysfunction with percutaneous mechanical thrombectomy compared with catheter-directed thrombolysis // J. Vasc. Surg. Elsevier, 2017. Vol. 65, № 5. P. 1460–1466.
- Minko P. et al. Mechanical thrombectomy of iliac vein thrombosis in a pig model using the Rotarex and Aspirex catheters. // Cardiovasc. Intervent. Radiol. Springer, 2014. Vol. 37, № 1. P. 211–217.
- Lichtenberg M., Stahlhoff W., Özkapi A. Safety, procedural success and outcome of the Aspirex ® S endovascular thrombectomy system in the treatment of iliofemoral deep vein thrombosis - data from the Arnsberg Aspirex registry // Vasa. Vasa, 2019. Vol. 48, № 4. P. 341–346.
- Loffroy R., Falvo N., Guillen K. Single-Session Percutaneous Mechanical Thrombectomy Using the Aspirex® S Device Plus Stenting for Acute Iliofemoral Deep Vein Thrombosis: Safety, Efficacy, and Mid-Term Outcomes // Diagnostics. Multidisciplinary Digital Publishing Institute, 2020. Vol. 10, № 8. P. 544.
- Deák Z., Strube H., Sadeghi-Azandaryani M. Rotational thrombectomy of acute peripheral vascular occlusions using the ThromCat XT device: techniques, indications and initial results // Diagnostic Interv. Radiol. Aves Yayincilik Ltd. STI., 2011. Vol. 17, № 3. P. 283.
- Delomez M. et al. Mechanical thrombectomy in patients with deep venous thrombosis. // Cardiovasc. Intervent. Radiol. Springer, 2001. Vol. 24, № 1. P. 42–48.
- Gandini R. et al. Percutaneous ilio-caval thrombectomy with the Amplatz device: preliminary results. // Eur. Radiol. Springer, 1999. Vol. 9, № 5. P. 951–958.
- Lee K.-H. et al. Mechanical thrombectomy of acute iliofemoral deep vein thrombosis with use of an Arrow-Trerotola percutaneous thrombectomy device. // J. Vasc. Interv. Radiol. Elsevier, 2006. Vol. 17, № 3. P. 487–495.
- Прозоров С.А. et al. Удаление флотирующих тромбов из нижней полой вены // Эндоваскулярная хирургия. Общероссийская общественная организация" Российское научное общество …, 2017. Vol. 4, № 1. P. 39–44.
- Капранов С.А. Эндоваскулярная хирургия при заболеваниях венозной системы: возможности и перспективы // Флебология. 2007. Vol. 1, № 1. P. 29.
- Rajput F., Du L., Woods M. Percutaneous vacuum-assisted thrombectomy using angioVac aspiration system // Cardiovasc. Revascularization Med. Elsevier, 2020. Vol. 21, № 4. P. 489–493.
- Lopez R., DeMartino R., Fleming M. Aspiration thrombectomy for acute iliofemoral or central deep venous thrombosis // J. Vasc. Surg. Venous Lymphat. Disord. Elsevier, 2019. Vol. 7, № 2. P. 162–168.
- Hariri A. et al. Use of a novel mechanical rinsing and aspiration thrombectomy device for treatment of deep venous and arteriovenous graft thrombosis. // J. Vasc. Interv. Radiol. Elsevier, 2007. Vol. 18, № 2. P. 313–316.
- Heberlein W.E. et al. New generation aspiration catheter: Feasibility in the treatment of pulmonary embolism. // World J. Radiol. Baishideng Publishing Group Inc, 2013. Vol. 5, № 11. P. 430–435.
- Wang W., Sun R., Chen Y. Meta-analysis and systematic review of percutaneous mechanical thrombectomy for lower extremity deep vein thrombosis // J. Vasc. Surg. Venous Lymphat. Disord. Elsevier, 2018. Vol. 6, № 6. P. 788–800.
- Alkhouli M. et al. Inferior Vena Cava Thrombosis // JACC Cardiovasc. Interv. American College of Cardiology Foundation Washington, DC, 2016. Vol. 9, № 7. P. 629–643.
- McAree B.J. et al. Inferior vena cava thrombosis: a review of current practice. // Vasc. Med. Sage Publications Sage UK: London, England, 2013. Vol. 18, № 1. P. 32–43.
- Kaufman J.A. et al. Society of Interventional Radiology Clinical Practice Guideline for Inferior Vena Cava Filters in the Treatment of Patients with Venous Thromboembolic Disease: Developed in collaboration with the American College of Cardiology, American College of Chest P // J. Vasc. Interv. Radiol. Elsevier, 2020. Vol. 31, № 10. P. 1529–1544.
- Stein P.D., Matta F., Yaekoub A.Y. Incidence of vena cava thrombosis in the United States. // Am. J. Cardiol. Elsevier, 2008. Vol. 102, № 7. P. 927–929.
- Sharifi M. et al. Role of IVC filters in endovenous therapy for deep venous thrombosis: the FILTER-PEVI (filter implantation to lower thromboembolic risk in percutaneous endovenous intervention) trial. // Cardiovasc. Intervent. Radiol. Springer, 2012. Vol. 35, № 6. P. 1408–1413.
- Avgerinos E.D. et al. Inferior vena cava filter placement during thrombolysis for acute iliofemoral deep venous thrombosis. // J. Vasc. surgery. Venous Lymphat. Disord. Elsevier, 2014. Vol. 2, № 3. P. 274–281.
- Black S.A. et al. Management of acute and chronic iliofemoral venous outflow obstruction: a multidisciplinary team consensus. // Int. Angiol. Edizioni Minerva Medica, 2020. Vol. 39, № 1. P. 3–16.
- Chick J.F.B. et al. Endovascular Iliocaval Stent Reconstruction for Inferior Vena Cava Filter-Associated Iliocaval Thrombosis: Approach, Technical Success, Safety, and Two-Year Outcomes in 120 Patients. // J. Vasc. Interv. Radiol. Elsevier, 2017. Vol. 28, № 7. P. 933–939.
- Group P.S. Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave) randomized study // Circulation. Am Heart Assoc, 2005. Vol. 112, № 3. P. 416–422.
- Kölbel T. et al. Thrombus embolization into IVC filters during catheter-directed thrombolysis for proximal deep venous thrombosis. // J. Endovasc. Ther. SAGE Publications Sage CA: Los Angeles, CA, 2008. Vol. 15, № 5. P. 605–613.
- Лебедев И.С. et al. Тромбоз нижней полой вены, исходящий из гонадных вен, в послеродовом периоде: описание серии случаев и обзор литературы. // Флебология. 2020. Vol. 14, № 3.
- Meissner M.H. et al. Early thrombus removal strategies for acute deep venous thrombosis: clinical practice guidelines of the Society for Vascular Surgery and the American Venous Forum. // J. Vasc. Surg. Elsevier, 2012. Vol. 55, № 5. P. 1449–1462.
- Weaver F.A. et al. Phlegmasia cerulea dolens: therapeutic considerations. // South. Med. J. 1988. Vol. 81, № 3. P. 306–312.
- Fasolini F.G., Streuli H.K. [Thrombectomy versus conservative therapy of thrombosis of the deep veins of the pelvis and legs. Late results 10 years later]. // Helv. Chir. Acta. 1985. Vol. 52, № 5. P. 735–738.
- Gänger K.H. et al. Surgical thrombectomy versus conservative treatment for deep venous thrombosis; functional comparison of long-term results. // Eur. J. Vasc. Surg. Elsevier, 1989. Vol. 3, № 6. P. 529–538.
- Hamilton H. et al. Venous thrombectomy in patients presenting with iliofemoral vein thrombosis after renal transplantation. // Transpl. Int. Wiley Online Library, 1996. Vol. 9, № 5. P. 513–516.
- Hold M. et al. Deep venous thrombosis: results of thrombectomy versus medical therapy. Presented at the 5th European-American Symposium on Venous Diseases, Vienna, Austria, Nov. 7-11, 1990. // Vasa. 1992. Vol. 21, № 2. P. 181–187.
- Matsubara J. et al. Long-term follow-up results of the iliofemoral venous thrombosis. // J. Cardiovasc. Surg. (Torino). 1976. Vol. 17, № 3. P. 234–239.
- Plate G., Einarsson E., Ohlin P. Thrombectomy with temporary arteriovenous fistula: the treatment of choice in acute iliofemoral venous thrombosis // J. Vasc. Surg. Elsevier, 1984. Vol. 1, № 6. P. 867–876.
- Sato S. et al. [Conservative treatment of acute deep vein thrombosis of lower extremities]. // Nihon Geka Gakkai Zasshi. 1992. Vol. 93, № 9. P. 1052–1054.
- Stiegler H. et al. [Operation, lysis, heparin therapy: 3 equally valid forms of therapy in acute leg-pelvic venous thrombosis]. // Vasa. Suppl. 1987. Vol. 20. P. 153–156.
- Törngren S. et al. The long-term outcome of proximal vein thrombosis during pregnancy is not improved by the addition of surgical thrombectomy to anticoagulant treatment // Eur. J. Vasc. Endovasc. Surg. Elsevier, 1996. Vol. 12, № 1. P. 31–36.
- Seager M.J. et al. Editor’s Choice-- A Systematic Review of Endovenous Stenting in Chronic Venous Disease Secondary to Iliac Vein Obstruction. // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2016. Vol. 51, № 1. P. 100–120.
- Eijgenraam P., ten Cate H., ten Cate-Hoek A.J. Venous stenting after deep venous thrombosis and antithrombotic therapy: A systematic review // Rev. Vasc. Med. Elsevier, 2014. Vol. 2, № 3. P. 88–97.
- Breen K., Breen K. Role of venous stenting for venous thromboembolism // Hematol. Am. Soc. Hematol. Educ. Progr. Hematology Am Soc Hematol Educ Program, 2020. Vol. 2020, № 1. P. 606–611.
- Hage A., Srinivasa R., Abramowitz S. Endovascular Iliocaval Stent Reconstruction for Iliocaval Thrombosis: A Multi-Institutional International Practice Pattern Survey // Ann. Vasc. Surg. Ann Vasc Surg, 2018. Vol. 49. P. 64–74.
- Milinis K. et al. Antithrombotic Therapy Following Venous Stenting: International Delphi Consensus. // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2018. Vol. 55, № 4. P. 537–544.
- Taha M.M.A.H., Busuttil A., Bootun R. A systematic review on the use of deep venous stenting for acute venous thrombosis of the lower limb // Phlebology. SAGE Publications Sage UK: London, England, 2019. Vol. 34, № 2. P. 115–127.
- Bækgaard N., Broholm R., Just S. Indications for stenting during thrombolysis // Phlebology. SAGE Publications Sage UK: London, England, 2013. Vol. 28, № 1_suppl. P. 112–116.
- Meng Q.-Y. et al. Stenting of iliac vein obstruction following catheter-directed thrombolysis in lower extremity deep vein thrombosis. // Chin. Med. J. (Engl). LWW, 2013. Vol. 126, № 18. P. 3519–3522.
- Raju S. Treatment of iliac-caval outflow obstruction // Semin. Vasc. Surg. Semin Vasc Surg, 2015. Vol. 28, № 1. P. 47–53.
- Razavi M., Jaff M., Miller L. Safety and Effectiveness of Stent Placement for Iliofemoral Venous Outflow Obstruction: Systematic Review and Meta-Analysis // Circ. Cardiovasc. Interv. Circ Cardiovasc Interv, 2015. Vol. 8, № 10.
- Rodrigues L., Bertanha M., El Dib R. Association between deep vein thrombosis and stent patency in symptomatic iliac vein compression syndrome: Systematic review and meta-analysis // J. Vasc. surgery. Venous Lymphat. Disord. J Vasc Surg Venous Lymphat Disord, 2021. Vol. 9, № 1. P. 275–284.
- Raju S., Owen S., Neglen P. The clinical impact of iliac venous stents in the management of chronic venous insufficiency. // J. Vasc. Surg. Elsevier, 2002. Vol. 35, № 1. P. 8–15.
- May R., Thurner J. The cause of the predominantly sinistral occurrence of thrombosis of the pelvic veins. // Angiology. Sage Publications Sage CA: Thousand Oaks, CA, 1957. Vol. 8, № 5. P. 419–427.
- Cockett F.B., Thomas M.L. The iliac compression syndrome // Br. J. Surg. Wiley Online Library, 1965. Vol. 52, № 10. P. 816–821.
- Ochoa Chaar C., Aurshina A. Endovascular and Open Surgery for Deep Vein Thrombosis // Clin. Chest Med. Clin Chest Med, 2018. Vol. 39, № 3. P. 631–644.
- Majeed G.M. et al. A Systematic Review and Meta-Analysis of 12-Month Patency After Intervention for Iliofemoral Obstruction Using Dedicated or Non-Dedicated Venous Stents. // J. Endovasc. Ther. SAGE Publications Sage CA: Los Angeles, CA, 2022. Vol. 29, № 3. P. 478–492.
- Garcia R. et al. Present and future options for treatment of infrainguinal deep vein disease. // J. Vasc. surgery. Venous Lymphat. Disord. Elsevier, 2018. Vol. 6, № 5. P. 664–671.
- DeYoung E., Minocha J. Inferior Vena Cava Filters: Guidelines, Best Practice, and Expanding Indications. // Semin. Intervent. Radiol. Thieme Medical Publishers, 2016. Vol. 33, № 2. P. 65–70.
- Арсланбеков М.М., Ефремова О.И., Золотухин И.А. Эмболия в кава-фильтр: критерии, разработанные с использованием модифицированного метода Delphi // Флебология. Общество с ограниченной ответственностью Издательство Медиа Сфера, 2020. Vol. 14, № 3. P. 184–188.
- Liu Y. et al. Effect of inferior vena cava filters on pulmonary embolism-related mortality and major complications: a systematic review and meta-analysis of randomized controlled trials. // J. Vasc. surgery. Venous Lymphat. Disord. Elsevier, 2021. Vol. 9, № 3. P. 792-800.e2.
- Ahmed O. et al. Inferior Vena Cava Filter Evaluation and Management for the Diagnostic Radiologist: A Comprehensive Review Including Inferior Vena Cava Filter-Related Complications and PRESERVE Trial Filters. // Can. Assoc. Radiol. J. Elsevier, 2019. Vol. 70, № 4. P. 367–382.
- Gillespie D.L. et al. Predicting the Safety and Effectiveness of Inferior Vena Cava Filters Study: Design of a unique safety and effectiveness study of inferior vena cava filters in clinical practice. // J. Vasc. surgery. Venous Lymphat. Disord. Elsevier, 2020. Vol. 8, № 2. P. 187-194.e1.
- Kaufman J.A. et al. Guidelines for the use of retrievable and convertible vena cava filters: report from the Society of Interventional Radiology multidisciplinary consensus conference. // Surg. Obes. Relat. Dis. Springer, 2006. Vol. 2, № 2. P. 200–212.
- Mismetti P. et al. Effect of a retrievable inferior vena cava filter plus anticoagulation vs anticoagulation alone on risk of recurrent pulmonary embolism: a randomized clinical trial. // JAMA. American Medical Association, 2015. Vol. 313, № 16. P. 1627–1635.
- Decousus H. et al. A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. Prévention du Risque d’Embolie Pulmonaire par Interruption Cave Study Group. // N. Engl. J. Med. Mass Medical Soc, 1998. Vol. 338, № 7. P. 409–415.
- White R.H. et al. Outcomes After Vena Cava Filter Use in Noncancer Patients With Acute Venous Thromboembolism // Circulation. Am Heart Assoc, 2016. Vol. 133, № 21. P. 2018–2029.
- Jaff M.R. et al. Management of Massive and Submassive Pulmonary Embolism, Iliofemoral Deep Vein Thrombosis, and Chronic Thromboembolic Pulmonary Hypertension // Circulation. Am Heart Assoc, 2011. Vol. 123, № 16. P. 1788–1830.
- Золотухин И.А. et al. Оценка обоснованности показаний к имплантации кава-фильтров при венозных тромбоэмболических осложнениях // Флебология. 2021. Vol. 15, № 2. P. 80.
- Norris C.S., Greenfield L.J., Herrmann J.B. Free-floating iliofemoral thrombus. A risk of pulmonary embolism. // Arch. Surg. American Medical Association, 1985. Vol. 120, № 7. P. 806–808.
- Streiff M.B. Vena caval filters: a comprehensive review. // Blood. American Society of Hematology Washington, DC, 2000. Vol. 95, № 12. P. 3669–3677.
- Zhao H. et al. Comparison of the in vitro clot-capturing efficiencies of commercially available retrievable inferior vena cava filters. // J. Vasc. surgery. Venous Lymphat. Disord. Elsevier, 2022. Vol. 10, № 2. P. 463-468.e2.
- Порембская О.Я. et al. Легочная эмболия — разрозненные части несобранной мозаики // Флебология. 2021. Vol. 15, № 3. P. 188.
- Caplin D.M. et al. Quality improvement guidelines for the performance of inferior vena cava filter placement for the prevention of pulmonary embolism. // J. Vasc. Interv. Radiol. Elsevier, 2011. Vol. 22, № 11. P. 1499–1506.
- Radiology A.C. of, Radiology S. of I. ACR-SIR-SPR practice parameter for the performance of inferior vena cava filter placement for the Prevention of Pulmonary Embolism. Fairfax, VA: American College of Radiology/Society of Interventional Radiology, 2016.
- Ni H., Win L.L.L. Retrievable inferior vena cava filters for venous thromboembolism // Int. Sch. Res. Not. Hindawi, 2013. Vol. 2013. P. 1–8.
- Imberti D. et al. Clinical experience with retrievable vena cava filters: results of a prospective observational multicenter study. // J. Thromb. Haemost. Wiley Online Library, 2005. Vol. 3, № 7. P. 1370–1375.
- Dake M.M.D., Murphy T.T.P.T., Krämer A.A.H. One-year analysis of the prospective multicenter SENTRY clinical trial: safety and effectiveness of the Novate Sentry Bioconvertible Inferior Vena Cava Filter // J. Vasc. Interv. Radiol. Elsevier, 2018. Vol. 29, № 10. P. 1350–1361.
- Le Blanche A.F. et al. The optional VenaTech(TM) Convertible (TM) vena cava filter: experimental study in sheep. // Cardiovasc. Intervent. Radiol. Springer, 2012. Vol. 35, № 5. P. 1181–1187.
- Kusuyama T. et al. Patient with a massive idiopathic thrombosis in the inferior vena cava. // Ann. Vasc. Dis. The Editorial Committee of Annals of Vascular Diseases, 2012. Vol. 5, № 1. P. 89–91.
- Smith S.J. et al. Vacuum-assisted thrombectomy device (AngioVac) in the management of symptomatic iliocaval thrombosis. // J. Vasc. Interv. Radiol. Elsevier, 2014. Vol. 25, № 3. P. 425–430.
- Гаврилов Е.К., Тарасов В.А., Хубулава Г.Г. Опыт диагностики, лечебной тактики и оперативных вмешательств при обструкции нижней полой вены различного генеза. // Флебология. 2020. Vol. 14, № 4.
- Игнатьев И.М., Акчурин Ф.Р., Заночкин А.В. Опыт лечения флотирующих тромбозов в системе нижней полой вены // Флебология. Издательство’Медиа Сфера’, 2011. Vol. 5, № 4. P. 44–51.
- Кириенко А.И., Андрияшкин В.В., Иванов В.В. Открытые оперативные вмешательства в лечении больных с поздними осложнениями имплантации кава-фильтров // Флебология. Издательство’Медиа Сфера’, 2018. Vol. 12, № 1. P. 4–11.
- Кириенко А.И., Андрияшкин В.В., Лебедев И.С. Тромбоз супраренального отдела нижней полой вены и правого предсердия при раке желудка // Хирургия. Журнал им. НИ Пирогова. Общество с ограниченной ответственностью Издательство Медиа Сфера, 2014. № 8. P. 81–82.
- D’Ayala M. et al. Factors Associated with Successful Thrombus Extraction with the AngioVac Device: An Institutional Experience. // Ann. Vasc. Surg. Elsevier, 2017. Vol. 38. P. 242–247.
- Donaldson C.W. et al. Thrombectomy using suction filtration and veno-venous bypass: single center experience with a novel device. // Catheter. Cardiovasc. Interv. Wiley Online Library, 2015. Vol. 86, № 2. P. E81-7.
- Ray C.E., Prochazka A. The need for anticoagulation following inferior vena cava filter placement: systematic review. // Cardiovasc. Intervent. Radiol. Springer, 2008. Vol. 31, № 2. P. 316–324.
- Langham M.R., Hoffman M.J., Greenfield L.J. Effect of anticoagulation on the lysis of filter entrapped thromboembolism in dogs. // J. Surg. Res. Elsevier, 1985. Vol. 38, № 4. P. 391–399.
- Ageno W. et al. The diagnosis of symptomatic recurrent pulmonary embolism and deep vein thrombosis: guidance from the SSC of the ISTH. // J. Thromb. Haemost. Wiley Online Library, 2013. Vol. 11, № 8. P. 1597–1602.
- Egermayer P. The effects of heparin and oral anticoagulants on thrombus propagation and prevention of the postphlebitic syndrome: a critical review of the literature. // Prog. Cardiovasc. Dis. Elsevier, 2001. Vol. 44, № 1. P. 69–80.
- Gautam G., Sebastian T., Klok F.A. How to Differentiate Recurrent Deep Vein Thrombosis from Postthrombotic Syndrome. // Hamostaseologie. Georg Thieme Verlag KG, 2020. Vol. 40, № 3. P. 280–291.
- van Dam L.F. et al. Magnetic resonance imaging for diagnosis of recurrent ipsilateral deep vein thrombosis. // Blood. American Society of Hematology, 2020. Vol. 135, № 16. P. 1377–1385.
- Kyrle P.A. How I treat recurrent deep-vein thrombosis. // Blood. American Society of Hematology Washington, DC, 2016. Vol. 127, № 6. P. 696–702.
- van Dam L.F., Gautam G., Dronkers C.E.A. Safety of using the combination of the Wells rule and D‐dimer test for excluding acute recurrent ipsilateral deep vein thrombosis // J. Thromb. Haemost. Wiley Online Library, 2020. Vol. 18, № 9. P. 2341–2348.
- Hassen S. et al. High percentage of non-diagnostic compression ultrasonography results and the diagnosis of ipsilateral recurrent proximal deep vein thrombosis: a rebuttal. // J. Thromb. Haemost. Wiley Online Library, 2011. Vol. 9, № 2. P. 414–416; author reply 417-8.
- Schulman S. How I treat recurrent venous thromboembolism in patients receiving anticoagulant therapy. // Blood. American Society of Hematology Washington, DC, 2017. Vol. 129, № 25. P. 3285–3293.
- Luk C. et al. Extended outpatient therapy with low molecular weight heparin for the treatment of recurrent venous thromboembolism despite warfarin therapy. // Am. J. Med. Elsevier, 2001. Vol. 111, № 4. P. 270–273.
- Carrier M. et al. Dose escalation of low molecular weight heparin to manage recurrent venous thromboembolic events despite systemic anticoagulation in cancer patients. // J. Thromb. Haemost. Wiley Online Library, 2009. Vol. 7, № 5. P. 760–765.
- Joseph L. et al. Bivalirudin for the treatment of patients with confirmed or suspected heparin-induced thrombocytopenia. // J. Thromb. Haemost. Wiley Online Library, 2014. Vol. 12, № 7. P. 1044–1053.
- van Es N. et al. Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials // Blood. American Society of Hematology Washington, DC, 2014. Vol. 124, № 12. P. 1968–1975.
- Чечулова А.В. et al. Особенности кровотечений на фоне антикоагулянтной терапии у пациентов пожилого и старческого возраста с тромбозом глубоких вен. // Флебология. 2021. Vol. 15, № 3.
- Pengo V., Denas G. Optimizing quality care for the oral vitamin K antagonists (VKAs) // Hematology. American Society of Hematology Washington, DC, 2018. Vol. 2018, № 1. P. 332–338.
- Palareti G., Cosmi B. Bleeding with anticoagulation therapy - who is at risk, and how best to identify such patients. // Thromb. Haemost. Schattauer GmbH, 2009. Vol. 102, № 2. P. 268–278.
- Sarode R. et al. Efficacy and safety of a 4-factor prothrombin complex concentrate in patients on vitamin K antagonists presenting with major bleeding: a randomized, plasma-controlled, phase IIIb study. // Circulation. Am Heart Assoc, 2013. Vol. 128, № 11. P. 1234–1243.
- Chai-Adisaksopha C. et al. Prothrombin complex concentrates versus fresh frozen plasma for warfarin reversal. A systematic review and meta-analysis. // Thromb. Haemost. Schattauer GmbH, 2016. Vol. 116, № 5. P. 879–890.
- Steiner T. et al. Fresh frozen plasma versus prothrombin complex concentrate in patients with intracranial haemorrhage related to vitamin K antagonists (INCH): a randomised trial. // Lancet. Neurol. Elsevier, 2016. Vol. 15, № 6. P. 566–573.
- Pollack C. V et al. Idarucizumab for Dabigatran Reversal - Full Cohort Analysis. // N. Engl. J. Med. Mass Medical Soc, 2017. Vol. 377, № 5. P. 431–441.
- Chaudhary R. et al. Evaluation of Direct Oral Anticoagulant Reversal Agents in Intracranial Hemorrhage: A Systematic Review and Meta-analysis. // JAMA Netw. open. American Medical Association, 2022. Vol. 5, № 11. P. e2240145.
- Piran S. et al. Management of direct factor Xa inhibitor-related major bleeding with prothrombin complex concentrate: a meta-analysis. // Blood Adv. American Society of Hematology Washington, DC, 2019. Vol. 3, № 2. P. 158–167.
- Connolly S.J. et al. Full Study Report of Andexanet Alfa for Bleeding Associated with Factor Xa Inhibitors. // N. Engl. J. Med. Mass Medical Soc, 2019. Vol. 380, № 14. P. 1326–1335.
- Partsch H. Therapy of deep vein thrombosis with low molecular weight heparin, leg compression and immediate ambulation. // Vasa. 2001. Vol. 30, № 3. P. 195–204.
- Rice L. Heparin-induced thrombocytopenia: myths and misconceptions (that will cause trouble for you and your patient). // Arch. Intern. Med. American Medical Association, 2004. Vol. 164, № 18. P. 1961–1964.
- Martel N., Lee J., Wells P.S. Risk for heparin-induced thrombocytopenia with unfractionated and low-molecular-weight heparin thromboprophylaxis: a meta-analysis. // Blood. American Society of Hematology, 2005. Vol. 106, № 8. P. 2710–2715.
- Smythe M.A., Koerber J.M., Mattson J.C. The incidence of recognized heparin-induced thrombocytopenia in a large, tertiary care teaching hospital. // Chest. Elsevier, 2007. Vol. 131, № 6. P. 1644–1649.
- Ivascu N.S. et al. Heparin-Induced Thrombocytopenia: A Review for Cardiac Anesthesiologists and Intensivists. // J. Cardiothorac. Vasc. Anesth. Elsevier, 2019. Vol. 33, № 2. P. 511–520.
- Warkentin T.E. et al. Heparin-induced thrombocytopenia in patients treated with low-molecular-weight heparin or unfractionated heparin. // N. Engl. J. Med. Mass Medical Soc, 1995. Vol. 332, № 20. P. 1330–1335.
- Warkentin T.E. et al. Treatment and prevention of heparin-induced thrombocytopenia: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). // Chest. Elsevier, 2008. Vol. 133, № 6 Suppl. P. 340S-380S.
- Warkentin T.E., Kelton J.G. Temporal aspects of heparin-induced thrombocytopenia. // N. Engl. J. Med. Mass Medical Soc, 2001. Vol. 344, № 17. P. 1286–1292.
- Salter B.S. et al. Heparin-Induced Thrombocytopenia: A Comprehensive Clinical Review. // J. Am. Coll. Cardiol. American College of Cardiology Foundation Washington, DC, 2016. Vol. 67, № 21. P. 2519–2532.
- Sun X. et al. Heparin-Induced Thrombocytopenia in Contemporary Cardiac Surgical Practice and Experience With a Protocol for Early Identification. // Am. J. Cardiol. Elsevier, 2016. Vol. 117, № 2. P. 305–309.
- Cuker A. Management of the multiple phases of heparin-induced thrombocytopenia. // Thromb. Haemost. Schattauer GmbH, 2016. Vol. 116, № 5. P. 835–842.
- Warkentin T.E., Kelton J.G. A 14-year study of heparin-induced thrombocytopenia. // Am. J. Med. Elsevier, 1996. Vol. 101, № 5. P. 502–507.
- Warkentin T.E. Heparin-induced thrombocytopenia: pathogenesis and management // Br. J. Haematol. Wiley Online Library, 2003. Vol. 121, № 4. P. 535–555.
- Cuker A. Heparin-induced thrombocytopenia (HIT) in 2011: an epidemic of overdiagnosis. // Thromb. Haemost. Schattauer GmbH, 2011. Vol. 106, № 6. P. 993–994.
- Greinacher A. et al. Heparin-induced thrombocytopenia with thromboembolic complications: meta-analysis of 2 prospective trials to assess the value of parenteral treatment with lepirudin and its therapeutic aPTT range. // Blood. American Society of Hematology Washington, DC, 2000. Vol. 96, № 3. P. 846–851.
- Linkins L., Hu G., Warkentin T.E. Systematic review of fondaparinux for heparin-induced thrombocytopenia: When there are no randomized controlled trials. // Res. Pract. Thromb. Haemost. Wiley Online Library, 2018. Vol. 2, № 4. P. 678–683.
- Barlow A. et al. Potential Role of Direct Oral Anticoagulants in the Management of Heparin-induced Thrombocytopenia. // Pharmacotherapy. Wiley Online Library, 2019. Vol. 39, № 8. P. 837–853.
- Tran P.N., Tran M.-H. Emerging Role of Direct Oral Anticoagulants in the Management of Heparin-Induced Thrombocytopenia // Clin. Appl. Thromb. SAGE Publications Sage CA: Los Angeles, CA, 2018. Vol. 24, № 2. P. 201–209.
- Linkins L.A. et al. Rivaroxaban for treatment of suspected or confirmed heparin-induced thrombocytopenia study. // J. Thromb. Haemost. Wiley Online Library, 2016. Vol. 14, № 6. P. 1206–1210.
- Warkentin T.E., Pai M., Linkins L.-A. Direct oral anticoagulants for treatment of HIT: update of Hamilton experience and literature review. // Blood. American Society of Hematology Washington, DC, 2017. Vol. 130, № 9. P. 1104–1113.
- Jung M. et al. Safety of IVC Filters with Heparin-Induced Thrombocytopenia: A Retrospecive Study // Blood. American Society of Hematology, 2011. Vol. 118, № 21. P. 2225–2225.
- Hong A.P. et al. Central venous catheters and upper-extremity deep-vein thrombosis complicating immune heparin-induced thrombocytopenia. // Blood. American Society of Hematology Washington, DC, 2003. Vol. 101, № 8. P. 3049–3051.
- Warkentin T.E. et al. The pathogenesis of venous limb gangrene associated with heparin-induced thrombocytopenia. // Ann. Intern. Med. American College of Physicians, 1997. Vol. 127, № 9. P. 804–812.
- Srinivasan A.F. et al. Warfarin-induced skin necrosis and venous limb gangrene in the setting of heparin-induced thrombocytopenia. // Arch. Intern. Med. American Medical Association, 2004. Vol. 164, № 1. P. 66–70.
- Goel R. et al. Platelet transfusions in platelet consumptive disorders are associated with arterial thrombosis and in-hospital mortality. // Blood. American Society of Hematology Washington, DC, 2015. Vol. 125, № 9. P. 1470–1476.
- РОАГ. Венозные осложнения во время беременности и послеродовом периоде. Акушерская тромбоэмболия. Клинические рекомендации [Electronic resource]. 2022. URL: https://cr.minzdrav.gov.ru/schema/723_1.
- АФР. Флебит и тромбофлебит поверхностных сосудов. Клинические рекомендации [Electronic resource]. 2021. URL: cr.minzdrav.gov.ru/recomend/668_1.
- American College of Obstetricians and Gynecologists’ Committee on Practice Bulletins—Obstetrics. ACOG Practice Bulletin No. 196: Thromboembolism in Pregnancy. // Obstet. Gynecol. 2018. Vol. 132, № 1. P. e1–e17.
- RCOG. Thrombosis and Embolism during Pregnancy and the Puerperium, Reducing the Risk. RCOG Green-top Guideline No. 37a [Electronic resource]. URL: www.rcog.org.uk/en/guidelines-research-services/guidelines/gtg37a/.
- American College of Obstetricians and Gynecologists’ Committee on Practice Bulletins–Obstetrics. ACOG Practice Bulletin No. 197: Inherited Thrombophilias in Pregnancy. // Obstet. Gynecol. 2018. Vol. 132, № 1. P. e18–e34.
- Bates S.M. et al. Guidance for the treatment and prevention of obstetric-associated venous thromboembolism. // J. Thromb. Thrombolysis. Springer, 2016. Vol. 41, № 1. P. 92–128.
- Middeldorp S. Is thrombophilia testing useful? // Hematol. Am. Soc. Hematol. Educ. Progr. American Society of Hematology Washington, DC, 2011. Vol. 2011, № 1. P. 150–155.
- Jacobsen A.F., Skjeldestad F.E., Sandset P.M. Incidence and risk patterns of venous thromboembolism in pregnancy and puerperium--a register-based case-control study. // Am. J. Obstet. Gynecol. Elsevier, 2008. Vol. 198, № 2. P. 233.e1-7.
- RCOG. Thromboembolic Disease in Pregnancy and the Puerperium: Acute Management. RCOG Green-top Guideline No. 37b [Electronic resource]. 2015. URL: www.rcog.org.uk/en/guidelines-research-services/guidelines/gtg37b/.
- Bates S.M. et al. VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. // Chest. Elsevier, 2012. Vol. 141, № 2 Suppl. P. e691S-e736S.
- Cohen S.L. et al. Comparison of international societal guidelines for the diagnosis of suspected pulmonary embolism during pregnancy. // Lancet. Haematol. Elsevier, 2020. Vol. 7, № 3. P. e247–e258.
- Mallick S., Petkova D. Investigating suspected pulmonary embolism during pregnancy. // Respir. Med. Elsevier, 2006. Vol. 100, № 10. P. 1682–1687.
- Wan T. et al. Guidance for the diagnosis of pulmonary embolism during pregnancy: Consensus and controversies. // Thromb. Res. Elsevier, 2017. Vol. 157. P. 23–28.
- Righini M. et al. Diagnosis of Pulmonary Embolism During Pregnancy: A Multicenter Prospective Management Outcome Study. // Ann. Intern. Med. American College of Physicians, 2018. Vol. 169, № 11. P. 766–773.
- van der Pol L.M. et al. Pregnancy-Adapted YEARS Algorithm for Diagnosis of Suspected Pulmonary Embolism. // N. Engl. J. Med. Mass Medical Soc, 2019. Vol. 380, № 12. P. 1139–1149.
- Greer I.A., Nelson-Piercy C. Low-molecular-weight heparins for thromboprophylaxis and treatment of venous thromboembolism in pregnancy: a systematic review of safety and efficacy. // Blood. 2005. Vol. 106, № 2. P. 401–407.
- Sagaram D. et al. Heparin-Induced Thrombocytopenia during Obstetric Hospital Admissions. // Am. J. Perinatol. Thieme Medical Publishers, 2018. Vol. 35, № 9. P. 898–903.
- To M.S., Hunt B.J., Nelson-Piercy C. A negative D-dimer does not exclude venous thromboembolism (VTE) in pregnancy. // J. Obstet. Gynaecol. Taylor & Francis, 2008. Vol. 28, № 2. P. 222–223.
- McLintock C. et al. Recommendations for the diagnosis and treatment of deep venous thrombosis and pulmonary embolism in pregnancy and the postpartum period. // Aust. N. Z. J. Obstet. Gynaecol. LWW, 2012. Vol. 52, № 1. P. 14–22.
- Leung A.N. et al. American Thoracic Society documents: an official American Thoracic Society/Society of Thoracic Radiology Clinical Practice Guideline--Evaluation of Suspected Pulmonary Embolism in Pregnancy. // Radiology. American Thoracic Society, 2012. Vol. 262, № 2. P. 635–646.
- Bajc M. et al. EANM guidelines for ventilation/perfusion scintigraphy : Part 1. Pulmonary imaging with ventilation/perfusion single photon emission tomography. // Eur. J. Nucl. Med. Mol. Imaging. Springer, 2009. Vol. 36, № 8. P. 1356–1370.
- Linnemann B. et al. Diagnosis of pregnancy-associated venous thromboembolism - position paper of the Working Group in Women’s Health of the Society of Thrombosis and Haemostasis (GTH). // Vasa. 2016. Vol. 45, № 2. P. 87–101.
- Chan W.-S. et al. Venous thromboembolism and antithrombotic therapy in pregnancy. // J. Obstet. Gynaecol. Can. Elsevier, 2014. Vol. 36, № 6. P. 527–553.
- Torkzad M.R. et al. Magnetic resonance imaging and ultrasonography in diagnosis of pelvic vein thrombosis during pregnancy. // Thromb. Res. Elsevier, 2010. Vol. 126, № 2. P. 107–112.
- Devis P., Knuttinen M.G. Deep venous thrombosis in pregnancy: incidence, pathogenesis and endovascular management. // Cardiovasc. Diagn. Ther. AME Publications, 2017. Vol. 7, № Suppl 3. P. S309–S319.
- Damodaram M. et al. D-dimers as a screening test for venous thromboembolism in pregnancy: is it of any use? // J. Obstet. Gynaecol. Taylor & Francis, 2009. Vol. 29, № 2. P. 101–103.
- Kovac M. et al. The use of D-dimer with new cutoff can be useful in diagnosis of venous thromboembolism in pregnancy. // Eur. J. Obstet. Gynecol. Reprod. Biol. Elsevier, 2010. Vol. 148, № 1. P. 27–30.
- Rabe E. et al. Indications for medical compression stockings in venous and lymphatic disorders: An evidence-based consensus statement. // Phlebology. SAGE Publications Sage UK: London, England, 2018. Vol. 33, № 3. P. 163–184.
- Sivolella S., De Biagi M., Brunello G. Managing dentoalveolar surgical procedures in patients taking new oral anticoagulants // Odontology. Odontology, 2015. Vol. 103, № 3. P. 258–263.
- Johnston S. An evidence summary of the management of patients taking direct oral anticoagulants (DOACs) undergoing dental surgery // Int. J. Oral Maxillofac. Surg. Int J Oral Maxillofac Surg, 2016. Vol. 45, № 5. P. 618–630.
- Mauprivez C., Khonsari R., Razouk O. Management of dental extraction in patients undergoing anticoagulant oral direct treatment: a pilot study // Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Oral Surg Oral Med Oral Pathol Oral Radiol, 2016. Vol. 122, № 5. P. e146–e155.
- Patel J., Woolcombe S., Patel R. Managing direct oral anticoagulants in patients undergoing dentoalveolar surgery // Br. Dent. J. Br Dent J, 2017. Vol. 222, № 4. P. 245–249.
- Yagyuu T., Kawakami M., Ueyama Y. Risks of postextraction bleeding after receiving direct oral anticoagulants or warfarin: A retrospective cohort study // BMJ Open. BMJ Open, 2017. Vol. 7, № 8.
- Miclotte I., Vanhaverbeke M., Agbaje J. Pragmatic approach to manage new oral anticoagulants in patients undergoing dental extractions: a prospective case-control study // Clin. Oral Investig. Clin Oral Investig, 2017. Vol. 21, № 7. P. 2183–2188.
- Kakkos S.K. et al. Combined intermittent pneumatic leg compression and pharmacological prophylaxis for prevention of venous thromboembolism. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2016. Vol. 9, № 9. P. CD005258.
- Ho K.M., Tan J.A. Stratified meta-analysis of intermittent pneumatic compression of the lower limbs to prevent venous thromboembolism in hospitalized patients. // Circulation. Am Heart Assoc, 2013. Vol. 128, № 9. P. 1003–1020.
- Dong K. et al. Pentasaccharides for the prevention of venous thromboembolism. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2016. Vol. 10, № 10. P. CD005134.
- Sachdeva A., Dalton M., Lees T. Graduated compression stockings for prevention of deep vein thrombosis. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2018. Vol. 11, № 11. P. CD001484.
- Collins R. et al. Reduction in fatal pulmonary embolism and venous thrombosis by perioperative administration of subcutaneous heparin. Overview of results of randomized trials in general, orthopedic, and urologic surgery. // N. Engl. J. Med. Wolters Kluwer Philadelphia, PA, 1988. Vol. 318, № 18. P. 1162–1173.
- Mismetti P. et al. Meta-analysis of low molecular weight heparin in the prevention of venous thromboembolism in general surgery. // Br. J. Surg. Wiley Online Library, 2001. Vol. 88, № 7. P. 913–930.
- Koch A. et al. Low molecular weight heparin and unfractionated heparin in thrombosis prophylaxis after major surgical intervention: update of previous meta-analyses. // Br. J. Surg. Wiley Online Library, 1997. Vol. 84, № 6. P. 750–759.
- Lederle F.A. et al. Venous thromboembolism prophylaxis in hospitalized medical patients and those with stroke: a background review for an American College of Physicians Clinical Practice Guideline. // Ann. Intern. Med. American College of Physicians, 2011. Vol. 155, № 9. P. 602–615.
- Jørgensen L.N., Wille-Jørgensen P., Hauch O. Prophylaxis of postoperative thromboembolism with low molecular weight heparins. // Br. J. Surg. Wiley Online Library, 1993. Vol. 80, № 6. P. 689–704.
- Tafur A., Douketis J. Perioperative management of anticoagulant and antiplatelet therapy. // Heart. BMJ Publishing Group Ltd and British Cardiovascular Society, 2018. Vol. 104, № 17. P. 1461–1467.
- Kuo H. et al. Thromboembolic and bleeding risk of periprocedural bridging anticoagulation: A systematic review and meta-analysis. // Clin. Cardiol. Wiley Online Library, 2020. Vol. 43, № 5. P. 441–449.
- Douketis J.D. Perioperative management of patients who are receiving warfarin therapy: an evidence-based and practical approach. // Blood. American Society of Hematology Washington, DC, 2011. Vol. 117, № 19. P. 5044–5049.
- Jaffer A.K. et al. Variations in perioperative warfarin management: outcomes and practice patterns at nine hospitals. // Am. J. Med. Elsevier, 2010. Vol. 123, № 2. P. 141–150.
- Singer D.E. et al. Antithrombotic therapy in atrial fibrillation: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). // Chest. Elsevier, 2008. Vol. 133, № 6 Suppl. P. 546S-592S.
- Salem D.N. et al. Valvular and structural heart disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). // Chest. Elsevier, 2008. Vol. 133, № 6 Suppl. P. 593S-629S.
- Siegal D. et al. Periprocedural heparin bridging in patients receiving vitamin K antagonists: systematic review and meta-analysis of bleeding and thromboembolic rates. // Circulation. Am Heart Assoc, 2012. Vol. 126, № 13. P. 1630–1639.
- Tafur A.J. et al. Predictors of major bleeding in peri-procedural anticoagulation management. // J. Thromb. Haemost. Wiley Online Library, 2012. Vol. 10, № 2. P. 261–267.
- Ansell J. et al. The pharmacology and management of the vitamin K antagonists: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. // Chest. Elsevier, 2004. Vol. 126, № 3 Suppl. P. 204S-233S.
- Douketis J.D. et al. Bridging anticoagulation with low-molecular-weight heparin after interruption of warfarin therapy is associated with a residual anticoagulant effect prior to surgery. // Thromb. Haemost. Schattauer GmbH, 2005. Vol. 94, № 3. P. 528–531.
- O’Donnell M.J. et al. Brief communication: Preoperative anticoagulant activity after bridging low-molecular-weight heparin for temporary interruption of warfarin. // Ann. Intern. Med. 2007. Vol. 146, № 3. P. 184–187.
- Strebel N. et al. Preoperative or postoperative start of prophylaxis for venous thromboembolism with low-molecular-weight heparin in elective hip surgery? // Arch. Intern. Med. American Medical Association, 2002. Vol. 162, № 13. P. 1451–1456.
- Douketis J., Spyropoulos A., Kaatz S. Perioperative Bridging Anticoagulation in Patients with Atrial Fibrillation // N. Engl. J. Med. N Engl J Med, 2015. Vol. 373, № 9. P. 823–833.
- Dunn A.S., Spyropoulos A.C., Turpie A.G.G. Bridging therapy in patients on long-term oral anticoagulants who require surgery: the Prospective Peri-operative Enoxaparin Cohort Trial (PROSPECT). // J. Thromb. Haemost. Wiley Online Library, 2007. Vol. 5, № 11. P. 2211–2218.
- Kovacs M.J. et al. Postoperative low molecular weight heparin bridging treatment for patients at high risk of arterial thromboembolism (PERIOP2): double blind randomised controlled trial // BMJ. British Medical Journal Publishing Group, 2021. Vol. 373. P. n1205.
- Beyer-Westendorf J., Gelbricht V., Förster K. Peri-interventional management of novel oral anticoagulants in daily care: results from the prospective Dresden NOAC registry // Eur. Heart J. Eur Heart J, 2014. Vol. 35, № 28. P. 1888–1896.
- Douketis J.D. et al. Perioperative Management of Patients With Atrial Fibrillation Receiving a Direct Oral Anticoagulant. // JAMA Intern. Med. American Medical Association, 2019. Vol. 179, № 11. P. 1469–1478.
- Sherwood M.W. et al. Outcomes of temporary interruption of rivaroxaban compared with warfarin in patients with nonvalvular atrial fibrillation: results from the rivaroxaban once daily, oral, direct factor Xa inhibition compared with vitamin K antagonism for prevention of stro // Circulation. Am Heart Assoc, 2014. Vol. 129, № 18. P. 1850–1859.
- Douketis J.D. et al. Perioperative bridging anticoagulation during dabigatran or warfarin interruption among patients who had an elective surgery or procedure. Substudy of the RE-LY trial. // Thromb. Haemost. Schattauer GmbH, 2015. Vol. 113, № 3. P. 625–632.
- Shaw J.R. et al. Predictors of preprocedural direct oral anticoagulant levels in patients having an elective surgery or procedure. // Blood Adv. American Society of Hematology Washington, DC, 2020. Vol. 4, № 15. P. 3520–3527.
- Heidbuchel H. et al. EHRA practical guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation: executive summary. // Eur. Heart J. Oxford University Press, 2013. Vol. 34, № 27. P. 2094–2106.
- Kearon C., Hirsh J. Management of anticoagulation before and after elective surgery. // N. Engl. J. Med. Mass Medical Soc, 1997. Vol. 336, № 21. P. 1506–1511.
- White R.H. et al. Temporary discontinuation of warfarin therapy: changes in the international normalized ratio. // Ann. Intern. Med. American College of Physicians, 1995. Vol. 122, № 1. P. 40–42.
- Larson B.J.G., Zumberg M.S., Kitchens C.S. A feasibility study of continuing dose-reduced warfarin for invasive procedures in patients with high thromboembolic risk. // Chest. Elsevier, 2005. Vol. 127, № 3. P. 922–927.
- Jenny J.Y., Pabinger I., Samama C.M. European guidelines on perioperative venous thromboembolism prophylaxis // Eur. J. Anaesthesiol. Lippincott Williams and Wilkins, 2018. Vol. 35, № 2. P. 123–129.
- Levy J.H., Tanaka K.A., Dietrich W. Perioperative hemostatic management of patients treated with vitamin K antagonists. // Anesthesiology. The American Society of Anesthesiologists, 2008. Vol. 109, № 5. P. 918–926.
- Polania Gutierrez J.J., Rocuts K.R. Perioperative Anticoagulation Management // StatPearls. 2022.
- Bateman B.T. et al. The risk and outcomes of epidural hematomas after perioperative and obstetric epidural catheterization: a report from the Multicenter Perioperative Outcomes Group Research Consortium. // Anesth. Analg. LWW, 2013. Vol. 116, № 6. P. 1380–1385.
- Moen V., Dahlgren N., Irestedt L. Severe neurological complications after central neuraxial blockades in Sweden 1990-1999. // Anesthesiology. The American Society of Anesthesiologists, 2004. Vol. 101, № 4. P. 950–959.
- Horlocker T.T. et al. Regional Anesthesia in the Patient Receiving Antithrombotic or Thrombolytic Therapy: American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Fourth Edition). // Reg. Anesth. Pain Med. Wolters Kluwer, 2018. Vol. 43, № 3. P. 263–309.
- Vandermeulen E.P., Van Aken H., Vermylen J. Anticoagulants and spinal-epidural anesthesia. // Anesth. Analg. LWW, 1994. Vol. 79, № 6. P. 1165–1177.
- Liu S.S., Mulroy M.F. Neuraxial anesthesia and analgesia in the presence of standard heparin. // Reg. Anesth. Pain Med. Lippincott Williams & Wilkins Ovid Technologies, 1998. Vol. 23, № 6 Suppl 2. P. 157–163.
- Chaney M.A. Intrathecal and epidural anesthesia and analgesia for cardiac surgery. // Anesth. Analg. LWW, 2006. Vol. 102, № 1. P. 45–64.
- Davis J.J. et al. Three-times-daily subcutaneous unfractionated heparin and neuraxial anesthesia: a retrospective review of 928 cases. // Reg. Anesth. Pain Med. BMJ Publishing Group Ltd, 2012. Vol. 37, № 6. P. 623–626.
- Pace M., Koury K., Gulur P. Epidurals in patients receiving thromboprophylaxis with unfractionated heparin three times a day: the value of activated partial thromboplastin time testing. // Anesth. Analg. LWW, 2014. Vol. 119, № 5. P. 1215–1218.
- Weitz J.I. Low-molecular-weight heparins. // N. Engl. J. Med. Mass Medical Soc, 1997. Vol. 337, № 10. P. 688–698.
- Tetri S. et al. Safety of low-dose subcutaneous enoxaparin for the prevention of venous thromboembolism after primary intracerebral haemorrhage. // Thromb. Res. Elsevier, 2008. Vol. 123, № 2. P. 206–212.
- Singelyn F.J. et al. The safety and efficacy of extended thromboprophylaxis with fondaparinux after major orthopedic surgery of the lower limb with or without a neuraxial or deep peripheral nerve catheter: the EXPERT Study. // Anesth. Analg. LWW, 2007. Vol. 105, № 6. P. 1540–1547, table of contents.
- Kietaibl S. et al. Regional anaesthesia in patients on antithrombotic drugs: Joint ESAIC/ESRA guidelines. // Eur. J. Anaesthesiol. LWW, 2022. Vol. 39, № 2. P. 100–132.
- Greenblatt D.J. Elimination half-life of drugs: value and limitations. // Annu. Rev. Med. Annual Reviews 4139 El Camino Way, PO Box 10139, Palo Alto, CA 94303-0139, USA, 1985. Vol. 36, № 1. P. 421–427.
- Narouze S. et al. Interventional Spine and Pain Procedures in Patients on Antiplatelet and Anticoagulant Medications (Second Edition): Guidelines From the American Society of Regional Anesthesia and Pain Medicine, the European Society of Regional Anaesthesia and Pain Thera // Reg. Anesth. Pain Med. BMJ Publishing Group Ltd, 2018. Vol. 43, № 3. P. 225–262.
- Baron T.H., Kamath P.S., McBane R.D. Management of antithrombotic therapy in patients undergoing invasive procedures. // N. Engl. J. Med. Mass Medical Soc, 2013. Vol. 368, № 22. P. 2113–2124.
- Liew A., Douketis J. Perioperative management of patients who are receiving a novel oral anticoagulant. // Intern. Emerg. Med. Springer, 2013. Vol. 8, № 6. P. 477–484.
- Prandoni P. et al. Recurrent venous thromboembolism and bleeding complications during anticoagulant treatment in patients with cancer and venous thrombosis. // Blood. American Society of Hematology Washington, DC, 2002. Vol. 100, № 10. P. 3484–3488.
- Sobieraj D.M. et al. Anticoagulation for the Treatment of Cancer-Associated Thrombosis: A Systematic Review and Network Meta-Analysis of Randomized Trials. // Clin. Appl. Thromb. Hemost. SAGE Publications Sage CA: Los Angeles, CA, 2018. Vol. 24, № 9_suppl. P. 182S-187S.
- Лобастов К.В., Счастливцев И.В. Актуальный статус прямых оральных антикоагулянтов при лечении венозных тромбоэмболических осложнений у онкологических больных // Рациональная фармакотерапия в кардиологии. Общество с ограниченной ответственностью «Столичная издательская компания», 2020. Vol. 16, № 2. P. 286–295.
- Francis C.W. et al. Treatment of venous thromboembolism in cancer patients with dalteparin for up to 12 months: the DALTECAN Study. // J. Thromb. Haemost. Wiley Online Library, 2015. Vol. 13, № 6. P. 1028–1035.
- Jara-Palomares L. et al. Tinzaparin in cancer associated thrombosis beyond 6 months: TiCAT study. // Thromb. Res. Elsevier, 2017. Vol. 157. P. 90–96.
- Kirkilesis G.I., Kakkos S.K., Tsolakis I.A. Editor’s Choice - A Systematic Review and Meta-Analysis of the Efficacy and Safety of Anticoagulation in the Treatment of Venous Thromboembolism in Patients with Cancer. // Eur. J. Vasc. Endovasc. Surg. Elsevier, 2019. Vol. 57, № 5. P. 685–701.
- Lee A.Y.Y. et al. Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer. // N. Engl. J. Med. Mass Medical Soc, 2003. Vol. 349, № 2. P. 146–153.
- Кательницкая О.В. et al. Особенности антикоагулянтной терапии венозных тромбоэмболических осложнений у пациентов со злокачественными новообразованиями // Флебология. 2020. Vol. 14, № 2.
- Young A.M. et al. Comparison of an Oral Factor Xa Inhibitor With Low Molecular Weight Heparin in Patients With Cancer With Venous Thromboembolism: Results of a Randomized Trial (SELECT-D). // J. Clin. Oncol. 2018. Vol. 36, № 20. P. 2017–2023.
- McBane R.D. et al. Apixaban and dalteparin in active malignancy-associated venous thromboembolism: The ADAM VTE trial. // J. Thromb. Haemost. Wiley Online Library, 2020. Vol. 18, № 2. P. 411–421.
- Agnelli G. et al. Apixaban for the Treatment of Venous Thromboembolism Associated with Cancer. // N. Engl. J. Med. 2020. Vol. 382, № 17. P. 1599–1607.
- Raskob G.E. et al. Edoxaban for the Treatment of Cancer-Associated Venous Thromboembolism. // N. Engl. J. Med. Mass Medical Soc, 2018. Vol. 378, № 7. P. 615–624.
- Giustozzi M. et al. Direct Oral Anticoagulants for the Treatment of Acute Venous Thromboembolism Associated with Cancer: A Systematic Review and Meta-Analysis. // Thromb. Haemost. Georg Thieme Verlag KG, 2020. Vol. 120, № 7. P. 1128–1136.
- Riaz I. Bin et al. Direct Oral Anticoagulants Compared With Dalteparin for Treatment of Cancer-Associated Thrombosis: A Living, Interactive Systematic Review and Network Meta-analysis. // Mayo Clin. Proc. Elsevier, 2022. Vol. 97, № 2. P. 308–324.
- Dong S. et al. Direct Oral Anticoagulant for the Treatment of VTE in Cancer Patients: A Systematic Review and Meta-analysis. // Ann. Pharmacother. SAGE Publications Sage CA: Los Angeles, CA, 2021. Vol. 55, № 4. P. 430–439.
- Houghton D.E. et al. Bleeding in Patients With Gastrointestinal Cancer Compared With Nongastrointestinal Cancer Treated With Apixaban, Rivaroxaban, or Enoxaparin for Acute Venous Thromboembolism // Mayo Clin. Proc. Elsevier, 2021. Vol. 96, № 11. P. 2793–2805.
- Kearon C., Akl E.A., Comerota A.J. Antithrombotic therapy for VTE disease: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines // Chest. American College of Chest Physicians, 2012. Vol. 141, № 2 SUPPL. P. e419S-e496S.
- ICM-VTE General Delegates. Recommendations from the ICM-VTE: General // J. Bone Jt. Surg. Lippincott Williams and Wilkins Ltd., 2022. Vol. 104, № Suppl 1. P. 4–162.
- Song K. et al. The preoperative incidence of deep vein thrombosis (DVT) and its correlation with postoperative DVT in patients undergoing elective surgery for femoral neck fractures. // Arch. Orthop. Trauma Surg. Springer, 2016. Vol. 136, № 10. P. 1459–1464.
- Zhang B.-F. et al. Deep vein thrombosis in bilateral lower extremities after hip fracture: a retrospective study of 463 patients. // Clin. Interv. Aging. Dove Press, 2018. Vol. 13. P. 681–689.
- Luksameearunothai K. et al. Usefulness of clinical predictors for preoperative screening of deep vein thrombosis in hip fractures. // BMC Musculoskelet. Disord. Springer, 2017. Vol. 18, № 1. P. 208.
- Pan Y. et al. [A single-center retrospective study on the intraluminal implantation of inferior vena cava filter for the lower extremity trauma patients with deep venous thrombosis]. // Zhonghua Wai Ke Za Zhi. 2014. Vol. 52, № 4. P. 254–257.
- Shao M. et al. [Application of inferior vena cava filters in prevention of peri-operative pulmonary embolism in patients with bone fracture combined with deep venous thrombosis: a report of 572 cases]. // Zhonghua Wai Ke Za Zhi. 2012. Vol. 50, № 5. P. 418–421.
- Асамов Р.Э. et al. Бессимптомные флеботромбозы и наследственная тромбофилия у больных со скелетной травмой // Ангиология и сосудистая хирургия. Российское общество ангиологов и сосудистых хирургов, 2008. Vol. 14, № 3. P. 73–78.
- Власов С.В. et al. Тромбоэмболические осложнения при лечении проксимальных переломов бедренной кости // Политравма. Благотворительный фонд «Центра охраны здоровья шахтеров», 2012. № 3. P. 23–28.
- Алабут А.В. Тактика активной профилактики тромбоэмболических осложнений при эндопротезировании крупных суставов // Медицинский вестник Северного Кавказа. Федеральное государственное бюджетное образовательное учреждение высшего …, 2011. Vol. 21, № 1. P. 49–51.
- Sun M.-C., Li M.-S. Intervention for diagnosis of deep vein thrombosis in acute stroke patients: a hospital-based study. // PLoS One. Public Library of Science San Francisco, USA, 2014. Vol. 9, № 12. P. e114094.
- Khan M.T. et al. Deep Vein Thrombosis in Acute Stroke - A Systemic Review of the Literature. // Cureus. Cureus Inc., 2017. Vol. 9, № 12. P. e1982.
- Hughes S. et al. Anticoagulation in chronic kidney disease patients-the practical aspects. // Clin. Kidney J. Oxford University Press, 2014. Vol. 7, № 5. P. 442–449.
- Woodruff S., Feugère G., Abreu P. A post hoc analysis of dalteparin versus oral anticoagulant (VKA) therapy for the prevention of recurrent venous thromboembolism (rVTE) in patients with cancer and renal impairment // J. Thromb. Thrombolysis. Springer, 2016. Vol. 42, № 4. P. 494–504.
- Martin K.A. et al. Use of direct oral anticoagulants in patients with obesity for treatment and prevention of venous thromboembolism: Updated communication from the ISTH SSC Subcommittee on Control of Anticoagulation. // J. Thromb. Haemost. Wiley Online Library, 2021. Vol. 19, № 8. P. 1874–1882.
- Katel A. et al. Efficacy and Safety of Direct Oral Anticoagulants in Venous Thromboembolism Compared to Traditional Anticoagulants in Morbidly Obese Patients: A Systematic Review and Meta-Analysis. // Cureus. Cureus, 2021. Vol. 13, № 4. P. e14572.
- Ihaddadene R., Carrier M. The use of anticoagulants for the treatment and prevention of venous thromboembolism in obese patients: implications for safety. // Expert Opin. Drug Saf. Taylor & Francis, 2016. Vol. 15, № 1. P. 65–74.
- Wilson S.J.-A. et al. Effect of patient weight on the anticoagulant response to adjusted therapeutic dosage of low-molecular- weight heparin for the treatment of venous thromboembolism. // Haemostasis. Karger Publishers, 2001. Vol. 31, № 1. P. 42–48.
- Sanderink G. et al. The pharmacokinetics and pharmacodynamics of enoxaparin in obese volunteers. // Clin. Pharmacol. Ther. Wiley Online Library, 2002. Vol. 72, № 3. P. 308–318.
- Al-Yaseen E. et al. The safety of dosing dalteparin based on actual body weight for the treatment of acute venous thromboembolism in obese patients // J. Thromb. Haemost. Wiley Online Library, 2005. Vol. 3, № 1. P. 100–102.
- Bazinet A. et al. Dosage of enoxaparin among obese and renal impairment patients // Thromb. Res. Elsevier, 2005. Vol. 116, № 1. P. 41–50.
- Imberti D. et al. Prophylaxis of venous thromboembolism with low molecular weight heparin in bariatric surgery: a prospective, randomised pilot study evaluating two doses of parnaparin (BAFLUX Study) // Obes. Surg. Springer, 2014. Vol. 24, № 2. P. 284–291.
- Davidson B.L. et al. Effect of obesity on outcomes after fondaparinux, enoxaparin, or heparin treatment for acute venous thromboembolism in the Matisse trials. // J. Thromb. Haemost. Wiley Online Library, 2007. Vol. 5, № 6. P. 1191–1194.
- Margaglione M. et al. Anticoagulation in Italian patients with venous thromboembolism and thrombophilic alterations: findings from START2 register study. // Blood Transfus. SIMTI Servizi, 2020. Vol. 18, № 6. P. 486–495.
- Kearon C. et al. Influence of thrombophilia on risk of recurrent venous thromboembolism while on warfarin: results from a randomized trial. // Blood. American Society of Hematology Washington, DC, 2008. Vol. 112, № 12. P. 4432–4436.
- Elsebaie M.A.T. et al. Direct oral anticoagulants in patients with venous thromboembolism and thrombophilia: a systematic review and meta‐analysis // J. Thromb. Haemost. Wiley Online Library, 2019. Vol. 17, № 4. P. 645–656.
- Cohen H. et al. Rivaroxaban versus warfarin to treat patients with thrombotic antiphospholipid syndrome, with or without systemic lupus erythematosus (RAPS): a randomised, controlled, open-label, phase 2/3, non-inferiority trial. // Lancet. Haematol. Elsevier, 2016. Vol. 3, № 9. P. e426-36.
- Goldhaber S.Z. et al. Efficacy of dabigatran versus warfarin in patients with acute venous thromboembolism in the presence of thrombophilia: Findings from RE-COVER®, RE-COVERTM II, and RE-MEDYTM. // Vasc. Med. SAGE Publications Sage UK: London, England, 2016. Vol. 21, № 6. P. 506–514.
- Ginsberg J.S. et al. Antiphospholipid antibodies and venous thromboembolism. // Blood. 1995. Vol. 86, № 10. P. 3685–3691.
- Chaturvedi S., McCrae K.R. Diagnosis and management of the antiphospholipid syndrome // Blood Rev. Elsevier, 2017. Vol. 31, № 6. P. 406–417.
- Garcia D., Erkan D. Diagnosis and Management of the Antiphospholipid Syndrome. // N. Engl. J. Med. Mass Medical Soc, 2018. Vol. 378, № 21. P. 2010–2021.
- Joffe H. V et al. Upper-extremity deep vein thrombosis: a prospective registry of 592 patients. // Circulation. Am Heart Assoc, 2004. Vol. 110, № 12. P. 1605–1611.
- van den Houten M.M.L. et al. Treatment of upper-extremity outflow thrombosis. // Phlebology. SAGE Publications Sage UK: London, England, 2016. Vol. 31, № 1 Suppl. P. 28–33.
- Persson L.M. et al. Hemodynamic and morphologic evaluation of sequelae of primary upper extremity deep venous thromboses treated with anticoagulation. // J. Vasc. Surg. Elsevier, 2006. Vol. 43, № 6. P. 1230–1235; discussion 1235.
- Illig K.A., Doyle A.J. A comprehensive review of Paget-Schroetter syndrome. // J. Vasc. Surg. Elsevier, 2010. Vol. 51, № 6. P. 1538–1547.
- Hughes E.S.R. Venous obstruction in the upper extremity. // Br. J. Surg. Wiley Online Library, 1948. Vol. 36, № 142. P. 155–163.
- Sanders R.J., Hammond S.L., Rao N.M. Diagnosis of thoracic outlet syndrome. // J. Vasc. Surg. Elsevier, 2007. Vol. 46, № 3. P. 601–604.
- Freischlag J., Orion K. Understanding thoracic outlet syndrome. // Scientifica (Cairo). Hindawi, 2014. Vol. 2014. P. 248163.
- McCleery R.S. et al. Subclavius and anterior scalene muscle compression as a cause of intermittent obstruction of the subclavian vein // Ann. Surg. Lippincott, Williams, and Wilkins, 1951. Vol. 133, № 5. P. 588–602.
- Thiyagarajah K. et al. Post-thrombotic syndrome and recurrent thromboembolism in patients with upper extremity deep vein thrombosis: A systematic review and meta-analysis. // Thromb. Res. Elsevier, 2019. Vol. 174. P. 34–39.
- Kucher N. Clinical practice. Deep-vein thrombosis of the upper extremities. // N. Engl. J. Med. Mass Medical Soc, 2011. Vol. 364, № 9. P. 861–869.
- Sartori M. et al. D-dimer for the diagnosis of upper extremity deep and superficial venous thrombosis. // Thromb. Res. Elsevier, 2015. Vol. 135, № 4. P. 673–678.
- Kraaijpoel N. et al. The diagnostic management of upper extremity deep vein thrombosis: A review of the literature. // Thromb. Res. Elsevier, 2017. Vol. 156. P. 54–59.
- Hans S.S., Shepard A.D., Weaver M.R. Endovascular and open vascular reconstruction: a practical approach. CRC Press, 2017.
- Mustafa B.O. et al. Sensitivity and specificity of ultrasonography in the diagnosis of upper extremity deep vein thrombosis: a systematic review. // Arch. Intern. Med. American Medical Association, 2002. Vol. 162, № 4. P. 401–404.
- Povlsen S., Povlsen B. Diagnosing Thoracic Outlet Syndrome: Current Approaches and Future Directions. // Diagnostics (Basel, Switzerland). Multidisciplinary Digital Publishing Institute, 2018. Vol. 8, № 1. P. 21.
- Sidawy A.P., Perler B.A. Rutherford’s vascular surgery and endovascular therapy, E-Book. Elsevier Health Sciences, 2018.
- Montiel F.S. et al. Treatment with direct oral anticoagulants in patients with upper extremity deep vein thrombosis. // Thromb. J. BioMed Central, 2017. Vol. 15, № 1. P. 26.
- Schastlivtsev I. et al. Rivaroxaban in the treatment of upper extremity deep vein thrombosis: A single-center experience and review of the literature. // Thromb. Res. Elsevier, 2019. Vol. 181. P. 24–28.
- Porfidia A. et al. Upper extremity deep vein thrombosis treated with direct oral anticoagulants: a multi-center real world experience. // J. Thromb. Thrombolysis. Springer, 2020. Vol. 50, № 2. P. 355–360.
- Houghton D.E. et al. Treatment of upper extremity deep vein thrombosis with apixaban and rivaroxaban. // Am. J. Hematol. Wiley Online Library, 2020. Vol. 95, № 7. P. 817–823.
- Lugo J. et al. Acute Paget-Schroetter syndrome: does the first rib routinely need to be removed after thrombolysis? // Ann. Vasc. Surg. Elsevier, 2015. Vol. 29, № 6. P. 1073–1077.
- Molina J.E., Hunter D.W., Dietz C.A. Paget-Schroetter syndrome treated with thrombolytics and immediate surgery. // J. Vasc. Surg. Elsevier, 2007. Vol. 45, № 2. P. 328–334.
- Stone D.H. et al. Aggressive treatment of idiopathic axillo-subclavian vein thrombosis provides excellent long-term function. // J. Vasc. Surg. Elsevier, 2010. Vol. 52, № 1. P. 127–131.
- Karaolanis G. et al. A systematic review and meta-analysis for the management of Paget-Schroetter syndrome. // J. Vasc. surgery. Venous Lymphat. Disord. Elsevier, 2021. Vol. 9, № 3. P. 801-810.e5.
- Meltzer A.J., Schneider D.B. Surgical techniques: Operative decompression using the infraclavicular approach for VTOS // Thoracic Outlet Syndrome. Springer, 2013. P. 429–432.
- Saber W. et al. Risk factors for catheter-related thrombosis (CRT) in cancer patients: a patient-level data (IPD) meta-analysis of clinical trials and prospective studies. // J. Thromb. Haemost. Wiley Online Library, 2011. Vol. 9, № 2. P. 312–319.
- Farge D. et al. International clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer. // J. Thromb. Haemost. Wiley Online Library, 2013. Vol. 11, № 1. P. 56–70.
- Barco S. et al. Anticoagulants for the prevention and treatment of catheter-related thrombosis in adults and children on parenteral nutrition: a systematic review and critical appraisal. // Blood Transfus. SIMTI Servizi, 2017. Vol. 15, № 4. P. 369–377.
- Rajasekhar A., Streiff M.B. How I treat central venous access device-related upper extremity deep vein thrombosis. // Blood. American Society of Hematology Washington, DC, 2017. Vol. 129, № 20. P. 2727–2736.
- Baumann Kreuziger L., Jaffray J., Carrier M. Epidemiology, diagnosis, prevention and treatment of catheter-related thrombosis in children and adults // Thromb. Res. Elsevier, 2017. Vol. 157. P. 64–71.
- Partsch H., Blättler W. Compression and walking versus bed rest in the treatment of proximal deep venous thrombosis with low molecular weight heparin. // J. Vasc. Surg. Elsevier, 2000. Vol. 32, № 5. P. 861–869.
- Roumen-Klappe E.M. et al. Multilayer compression bandaging in the acute phase of deep-vein thrombosis has no effect on the development of the post-thrombotic syndrome. // J. Thromb. Thrombolysis. Springer, 2009. Vol. 27, № 4. P. 400–405.
- Blättler W., Partsch H. Leg compression and ambulation is better than bed rest for the treatment of acute deep venous thrombosis. // Int. Angiol. Turin, Italy: Minerva Medica,[1982-, 2003. Vol. 22, № 4. P. 393–400.
- Kahn S.R. et al. Graduated compression stockings to treat acute leg pain associated with proximal DVT. A randomised controlled trial. // Thromb. Haemost. Schattauer GmbH, 2014. Vol. 112, № 6. P. 1137–1141.
- Amin E.E. et al. Reduced incidence of vein occlusion and postthrombotic syndrome after immediate compression for deep vein thrombosis // Blood. American Society of Hematology Washington, DC, 2018. Vol. 132, № 21. P. 2298–2304.
- Arpaia G. et al. Efficacy of elastic compression stockings used early or after resolution of the edema on recanalization after deep venous thrombosis: the COM.PRE Trial. // Blood Coagul. Fibrinolysis. LWW, 2007. Vol. 18, № 2. P. 131–137.
- Brandjes D.P. et al. Randomised trial of effect of compression stockings in patients with symptomatic proximal-vein thrombosis. // Lancet (London, England). Elsevier, 1997. Vol. 349, № 9054. P. 759–762.
- Prandoni P. et al. Below-knee elastic compression stockings to prevent the post-thrombotic syndrome: a randomized, controlled trial. // Ann. Intern. Med. American College of Physicians, 2004. Vol. 141, № 4. P. 249–256.
- Prandoni P. et al. Thigh-length versus below-knee compression elastic stockings for prevention of the postthrombotic syndrome in patients with proximal-venous thrombosis: a randomized trial. // Blood. American Society of Hematology Washington, DC, 2012. Vol. 119, № 6. P. 1561–1565.
- Tie H.-T. et al. Compression Therapy in the Prevention of Postthrombotic Syndrome: A Systematic Review and Meta-Analysis. // Medicine (Baltimore). Wolters Kluwer Health, 2015. Vol. 94, № 31. P. e1318.
- Partsch H., Kaulich M., Mayer W. Immediate mobilisation in acute vein thrombosis reduces post-thrombotic syndrome. // Int. Angiol. Edizioni Minerva Medica, 2004. Vol. 23, № 3. P. 206–212.
- Aschwanden M. et al. Effect of prolonged treatment with compression stockings to prevent post-thrombotic sequelae: a randomized controlled trial. // J. Vasc. Surg. Elsevier, 2008. Vol. 47, № 5. P. 1015–1021.
- Mol G.C. et al. One versus two years of elastic compression stockings for prevention of post-thrombotic syndrome (OCTAVIA study): randomised controlled trial. // BMJ. British Medical Journal Publishing Group, 2016. Vol. 353. P. i2691.
- Ten Cate-Hoek A.J. et al. Individualised versus standard duration of elastic compression therapy for prevention of post-thrombotic syndrome (IDEAL DVT): a multicentre, randomised, single-blind, allocation-concealed, non-inferiority trial. // Lancet. Haematol. Elsevier, 2018. Vol. 5, № 1. P. e25–e33.
- Hillegass E. et al. Role of Physical Therapists in the Management of Individuals at Risk for or Diagnosed With Venous Thromboembolism: Evidence-Based Clinical Practice Guideline. // Phys. Ther. Oxford University Press, 2016. Vol. 96, № 2. P. 143–166.
- Rocha A.T. et al. Risk-assessment algorithm and recommendations for venous thromboembolism prophylaxis in medical patients. // Vasc. Health Risk Manag. Dove Press, 2007. Vol. 3, № 4. P. 533–553.
- Excellence N.I. for H. and C. Falls in older people: assessing risk and prevention. NICE, 2013.
- Wells P.S. et al. Value of assessment of pretest probability of deep-vein thrombosis in clinical management. // Lancet (London, England). Elsevier, 1997. Vol. 350, № 9094. P. 1795–1798.
- Kwon O.-Y. et al. Effects of ankle exercise combined with deep breathing on blood flow velocity in the femoral vein. // Aust. J. Physiother. Elsevier, 2003. Vol. 49, № 4. P. 253–258.
- Motykie G.D. et al. Risk factor assessment in the management of patients with suspected deep venous thrombosis. // Int. Angiol. Edizioni Minerva Medica, 2000. Vol. 19, № 1. P. 47–51.
- Aissaoui N. et al. A meta-analysis of bed rest versus early ambulation in the management of pulmonary embolism, deep vein thrombosis, or both. // Int. J. Cardiol. Elsevier, 2009. Vol. 137, № 1. P. 37–41.
- Kahn S.R., Shrier I., Kearon C. Physical activity in patients with deep venous thrombosis: a systematic review. // Thromb. Res. Elsevier, 2008. Vol. 122, № 6. P. 763–773.
- Dupras D., Bluhm J., Felty C. Institute for Clinical Systems Improvement. Venous Thromboembolism Diagnosis and Treatment. 2013.
- Pieracci F.M. et al. Use of long-term anticoagulation is associated with traumatic intracranial hemorrhage and subsequent mortality in elderly patients hospitalized after falls: analysis of the New York State Administrative Database. // J. Trauma. LWW, 2007. Vol. 63, № 3. P. 519–524.
- Inui T.S. et al. Mortality after ground-level fall in the elderly patient taking oral anticoagulation for atrial fibrillation/flutter: a long-term analysis of risk versus benefit. // J. Trauma Acute Care Surg. LWW, 2014. Vol. 76, № 3. P. 642–649; discussion 649-50.
- Garvin R., Howard E. Are major bleeding events from falls more likely in patients on warfarin? // J. Fam. Pract. Family Physicians Inquiries Network, 2006. Vol. 55, № 2. P. 159–160; discussion 159.
- Garwood C.L., Corbett T.L. Use of anticoagulation in elderly patients with atrial fibrillation who are at risk for falls. // Ann. Pharmacother. SAGE Publications Sage CA: Los Angeles, CA, 2008. Vol. 42, № 4. P. 523–532.
- Feinberg W.M., Blackshear J.L., Laupacis A. Prevalence, age distribution, and gender of patients with atrial fibrillation: analysis and implications // Arch. Intern. Med. American Medical Association, 1995. Vol. 155, № 5. P. 469–473.
- Noack F. et al. Feasibility and safety of rehabilitation after venous thromboembolism. // Vasc. Health Risk Manag. Dove Press, 2015. Vol. 11. P. 397–401.
- Amoury M. et al. Prognosis of patients with pulmonary embolism after rehabilitation // Vasc. Health Risk Manag. Dove Press, 2018. Vol. Volume 14. P. 183–187.
- Blackwell D.L., Lucas J.W., Clarke T.C. Summary health statistics for U.S. adults: national health interview survey, 2012. // Vital Health Stat. 10. 2014. № 260. P. 1–161.
- Stevens J.A. Falls among older adults--risk factors and prevention strategies. // J. Safety Res. 2005. Vol. 36, № 4. P. 409–411.
- АТОР. Профилактика венозных тромбоэмболических осложнений в травматологии и ортопедии. Российские клинические рекомендации. // Травматология и ортопедия России. 2012. Vol. 63, № 1. P. 3–24.
- Ахтямов И.Ф., Зиатдинов Б.Г., Кильметов Т.А. Эффективность электронейростимуляции как метода профилактики тромбоэмболических осложнений при эндопротезировании тазобедренного сустава. 2017. Vol. 8, № 109. P. 29–35.
- Gavish I., Brenner B. Air travel and the risk of thromboembolism. // Intern. Emerg. Med. Springer, 2011. Vol. 6, № 2. P. 113–116.
- Kuipers S. et al. The risk of venous thrombosis after air travel: contribution of clinical risk factors. // Br. J. Haematol. 2014. Vol. 165, № 3. P. 412–413.
- Belcaro G. et al. Prevention of Venous Thrombosis with Elastic Stockings During Long-Haul Flights: The LONFLIT 5 JAP Study // Clin. Appl. Thromb. Sage Publications Sage CA: Thousand Oaks, CA, 2003. Vol. 9, № 3. P. 197–201.
- Belcaro G. et al. Venous Thromboembolism from Air Travel // Angiology. Sage Publications Sage CA: Thousand Oaks, CA, 2001. Vol. 52, № 6. P. 369–374.
- Clark S.L., Onida S., Davies A. Long-haul travel and venous thrombosis: What is the evidence? // Phlebol. J. Venous Dis. SAGE Publications Sage UK: London, England, 2018. Vol. 33, № 5. P. 295–297.
- Toff W.D., Sugerman H., Eklöf B.G. Venous thrombosis related to air travel--reply. // JAMA. American Medical Association, 2013. Vol. 309, № 13. P. 1347.
- Alikhan R. et al. Prevention of venous thromboembolism in medical patients with enoxaparin // Blood Coagul. Fibrinolysis. LWW, 2003. Vol. 14, № 4. P. 341–346.
- Cohen A.T. et al. Efficacy and safety of fondaparinux for the prevention of venous thromboembolism in older acute medical patients: randomised placebo controlled trial // BMJ. British Medical Journal Publishing Group, 2006. Vol. 332, № 7537. P. 325–329.
- Cohen A.T. et al. Thromboprophylaxis with dalteparin in medical patients: which patients benefit? // Vasc. Med. Sage Publications Sage UK: London, England, 2007. Vol. 12, № 2. P. 123–127.
- Salmaggi A. et al. Perioperative thromboprophylaxis in patients with craniotomy for brain tumours: a systematic review. // J. Neurooncol. Springer, 2013. Vol. 113, № 2. P. 293–303.
- Einstein M.H., Pritts E.A., Hartenbach E.M. Venous thromboembolism prevention in gynecologic cancer surgery: a systematic review. // Gynecol. Oncol. Elsevier, 2007. Vol. 105, № 3. P. 813–819.
- Eppsteiner R.W. et al. Mechanical compression versus subcutaneous heparin therapy in postoperative and posttrauma patients: a systematic review and meta-analysis. // World J. Surg. Springer, 2010. Vol. 34, № 1. P. 10–19.
- Leonardi M.J., McGory M.L., Ko C.Y. A systematic review of deep venous thrombosis prophylaxis in cancer patients: implications for improving quality. // Ann. Surg. Oncol. Springer, 2007. Vol. 14, № 2. P. 929–936.
- Akl E.A. et al. Low molecular weight heparin versus unfractionated heparin for perioperative thromboprophylaxis in patients with cancer. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2014. № 6. P. CD009447.
- Kakkar V. V et al. Extended prophylaxis with bemiparin for the prevention of venous thromboembolism after abdominal or pelvic surgery for cancer: the CANBESURE randomized study. // J. Thromb. Haemost. Wiley Online Library, 2010. Vol. 8, № 6. P. 1223–1229.
- Kakkar A.K. et al. Preoperative enoxaparin versus postoperative semuloparin thromboprophylaxis in major abdominal surgery: a randomized controlled trial. // Ann. Surg. LWW, 2014. Vol. 259, № 6. P. 1073–1079.
- Vedovati M.C. et al. A randomized study on 1-week versus 4-week prophylaxis for venous thromboembolism after laparoscopic surgery for colorectal cancer. // Ann. Surg. LWW, 2014. Vol. 259, № 4. P. 665–669.
- Auer R. et al. The use of extended perioperative low molecular weight heparin (tinzaparin) to improve disease-free survival following surgical resection of colon cancer: a pilot randomized controlled trial. // Blood Coagul. Fibrinolysis. LWW, 2011. Vol. 22, № 8. P. 760–762.
- Akl E.A. et al. Extended perioperative thromboprophylaxis in patients with cancer. A systematic review. // Thromb. Haemost. Schattauer GmbH, 2008. Vol. 100, № 6. P. 1176–1180.
- Fagarasanu A. et al. Role of Extended Thromboprophylaxis After Abdominal and Pelvic Surgery in Cancer Patients: A Systematic Review and Meta-Analysis. // Ann. Surg. Oncol. Springer, 2016. Vol. 23, № 5. P. 1422–1430.
- Guo Q. et al. Perioperative Pharmacological Thromboprophylaxis in Patients With Cancer: A Systematic Review and Meta-analysis. // Ann. Surg. LWW, 2017. Vol. 265, № 6. P. 1087–1093.
- Rasmussen M.S., Jørgensen L.N., Wille-Jørgensen P. Prolonged thromboprophylaxis with low molecular weight heparin for abdominal or pelvic surgery. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2009. № 1. P. CD004318.
- Felder S. et al. Prolonged thromboprophylaxis with low molecular weight heparin for abdominal or pelvic surgery. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2019. Vol. 8, № 8. P. CD004318.
- Carrier M. et al. Lack of evidence to support thromboprophylaxis in hospitalized medical patients with cancer. // Am. J. Med. Elsevier, 2014. Vol. 127, № 1. P. 82-6.e1.
- Agnelli G. et al. Nadroparin for the prevention of thromboembolic events in ambulatory patients with metastatic or locally advanced solid cancer receiving chemotherapy: a randomised, placebo-controlled, double-blind study. // Lancet. Oncol. Elsevier, 2009. Vol. 10, № 10. P. 943–949.
- Khorana A.A. et al. Rivaroxaban for Thromboprophylaxis in High-Risk Ambulatory Patients with Cancer. // N. Engl. J. Med. Mass Medical Soc, 2019. Vol. 380, № 8. P. 720–728.
- Whitlock R.P. et al. Antithrombotic and thrombolytic therapy for valvular disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. // Chest. Elsevier, 2012. Vol. 141, № 2 Suppl. P. e576S-e600S.
- ASA. Arthroplasty Society of Australia guidelines for VTE prophylaxis for hip and knee arthroplasty: Australian Orthopaedic Association. 2018.
- National Guideline Centre. Venous thromboembolism in over 16s: Reducing the risk of hospital-acquired deep vein thrombosis or pulmonary embolism // National Institute for Health and Care excellence. 2018. Vol. 2, № March.
- Balk E.M. et al. Venous thromboembolism prophylaxis in major orthopedic surgery: systematic review update. 2018.
- Schulman S. et al. Venous Thromboembolic Diseases: Diagnosis, Management and Thrombophilia Testing: Observations on NICE Guideline [NG158]. // Thromb. Haemost. Georg Thieme Verlag KG, 2020. Vol. 120, № 8. P. 1143–1146.
- Forster R., Stewart M. Anticoagulants (extended duration) for prevention of venous thromboembolism following total hip or knee replacement or hip fracture repair. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2016. Vol. 3, № 3. P. CD004179.
- Falck-Ytter Y. et al. Prevention of VTE in orthopedic surgery patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. // Chest. Elsevier, 2012. Vol. 141, № 2 Suppl. P. e278S-e325S.
- Borgen P.O. et al. Similar Clinical Outcomes with Preoperative and Postoperative Start of Thromboprophylaxis in THA: A Register-based Study. // Clin. Orthop. Relat. Res. Springer, 2017. Vol. 475, № 9. P. 2245–2252.
- Ast M.P. et al. Clinical outcomes of patients with non-fatal VTE after total knee arthroplasty. // J. Arthroplasty. Elsevier, 2014. Vol. 29, № 1. P. 37–39.
- Venker B.T. et al. Safety and Efficacy of New Anticoagulants for the Prevention of Venous Thromboembolism After Hip and Knee Arthroplasty: A Meta-Analysis. // J. Arthroplasty. Elsevier, 2017. Vol. 32, № 2. P. 645–652.
- An V.V.G.G. et al. Aspirin as Thromboprophylaxis in Hip and Knee Arthroplasty: A Systematic Review and Meta-Analysis. // J. Arthroplasty. Churchill Livingstone Inc., 2016. Vol. 31, № 11. P. 2608–2616.
- Любимов Е.А. et al. Опыт использования ацетилсалициловой кислоты в комплексной профилактике венозных тромбоэмболических осложнений после артропластики коленного сустава. // Флебология. 2020. Vol. 14, № 3.
- Касимова А.Р. et al. Анализ амбулаторного этапа фармакологической тромбопрофилактики у пациентов после эндопротезирования коленного сустава. // Флебология. 2020. Vol. 14, № 3.
- Pedersen A.B. et al. Venous thromboembolism in patients having knee replacement and receiving thromboprophylaxis: a Danish population-based follow-up study. // J. Bone Joint Surg. Am. LWW, 2011. Vol. 93, № 14. P. 1281–1287.
- Guijarro R. et al. Venous thromboembolism and bleeding after total knee and hip arthroplasty. Findings from the Spanish National Discharge Database. // Thromb. Haemost. Thromb Haemost, 2011. Vol. 105, № 4. P. 610–615.
- Raphael I.J. et al. Aspirin: an alternative for pulmonary embolism prophylaxis after arthroplasty? // Clin. Orthop. Relat. Res. Springer, 2014. Vol. 472, № 2. P. 482–488.
- Anderson D.R. et al. Aspirin Versus Low-Molecular-Weight Heparin for Extended Venous Thromboembolism Prophylaxis After Total Hip Arthroplasty // Ann. Intern. Med. Ann Intern Med, 2013. Vol. 158, № 11. P. 800.
- Касимова А.Р.Р., Божкова С.А., Тихилов Р.М. Влияние фармакологической тромбопрофилактики, турникета и дренирования на геморрагические осложнения в ранние сроки после эндопротезирования коленного сустава: предварительные результаты // Травматология и ортопедия России. Федеральное государственное бюджетное учреждение «Российский ордена …, 2019. Vol. 25, № 3. P. 70–80.
- Касимова А.Р., Божкова С. Применение различных групп лекарственных средств для фармакологической тромбопрофилактики после больших ортопедических операций в клинической практике // Флебология. 2018. Vol. 12, № 4. P. 306–313.
- Di Nisio M., van Es N., Büller H.R. Deep vein thrombosis and pulmonary embolism. // Lancet (London, England). Elsevier, 2016. Vol. 388, № 10063. P. 3060–3073.
- Sarmiento A., Goswami A. Thromboembolic disease prophylaxis in total hip arthroplasty. // Clin. Orthop. Relat. Res. LWW, 2005. Vol. 436, № 436. P. 138–143.
- Huang H.F.H.-F., Tian J.L.J.-L., Sun L. The effect of anticoagulants on venous thrombosis prevention after knee arthroscopy: a systematic review. 2019. Vol. 43, № 10. P. 2303–2308.
- Salzler M.J. et al. Complications after arthroscopic knee surgery. // Am. J. Sports Med. SAGE Publications Sage CA: Los Angeles, CA, 2014. Vol. 42, № 2. P. 292–296.
- Graham W.C., Flanigan D.C. Venous thromboembolism following arthroscopic knee surgery: a current concepts review of incidence, prophylaxis, and preoperative risk assessment. // Sports Med. Springer, 2014. Vol. 44, № 3. P. 331–343.
- Zheng G. et al. No effectiveness of anticoagulants for thromboprophylaxis after non-major knee arthroscopy: a systemic review and meta-analysis of randomized controlled trials. // J. Thromb. Thrombolysis. 2018. Vol. 45, № 4. P. 562–570.
- Jameson S.S. et al. Venous thromboembolic events following foot and ankle surgery in the English National Health Service. // J. Bone Joint Surg. Br. The British Editorial Society of Bone and Joint Surgery, 2011. Vol. 93, № 4. P. 490–497.
- Calder J.D.F. et al. Meta-analysis and suggested guidelines for prevention of venous thromboembolism (VTE) in foot and ankle surgery. // Knee Surg. Sports Traumatol. Arthrosc. Springer, 2016. Vol. 24, № 4. P. 1409–1420.
- Weisman M.H.S. et al. Venous Thromboembolic Prophylaxis in Foot and Ankle Surgery: A Review of Current Literature and Practice. // Foot Ankle Spec. SAGE Publications Sage CA: Los Angeles, CA, 2017. Vol. 10, № 4. P. 343–351.
- Bikdeli B., Chatterjee S., Desai N.R. Inferior Vena Cava Filters to Prevent Pulmonary Embolism: Systematic Review and Meta-Analysis // J. Am. Coll. Cardiol. Elsevier USA, 2017. Vol. 70, № 13. P. 1587–1597.
- Felcher A.H. et al. Incidence and risk factors for venous thromboembolic disease in podiatric surgery. // Chest. Elsevier, 2009. Vol. 135, № 4. P. 917–922.
- Jameson S.S. et al. Venous thromboembolic events are rare after shoulder surgery: analysis of a national database. // J. shoulder Elb. Surg. Elsevier, 2011. Vol. 20, № 5. P. 764–770.
- Ojike N.I. et al. Venous thromboembolism in shoulder surgery: a systematic review. // Acta Orthop. Belg. 2011. Vol. 77, № 3. P. 281–289.
- Sager B. et al. Timing and Risk Factors for Venous Thromboembolism After Rotator Cuff Repair in the 30-Day Perioperative Period. // Arthroscopy. Elsevier, 2019. Vol. 35, № 11. P. 3011–3018.
- Mosenthal W.P. et al. Thromboprophylaxis in Spinal Surgery. // Spine (Phila. Pa. 1976). Wolters Kluwer, 2018. Vol. 43, № 8. P. E474–E481.
- Shiqing W. et al. Efficacy of low molecular weight heparin in spinal trauma patients after part concentrated screw surgery and its influence on blood parameters and the incidence of deep venous thrombosis. // Med. Hypotheses. Elsevier, 2019. Vol. 132. P. 109330.
- Faraoni D. et al. European guidelines on perioperative venous thromboembolism prophylaxis: Neurosurgery. // Eur. J. Anaesthesiol. Lippincott Williams and Wilkins, 2018. Vol. 35, № 2. P. 90–95.
- Routhier N., Tagalakis V., Bouchard-Duchene V. Venous thromboembolism (VTE) prophylaxis - Symptoms, diagnosis and treatment | BMJ Best Practice US. 2017.
- Хороненко В.Э., Чиссов В.И., Суворин П.А. Периоперационная профилактика венозных тромбоэмболических осложнений в плановой онкохирургии // Res. Pract. Med. J. Общество с ограниченной ответственностью «КВАЗАР», 2016. Vol. 3, № 4.
- Kim S.M. et al. Risk factors for post-operative venous thromboembolism in patients with a malignancy of the lower limb. // Bone Joint J. 2013. Vol. 95-B, № 4. P. 558–562.
- Morii T., Mochizuki K., Tajima T. Venous thromboembolism in the management of patients with musculoskeletal tumor // J. Orthop. Sci. Springer Tokyo, 2010. Vol. 15, № 6. P. 810–815.
- Nathan S.S. et al. Proximal deep vein thrombosis after hip replacement for oncologic indications. // J. Bone Joint Surg. Am. LWW, 2006. Vol. 88, № 5. P. 1066–1070.
- Ruggieri P. et al. Clinically significant thromboembolic disease in orthopedic oncology: An analysis of 986 patients treated with low-molecular-weight heparin // J. Surg. Oncol. Wiley Online Library, 2010. Vol. 102, № 5. P. 375–379.
- Patel A.R. et al. Aspirin and compression devices versus low-molecular-weight heparin and PCD for VTE prophylaxis in orthopedic oncology patients. // J. Surg. Oncol. Wiley Online Library, 2010. Vol. 102, № 3. P. 276–281.
- Singh V.A., Yong L.M., Vijayananthan A. Is DVT prophylaxis necessary after oncology lower limb surgery? A pilot study. // Springerplus. SpringerOpen, 2016. Vol. 5, № 1. P. 943.
- Carrier M. et al. Systematic review: the Trousseau syndrome revisited: should we screen extensively for cancer in patients with venous thromboembolism? // Ann. Intern. Med. American College of Physicians, 2008. Vol. 149, № 5. P. 323–333.
- Watson H.G., Keeling D.M., Laffan M. Guideline on aspects of cancer-related venous thrombosis // Br. J. Haematol. 2015. Vol. 170, № 5. P. 640–648.
- Kaiser C.L. et al. Predictors of venous thromboembolism in patients with primary sarcoma of bone. // Surg. Oncol. Elsevier, 2017. Vol. 26, № 4. P. 506–510.
- Mitchell S.Y. et al. Venous thromboembolism in patients with primary bone or soft-tissue sarcomas. // J. Bone Joint Surg. Am. LWW, 2007. Vol. 89, № 11. P. 2433–2439.
- Ramo B.A. et al. Incidence of symptomatic venous thromboembolism in oncologic patients undergoing lower-extremity endoprosthetic arthroplasty. // J. Bone Joint Surg. Am. LWW, 2011. Vol. 93, № 9. P. 847–854.
- Yamaguchi T. et al. Deep-vein thrombosis after resection of musculoskeletal tumours of the lower limb // Bone Joint J. 2013. Vol. 95-B, № 9. P. 1280–1284.
- Cardiovascular Disease Educational and Research Trust et al. Prevention and treatment of venous thromboembolism: international consensus statement (guidelines according to scientific evidence). // Clin. Appl. Thromb. Hemost. SAGE Publications Sage CA: Los Angeles, CA, 2013. Vol. 19, № 2. P. 116–118.
- Gould M.K. et al. Prevention of VTE in nonorthopedic surgical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. // Chest. Elsevier, 2012. Vol. 141, № 2 Suppl. P. e227S-e277S.
- Takvorian K. Should Combined Hormonal Contraception Be Stopped in the Perioperative Period? // NEJM Evid. Massachusetts Medical Society, 2022. Vol. 1, № 1. P. EVIDtt2100050.
- Nicolaides A.N. Prevention of deep vein thrombosis. // Geriatrics. 1973. Vol. 28, № 2. P. 69–77.
- Amin A.N., Girard F., Samama M.M. Does ambulation modify venous thromboembolism risk in acutely ill medical patients? // Thromb. Haemost. Schattauer GmbH, 2010. Vol. 104, № 5. P. 955–961.
- Machin M. et al. Systematic review on the benefit of graduated compression stockings in the prevention of venous thromboembolism in low-risk surgical patients. // Phlebology. SAGE Publications Sage UK: London, England, 2021. Vol. 36, № 3. P. 184–193.
- Shalhoub J. et al. Graduated compression stockings as adjuvant to pharmaco-thromboprophylaxis in elective surgical patients (GAPS study): randomised controlled trial. // BMJ. British Medical Journal Publishing Group, 2020. Vol. 369. P. m1309.
- Collins R. et al. Reduction in fatal pulmonary embolism and venous thrombosis by perioperative administration of subcutaneous heparin. Overview of results of randomized trials in general, orthopedic, and urologic surgery. // N. Engl. J. Med. 1988. Vol. 318, № 18. P. 1162–1173.
- Wille-Jørgensen P. et al. Heparins and mechanical methods for thromboprophylaxis in colorectal surgery. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2003. № 4. P. CD001217.
- Kakkos S. et al. Combined intermittent pneumatic leg compression and pharmacological prophylaxis for prevention of venous thromboembolism // Cochrane Database Syst. Rev. John Wiley & Sons, Ltd, 2022. Vol. 2022, № 1. P. CD005258.
- Hajibandeh S. et al. Neuromuscular electrical stimulation for the prevention of venous thromboembolism. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2017. Vol. 11, № 11. P. CD011764.
- Lobastov K. et al. Electrical calf muscle stimulation with Veinoplus device in postoperative venous thromboembolism prevention. // Int. Angiol. 2014. Vol. 33, № 1. P. 42–49.
- Lobastov K. et al. Intermittent Pneumatic Compression in Addition to Standard Prophylaxis of Postoperative Venous Thromboembolism in Extremely High-risk Patients (IPC SUPER): A Randomized Controlled Trial. // Ann. Surg. LWW, 2021. Vol. 274, № 1. P. 63–69.
- Баринов В.Е., Лобастов К.В., Бояринцев В.В. Повышенные дозы гепарина в профилактике послеоперационных венозных тромбоэмболий у пациентов с высоким риском их развития: эффективность и безопасность // Современные проблемы науки и образования. Общество с ограниченной ответственностью" Издательский Дом" Академия …, 2013. № 6. P. 579.
- Wall V. et al. Anti-Factor Xa measurements in acute care surgery patients to examine enoxaparin dose. // Am. J. Surg. Elsevier, 2018. Vol. 216, № 2. P. 222–229.
- Pannucci C.J. et al. Assessment of Anti-Factor Xa Levels of Patients Undergoing Colorectal Surgery Given Once-Daily Enoxaparin Prophylaxis: A Clinical Study Examining Enoxaparin Pharmacokinetics. // JAMA Surg. American Medical Association, 2019. Vol. 154, № 8. P. 697–704.
- Pannucci C.J. et al. Enoxaparin 40 mg per Day Is Inadequate for Venous Thromboembolism Prophylaxis After Thoracic Surgical Procedure. // Ann. Thorac. Surg. Elsevier, 2018. Vol. 106, № 2. P. 404–411.
- Pannucci C.J. et al. Inadequate Enoxaparin Dosing Predicts 90-Day Venous Thromboembolism Risk among Plastic Surgery Inpatients: An Examination of Enoxaparin Pharmacodynamics. // Plast. Reconstr. Surg. LWW, 2017. Vol. 139, № 4. P. 1009–1020.
- Khoursheed M. et al. Therapeutic effect of low-molecular weight heparin and incidence of lower limb deep venous thrombosis and pulmonary embolism after laparoscopic bariatric surgery. // Surg. Laparosc. Endosc. Percutan. Tech. LWW, 2013. Vol. 23, № 6. P. 491–493.
- Rowan B.O. et al. Anti-Xa levels in bariatric surgery patients receiving prophylactic enoxaparin. // Obes. Surg. Springer, 2008. Vol. 18, № 2. P. 162–166.
- Faraklas I. et al. Evaluation of an enoxaparin dosing calculator using burn size and weight. // J. Burn Care Res. Oxford University Press, 2013. Vol. 34, № 6. P. 621–627.
- Pannucci C.J. et al. Optimal Dosing of Prophylactic Enoxaparin after Surgical Procedures: Results of the Double-Blind, Randomized, Controlled FIxed or Variable Enoxaparin (FIVE) Trial. // Plast. Reconstr. Surg. LWW, 2021. Vol. 147, № 4. P. 947–958.
- Pannucci C.J., Rondina M.T. Should we be following anti-factor Xa levels in patients receiving prophylactic enoxaparin perioperatively? // Surgery. Elsevier, 2017. Vol. 161, № 2. P. 329–331.
- Fareed J. et al. Pharmacodynamic and pharmacokinetic properties of enoxaparin : implications for clinical practice. // Clin. Pharmacokinet. Springer, 2003. Vol. 42, № 12. P. 1043–1057.
- Feng J.-P. et al. Efficacy of intermittent pneumatic compression for venous thromboembolism prophylaxis in patients undergoing gynecologic surgery: A systematic review and meta-analysis. // Oncotarget. Impact Journals, LLC, 2017. Vol. 8, № 12. P. 20371–20379.
- Morris R.J., Woodcock J.P. Intermittent pneumatic compression or graduated compression stockings for deep vein thrombosis prophylaxis? A systematic review of direct clinical comparisons. // Ann. Surg. LWW, 2010. Vol. 251, № 3. P. 393–396.
- Rahn D.D. et al. Venous thromboembolism prophylaxis in gynecologic surgery: a systematic review. // Obstet. Gynecol. LWW, 2011. Vol. 118, № 5. P. 1111–1125.
- O’Connell S. et al. The Use of Intermittent Pneumatic Compression in Orthopedic and Neurosurgical Postoperative Patients: A Systematic Review and Meta-analysis. // Ann. Surg. Wolters Kluwer, 2016. Vol. 263, № 5. P. 888–889.
- Zareba P. et al. Meta-analysis of randomized trials comparing combined compression and anticoagulation with either modality alone for prevention of venous thromboembolism after surgery. // Br. J. Surg. Oxford University Press, 2014. Vol. 101, № 9. P. 1053–1062.
- Pavon J.M. et al. Effectiveness of Intermittent Pneumatic Compression Devices for Venous Thromboembolism Prophylaxis in High-Risk Surgical Patients: A Systematic Review. // J. Arthroplasty. Elsevier, 2016. Vol. 31, № 2. P. 524–532.
- Sobieraj D.M., Coleman C.I., Tongbram V. Comparative effectiveness of combined pharmacologic and mechanical thromboprophylaxis versus either method alone in major orthopedic surgery: a systematic review and meta‐analysis // Pharmacother. J. Hum. Pharmacol. Drug Ther. Wiley Online Library, 2013. Vol. 33, № 3. P. 275–283.
- Haut E.R. et al. The effectiveness of prophylactic inferior vena cava filters in trauma patients: a systematic review and meta-analysis. // JAMA Surg. American Medical Association, 2014. Vol. 149, № 2. P. 194–202.
- Kaw R. et al. Inferior vena cava filters and postoperative outcomes in patients undergoing bariatric surgery: a meta-analysis. // Surg. Obes. Relat. Dis. Elsevier, 2014. Vol. 10, № 4. P. 725–733.
- Hull R.D. et al. Extended out-of-hospital low-molecular-weight heparin prophylaxis against deep venous thrombosis in patients after elective hip arthroplasty: a systematic review. // Ann. Intern. Med. American College of Physicians, 2001. Vol. 135, № 10. P. 858–869.
- Eikelboom J.W., Quinlan D.J., Douketis J.D. Extended-duration prophylaxis against venous thromboembolism after total hip or knee replacement: a meta-analysis of the randomised trials. // Lancet (London, England). Elsevier, 2001. Vol. 358, № 9275. P. 9–15.
- Huo M.H., Muntz J. Extended thromboprophylaxis with low-molecular-weight heparins after hospital discharge in high-risk surgical and medical patients: a review. // Clin. Ther. Elsevier, 2009. Vol. 31, № 6. P. 1129–1141.
- Lu X., Lin J. Low molecular weight heparin versus other anti-thrombotic agents for prevention of venous thromboembolic events after total hip or total knee replacement surgery: a systematic review and meta-analysis. // BMC Musculoskelet. Disord. Springer, 2018. Vol. 19, № 1. P. 322.
- Milinis K. et al. The effectiveness of graduated compression stockings for prevention of venous thromboembolism in orthopedic and abdominal surgery patients requiring extended pharmacologic thromboprophylaxis. // J. Vasc. surgery. Venous Lymphat. Disord. Elsevier, 2018. Vol. 6, № 6. P. 766-777.e2.
- Ockelford P.A., Patterson J., Johns A.S. A double-blind randomized placebo controlled trial of thromboprophylaxis in major elective general surgery using once daily injections of a low molecular weight heparin fragment (Fragmin). // Thromb. Haemost. Schattauer GmbH, 1989. Vol. 62, № 4. P. 1046–1049.
- Pezzuoli G. et al. Prophylaxis of fatal pulmonary embolism in general surgery using low-molecular weight heparin Cy 216: a multicentre, double-blind, randomized, controlled, clinical trial versus placebo (STEP). STEP-Study Group. // Int. Surg. 1989. Vol. 74, № 4. P. 205–210.
- Bergqvist D. et al. Thromboprophylaxis with a low molecular weight heparin (tinzaparin) in emergency abdominal surgery. A double-blind multicenter trial. // Vasa. 1996. Vol. 25, № 2. P. 156–160.
- Barbui T., Cassinelli G., Cortelazzo S. Comparison of low molecular weight heparin CY 216 and unfractionated heparin in preventing post-operative venous thromboembolism in general surgery: a preliminary results of a cooperative study // Fibrinolysis. Churchill Livingstone, 1990. Vol. 4. P. 79.
- Ceccato D. et al. Weight-adjusted versus fixed dose heparin thromboprophylaxis in hospitalized obese patients: A systematic review and meta-analysis. // Eur. J. Intern. Med. Elsevier, 2021. Vol. 88. P. 73–80.
- Хитарьян А.Г. et al. Новый подход к эффективной профилактике венозных тромбоэмболических осложнений в бариатрической хирургии: опыт одного центра. // Флебология. 2020. Vol. 14, № 4.
- Kolluri R. et al. A randomized study of the safety and efficacy of fondaparinux versus placebo in the prevention of venous thromboembolism after coronary artery bypass graft surgery. // Am. Heart J. Elsevier, 2016. Vol. 171, № 1. P. 1–6.
- Spebar M.J. et al. Perioperative heparin prophylaxis of deep venous thrombosis in patients with peripheral vascular disease. // Am. J. Surg. Elsevier, 1981. Vol. 142, № 6. P. 649–650.
- Murakami M. et al. External pneumatic compression does not increase urokinase plasminogen activator after abdominal surgery. // J. Vasc. Surg. Elsevier, 2002. Vol. 36, № 5. P. 917–921.
- Toth S. et al. A meta-analysis and systematic review of venous thromboembolism prophylaxis in patients undergoing vascular surgery procedures. // J. Vasc. surgery. Venous Lymphat. Disord. Elsevier, 2020. Vol. 8, № 5. P. 869-881.e2.
- Ho K.M., Bham E., Pavey W. Incidence of Venous Thromboembolism and Benefits and Risks of Thromboprophylaxis After Cardiac Surgery: A Systematic Review and Meta-Analysis. // J. Am. Heart Assoc. Am Heart Assoc, 2015. Vol. 4, № 10. P. e002652.
- Baca I. et al. [Prevention of thromboembolism in minimal invasive interventions and brief inpatient treatment. Results of a multicenter, prospective, randomized, controlled study with a low molecular weight heparin]. // Chirurg. 1997. Vol. 68, № 12. P. 1275–1280.
- Borstad E. et al. Comparison of low molecular weight heparin vs. unfractionated heparin in gynecological surgery. II: Reduced dose of low molecular weight heparin. // Acta Obstet. Gynecol. Scand. Wiley Online Library, 1992. Vol. 71, № 6. P. 471–475.
- Boncinelli S. et al. Haemostatic molecular markers in patients undergoing radical retropubic prostatectomy for prostate cancer and submitted to prophylaxis with unfractioned or low molecular weight heparin. // Minerva Anestesiol. 2001. Vol. 67, № 10. P. 693–703.
- Bounameaux H. et al. Antithrombotic prophylaxis in patients undergoing laparoscopic cholecystectomy. // Thromb. Res. 1997. Vol. 86, № 3. P. 271–273.
- Pannucci C.J. et al. Benefits and Risks of Prophylaxis for Deep Venous Thrombosis and Pulmonary Embolus in Plastic Surgery: A Systematic Review and Meta-Analysis of Controlled Trials and Consensus Conference. // Plast. Reconstr. Surg. LWW, 2016. Vol. 137, № 2. P. 709–730.
- Schünemann H.J. et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: prophylaxis for hospitalized and nonhospitalized medical patients. // Blood Adv. American Society of Hematology Washington, DC, 2018. Vol. 2, № 22. P. 3198–3225.
- CLOTS Trials Collaboration et al. Effectiveness of thigh-length graduated compression stockings to reduce the risk of deep vein thrombosis after stroke (CLOTS trial 1): a multicentre, randomised controlled trial. // Lancet (London, England). Elsevier, 2009. Vol. 373, № 9679. P. 1958–1965.
- Muir K.W. et al. Randomized trial of graded compression stockings for prevention of deep-vein thrombosis after acute stroke. // QJM. Oxford University Press, 2000. Vol. 93, № 6. P. 359–364.
- CLOTS (Clots in Legs Or sTockings after Stroke) Trials Collaboration et al. Effectiveness of intermittent pneumatic compression in reduction of risk of deep vein thrombosis in patients who have had a stroke (CLOTS 3): a multicentre randomised controlled trial // Lancet. Elsevier, 2013. Vol. 382, № 9891. P. 516–524.
- CLOTS (Clots in Legs Or sTockings after Stroke) Trials Collaboration. Effect of intermittent pneumatic compression on disability, living circumstances, quality of life, and hospital costs after stroke: secondary analyses from CLOTS 3, a randomised trial. // Lancet. Neurol. Elsevier, 2014. Vol. 13, № 12. P. 1186–1192.
- Spinelli M., Corea F., Bignamini V. Early vital and functional outcome of acute ischaemic stroke patients: influence of deep vein thrombosis prevention with pneumatic compression devices // J. Neurol. DR DIETRICH STEINKOPFF VERLAG PO BOX 10 04 62, D-64204 DARMSTADT, GERMANY, 2006. Vol. 253. P. 135.
- Group I.S.T.C. The International Stroke Trial (IST): a randomised trial of aspirin, subcutaneous heparin, both, or neither among 19435 patients with acute ischaemic stroke. International Stroke Trial Collaborative Group. // Lancet (London, England). Elsevier, 1997. Vol. 349, № 9065. P. 1569–1581.
- Kay R. et al. Low-molecular-weight heparin for the treatment of acute ischemic stroke. // N. Engl. J. Med. Mass Medical Soc, 1995. Vol. 333, № 24. P. 1588–1593.
- Elias A. et al. [Prevention of deep venous thrombosis of the leg by a very low molecular weight heparin fraction (CY 222) in patients with hemiplegia following cerebral infarction: a randomized pilot study (30 patients)]. // La Rev. Med. interne. 1990. Vol. 11, № 1. P. 95–98.
- Kwiecinski H., Pniewski J., Kaminska A. A randomized trial of fraxiparine in acute ischemic stroke // Cerebrovasc Dis. 1995. Vol. 5. P. 234.
- Hommel M. Fraxiparine in Ischaemic Stroke Study. FISS bis investigators group // Cerebrovasc Dis. 1998. Vol. 8, № suppl 4. P. S19.
- Chaudhry H., Yadav K., Dubey S. Low molecular weight heparin in acute ischemic stroke // Antiseptic. 2002. Vol. 99. P. 31–32.
- McCarthy S.T. et al. Low-dose heparin as a prophylaxis against deep-vein thrombosis after acute stroke. // Lancet (London, England). Elsevier, 1977. Vol. 2, № 8042. P. 800–801.
- McCarthy S.T., Turner J. Low-dose subcutaneous heparin in the prevention of deep-vein thrombosis and pulmonary emboli following acute stroke. // Age Ageing. Oxford University Press, 1986. Vol. 15, № 2. P. 84–88.
- Duke R.J., Turpie A.G.G., Bloch R.F. Cerebrovascular disease. 1983.
- Orken D.N. et al. Prevention of Deep Venous Thrombosis and Pulmonary Embolism in Patients With Acute Intracerebral Hemorrhage // Neurologist. LWW, 2009. Vol. 15, № 6. P. 329–331.
- Zubkov A.Y., Wijdicks E.F.M. Deep venous thrombosis prophylaxis in cerebral hemorrhage // Rev. Neurol. Dis. 2009. Vol. 6, № 1. P. 21–25.
- Sherman D.G. et al. The efficacy and safety of enoxaparin versus unfractionated heparin for the prevention of venous thromboembolism after acute ischaemic stroke (PREVAIL Study): an open-label randomised comparison. // Lancet (London, England). Elsevier, 2007. Vol. 369, № 9570. P. 1347–1355.
- Turpie A.G. et al. A low-molecular-weight heparinoid compared with unfractionated heparin in the prevention of deep vein thrombosis in patients with acute ischemic stroke. A randomized, double-blind study. // Ann. Intern. Med. American College of Physicians, 1992. Vol. 117, № 5. P. 353–357.
- Dumas R. et al. A multicentre, double-blind, randomized study to compare the safety and efficacy of once-daily ORG 10172 and twice-daily low-dose heparin in preventing deep-vein thrombosis in patients with acute ischaemic stroke. // Age Ageing. Oxford University Press, 1994. Vol. 23, № 6. P. 512–516.
- Diener H.-C. et al. Prophylaxis of thrombotic and embolic events in acute ischemic stroke with the low-molecular-weight heparin certoparin: results of the PROTECT Trial. // Stroke. Am Heart Assoc, 2006. Vol. 37, № 1. P. 139–144.
- Ageno W. et al. Nadroparin for the prevention of venous thromboembolism in nonsurgical patients: a systematic review and meta-analysis. // J. Thromb. Thrombolysis. Springer, 2016. Vol. 42, № 1. P. 90–98.
- Alikhan R., Forster R., Cohen A.T. Heparin for the prevention of venous thromboembolism in acutely ill medical patients (excluding stroke and myocardial infarction) // Cochrane Database Syst. Rev. John Wiley & Sons, Ltd, 2014. Vol. 2018, № 2. P. CD003747.
- Dentali F. et al. Meta-analysis: anticoagulant prophylaxis to prevent symptomatic venous thromboembolism in hospitalized medical patients. // Ann. Intern. Med. American College of Physicians, 2007. Vol. 146, № 4. P. 278–288.
- Bump G.M. et al. How complete is the evidence for thromboembolism prophylaxis in general medicine patients? A meta-analysis of randomized controlled trials. // J. Hosp. Med. Wiley Online Library, 2009. Vol. 4, № 5. P. 289–297.
- André C., de Freitas G.R., Fukujima M.M. Prevention of deep venous thrombosis and pulmonary embolism following stroke: a systematic review of published articles // Eur. J. Neurol. Wiley Online Library, 2007. Vol. 14, № 1. P. 21–32.
- Fernando S.M. et al. VTE Prophylaxis in Critically Ill Adults: A Systematic Review and Network Meta-analysis. // Chest. Elsevier, 2022. Vol. 161, № 2. P. 418–428.
- Sandercock P.A.G., Counsell C., Kane E.J. Anticoagulants for acute ischaemic stroke. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2015. Vol. 2015, № 3. P. CD000024.
- Själander A. et al. Efficacy and safety of anticoagulant prophylaxis to prevent venous thromboembolism in acutely ill medical inpatients: a meta-analysis. // J. Intern. Med. Wiley Online Library, 2008. Vol. 263, № 1. P. 52–60.
- Sandercock P.A., Leong T.S. Low-molecular-weight heparins or heparinoids versus standard unfractionated heparin for acute ischaemic stroke. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2017. Vol. 4, № 4. P. CD000119.
- Wein L. et al. Pharmacological venous thromboembolism prophylaxis in hospitalized medical patients: a meta-analysis of randomized controlled trials. // Arch. Intern. Med. American Medical Association, 2007. Vol. 167, № 14. P. 1476–1486.
- Lloyd N.S. et al. Anticoagulant prophylaxis to prevent asymptomatic deep vein thrombosis in hospitalized medical patients: a systematic review and meta-analysis. // J. Thromb. Haemost. Wiley Online Library, 2008. Vol. 6, № 3. P. 405–414.
- Kanaan A.O. et al. Meta-analysis of venous thromboembolism prophylaxis in medically Ill patients. // Clin. Ther. Elsevier, 2007. Vol. 29, № 11. P. 2395–2405.
- Kamphuisen P.W., Agnelli G. What is the optimal pharmacological prophylaxis for the prevention of deep-vein thrombosis and pulmonary embolism in patients with acute ischemic stroke? // Thromb. Res. Elsevier, 2007. Vol. 119, № 3. P. 265–274.
- Eikelboom J.W. Effect of fondaparinux 2.5 mg once daily on mortality: a meta-analysis of phase III randomized trials of venous thromboembolism prevention // Eur. Hear. J. Suppl. Oxford University Press, 2008. Vol. 10, № suppl_C. P. C8–C13.
- Zhang C. et al. [The efficacy of intermittent pneumatic compression in the prevention of venous thromboembolism in medical critically ill patients]. // Zhongguo Wei Zhong Bing Ji Jiu Yi Xue. 2011. Vol. 23, № 9. P. 563–565.
- Smyth R.M.D., Aflaifel N., Bamigboye A.A. Interventions for varicose veins and leg oedema in pregnancy. // Cochrane database Syst. Rev. John Wiley & Sons, Ltd, 2015. Vol. 2015, № 10. P. CD001066.
- Malgor RD, Gasparis AP, Labropoulos N. Morbidity and mortality after thermal venous ablations. Int Angiol. 2016 Feb;35(1):57-61. PMID: 25673309.
- den Heijer M, Lewington S, Clarke R. Homocysteine, MTHFR and risk of venous thrombosis: a meta-analysis of published epidemiological studies. J Thromb Haemost. 2005;3(2):292–299.
- Ray JG. Meta-analysis of hyperhomocysteinemia as a risk factor for venous thromboembolic disease. Arch Intern Med. 1998;158(19):2101–2106.
- den Heijer M, Rosendaal FR, Blom HJ, et al. Hyperhomocysteinemia and venous thrombosis: a meta-analysis. Thromb Haemost. 1998;80(6):874–877.
- Undas A, Brozek J, Szczeklik A. Homocysteine and thrombosis: from basic science to clinical evidence. Thromb Haemost. 2005 Nov;94(5):907-15. doi: 10.1160/TH05-05-0313. PMID: 16363230.
- Ray JG. Hyperhomocysteinemia: no longer a consideration in the management of venous thromboembolism. Curr Opin Pulm Med. 2008;14(5):369–373.
- den Heijer M, Willems HP, Blom HJ, et al. Homocysteine lowering by B vitamins and the secondary prevention of deep vein thrombosis and pulmonary embolism: a randomized, placebo-controlled, double-blind trial. Blood. 2007;109(1):139–144.
- Ray JG, Kearon C, Yi Q, et al. Homocysteine-lowering therapy and risk for venous thromboembolism: a randomized trial. Ann Intern Med. 2007;146(11):761–767.
- Vučković BA, van Rein N, Cannegieter SC, et al. Vitamin supplementation on the risk of venous thrombosis: results from the MEGA case-control study. Am J Clin Nutr. 2015;101(3):606–612.
- Ospina-Romero M, Cannegieter SC, den Heijer M, Doggen CJM, Rosendaal FR, Lijfering WM. Hyperhomocysteinemia and Risk of First Venous Thrombosis: The Influence of (Unmeasured) Confounding Factors. Am J Epidemiol. 2018 Jul 1;187(7):1392-1400. doi: 10.1093/aje/kwy004. PMID: 29370361.
- Wu O, Robertson L, Twaddle S, Lowe GD, Clark P, Greaves M, Walker ID, Langhorne P, Brenkel I, Regan L, Greer I. Screening for thrombophilia in high-risk situations: systematic review and cost-effectiveness analysis. The Thrombosis: Risk and Economic Assessment of Thrombophilia Screening (TREATS) study. Health Technol Assess. 2006 Apr;10(11):1-110. doi: 10.3310/hta10110. PMID: 16595080.
Приложения А1, А2 (состав рабочей группы, методология)
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
- Апханова Т.В., к.м.н., член Российского кардиологического общества (РКО), член Европейского общества кардиологов (ESC), член Американского вено-лимфатического общества (American Vein and Lymphatic Society, USA)
- Ахметзянов Р.В., д.м.н., член Ассоциации флебологов России (АФР), член Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Российского общества хирургов (РОХ)
- Ахтямов И.Ф., д.м.н., профессор, член ассоциации травматологов-ортопедов России (АТОР), член международного общества травматологов-ортопедов (SICOT)
- Баринов В.Е., д.м.н., доцент, член Ассоциации флебологов России (АФР), член Европейского Венозного Форума (EVF), член Американского Венозного Форума (AVF), член Европейского общества сосудистых хирургов (ESVS)
- Бахметьев А.С., к.м.н., член Ассоциации флебологов России (АФР)
- Белов М. В., к.м.н., член ассоциации травматологов-ортопедов России (АТОР)
- Бобров С. А. к.м.н., член Российского общества акушер-гинекологов (РОАГ)
- Божкова С.А., д.м.н., член научного комитета международной ассоциации против инфекции в ортопедии и травматологии (WAIOT), член Межрегиональной ассоциации клинической микробиологии и антимикробной химиотерапии (МАКМАХ)
- Бредихин Р.А., д.м.н., член Ассоциации флебологов России (АФР), исполнительный секретарь общества флебологов Республики Татарстан, член Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Европейского общества сосудистых хирургов (ESVS)
- Булатов В.Л., к.м.н., член Ассоциации флебологов России (АФР)
- Вавилова Татьяна Владимировна – д.м.н., профессор, член Российского кардиологического общества (РКО), член международного общества по тромбозам и гемостазу (ISTH)
- Варданян А.В., д.м.н., доцент, член Российского общества хирургов (РОХ)
- Воробьева Н.А., д.м.н., профессор, заслуженный врач РФ, член правления Национальная ассоциация специалистов по тромбозам, клинической гемостазиологии и гемореологии (НАТГ)
- Гаврилов Е.К., д.м.н., член Ассоциации флебологов России (АФР)
- Гаврилов С.Г., д.м.н., доцент, член Ассоциации флебологов России (АФР)
- Головина В.И., член Ассоциации флебологов России (АФР), Engagement working group International Union of Phlebology
- Горин А.С., член Ассоциации флебологов России (АФР)
- Дженина О.В., член Ассоциации флебологов России (АФР)
- Дианов С.В., д.м.н., профессор, заслуженный врач РФ, член ассоциации травматологов-ортопедов России (АТОР), член международного общества травматологов-ортопедов (SICOT)
- Ефремова О.И., к.м.н., член Ассоциации флебологов России (АФР)
- Жуковец В.В., к.м.н., член Ассоциации флебологов России (АФР)
- Замятин М. Н., д.м.н., профессор, заслуженный врач РФ
- Золотухин И.А., д.м.н., профессор, профессор РАН, исполнительный секретарь Ассоциации флебологов России (АФР)
- Игнатьев И.А., член Ассоциации флебологов России (АФР)
- Илюхин Е.А., к.м.н., вице-президент Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ)
- Калинин Р.Е., д.м.н., профессор, член Исполнительного совета Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ), член правления Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Ассоциации сердечно-сосудистых хирургов России (АССХ), член Европейского общества сосудистых хирургов (ESVS)
- Камаев А.А., к.м.н., член Научного совета Ассоциации флебологов России (АФР), Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Европейского общества сосудистых хирургов (ESVS)
- Каплунов О.А. д.м.н., член ассоциации травматологов-ортопедов России (АТОР)
- Каримова Г.Н. к.м.н., член Российского общества акушер-гинекологов (РОАГ)
- Карпенко А.А., д.м.н., член Ассоциации флебологов России (АФР), член Российского общества ангиологов и сосудистых хирургов (РОАиСХ)
- Касимова А.Р. к.м.н.
- Кательницкая О.В., к.м.н., член Ассоциации флебологов России (АФР), член Российского общества ангиологов и сосудистых хирургов (РОАиСХ)
- Кательницкий И.И., д.м.н., доцент, член Ассоциации флебологов России (АФР)
- Каторкин С.Е., д.м.н., доцент, член Исполнительного совета Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ).
- Кириенко А.И., д.м.н., академик РАМН, академик РАН, почетный президент Ассоциации флебологов России (АФР), вице-президент Российского общества хирургов (РОХ), член президиума Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член совета Европейского общества сосудистых хирургов (ESVS), лауреат Государственной премии РФ, премии Правительства РФ, премий имени академика А.Н. Бакулева и имени академика Е.Н. Мешалкина;
- Князев Р. И., к.м.н., член Российского общества клинической онкологии (RUSSCO), общества специалистов-онкологов по опухолям органов репродуктивной системы (ОСОРС), International Gynecological Cancer Society (IGCS).
- Кончугова Т.В. – д.м.н., проф., член Национальной Ассоциации экспертов по санаторно-курортному лечению
- Копенкин С.С., к.м.н., член ассоциации травматологов-ортопедов России (АТОР)
- Кошевой А.П., д.м.н., член Ассоциации флебологов России (АФР)
- Кравцов П.Ф., к.м.н., член Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ)
- Крылов А.Ю., д.м.н., профессор, член Исполнительного совета Ассоциации флебологов России (АФР), член Российского общества ангиологов и сосудистых хирургов (РОАиСХ)
- Кульчицкая Д.Б. - д.м.н., проф., член Национальной Ассоциации экспертов по санаторно-курортному лечению
- Лаберко Л.А., д.м.н., доцент, член Ассоциации флебологов России (АФР)
- Лебедев И.С., д.м.н., доцент, член Российского общества хирургов (РОХ)
- Лобастов К.В., к.м.н., член Ассоциации флебологов России (АФР), European Venous Forum (EVF), International Union of Angiology (IUA);
- Маланин Д.А. д.м.н., профессор, член ассоциации травматологов-ортопедов России (АТОР), член Российской ассоциации ортопедов (РАО), международного общества хирургии колена и артроскопии (ESSKA)
- Матюшкин А.В., д.м.н., профессор, член Российского общества ангиологов и сосудистых хирургов (РОАиСХ)
- Мжаванадзе Н.Д., к.м.н., член Ассоциации флебологов России (АФР), Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Европейского общества сосудистых хирургов (ESVS).
- Моисеев С.В., д.м.н., член президиума Научного общества Нефрологов России (НОНР); член президиума Ассоциации ревматологов России (АРР).
- Муштин Н.Е. к.м.н., член ассоциации травматологов-ортопедов России (АТОР)
- Николаева М.Г. д.м.н., доцент, член Российского общества акушер-гинекологов (РОАГ)
- Пелевин А.В., член Ассоциации флебологов России (АФР)
- Петриков А.С., д.м.н., доцент, член Исполнительного совета Ассоциации флебологов России (АФР)
- Пирадов М.А., д.м.н., академик РАН, член Президиума Правления Всероссийского общества неврологов, член Правления Федерации анестезиологов-реаниматологов России (ФАРР)
- Пиханова Ж.М., к.м.н., член Ассоциации флебологов России (АФР)
- Поддубная И.В, д.м.н., академик РАН, председатель Российского общества онкогематологов (РОО (Общество онкогематологов)).
- Порембская О.Я., к.м.н., член Ассоциации флебологов России (АФР), член Европейского Венозного Форума (EVF)
- Потапов М.П., к.м.н., член Ассоциации флебологов России (АФР), член Российского общества ангиологов и сосудистых хирургов (РОАиСХ)
- Пырегов А.В. д.м.н., профессор, председатель комитета по анестезиологии и реаниматологии в акушерстве и гинекологии ассоциации анестезиологов-реаниматологов (ААР)
- Рачин А.П. – д.м.н., проф., учредитель Российского общества по изучению головной боли, Президент Национальной ассоциации экспертов по коморбидной неврологии, член межрегионального общества «Северо-Западное общество по изучению боли»
- Рогачевский О. В. д.м.н., член правления Московского общества гемафереза, член правления Российского общества акушеров-гинекологов (РОАГ), член международного общества переливания крови (ISBT), член Европейской ассоциации анестезиологов (ЕSA)
- Рябинкина Ю.В., д.м.н., член Всероссийского общества неврологов
- Сапелкин С.В., д.м.н., член Ассоциации флебологов России (АФР), член Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Американского Венозного Форума (AVF), член Европейского общества сосудистых хирургов (ESVS)
- Селиверстов Е.И., д.м.н., член Ассоциации флебологов России (АФР)
- Сонькин И.Н., член Ассоциации флебологов России (АФР), Ассоциации сердечно-сосудистых хирургов России (АССХ)
- Сорока В.В., д.м.н., профессор, заслуженный врач РФ
- Стойко Ю.М., д.м.н., профессор, заслуженный врач РФ, заслуженный деятель науки РФ, лауреат премии Правительства РФ, почетный президент Ассоциации флебологов России (АФР), член правления Российского общества ангиологов и сосудистых хирургов (РОАиСХ), почетный член Европейского Венозного Форума (EVF)
- Сучков И.А., д.м.н., профессор, президент Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ); член Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Ассоциации сердечно-сосудистых хирургов России (АССХ), член Европейского общества сосудистых хирургов (ESVS)
- Сушков С.А., к.м.н., доцент, член Ассоциации флебологов России (АФР)
- Счастливцев И.В., к.м.н., доцент, член Ассоциации флебологов России (АФР), European Venous Forum (EVF), Российского общества хирургов (РОХ), Ассоциации специалистов по тромбозам, клинической гемостазиологии и гемореологии (НАТГ)
- Тихилов Р. М., д.м.н., профессор, вице-президент ассоциации травматологов-ортопедов России (АТОР), член европейского общества тазобедренного сустава (EHS), член международного общества тазобедренного сустава (IHS)
- Трякин А.А., д.м.н., член Российского общество клинических онкологов (RUSSCO)
- Фокин А.А., д.м.н., профессор, член Ассоциации флебологов России (АФР), член Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член правления Европейского общества сосудистых хирургов (ESVS)
- Хороненко В.Э., д.м.н., член Российского общества клинической онкологии (RUSSCO)
- Хруслов М. В. к.м.н.
- Цатурян А.Б., член Ассоциации флебологов России (АФР)
- Цед А.Н. д.м.н., член ассоциации травматологов-ортопедов России (АТОР), член общества травматологов АО Травма Россия
- Черкашин М.А., член Ассоциации флебологов России (АФР), European Society of Medical Oncology, European Society of Radiology
- Чечулова А.В., к.м.н.
- Чуйко С.Г., к.м.н., член Ассоциации флебологов России (АФР)
- Шмаков Р.Г. д.м.н., профессор РАН, член президиума правления Российского общества акушер-гинекологов (РОАГ), член международного общества по изучению рака во время беременности (INCIP)
- Явелов И.С., д.м.н., член правления Российского кардиологического общества (РКО), член правления Общества специалистов по неотложной кардиологии
- Яшкин М.Н., к.м.н., член Ассоциации флебологов России (АФР), член Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Российского общества хирургов (РОХ), член Европейского Венозного Форума (EVF), член Европейского общества сосудистых хирургов (ESVS)
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки или другого конфликта интересов при составлении данных рекомендаций.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
Врач - сердечно-сосудистый хирург;
Врач по рентгенэндоваскулярным диагностике и лечению
Врач - хирург;
Врач ультразвуковой диагностики;
Врач-терапевт
Врач-кардиолог
Студенты медицинских ВУЗов, ординаторы, аспиранты.
Рекомендации основаны на совокупном анализе доказательств, представленных в мировой литературе и полученных в результате клинического применения современных принципов и методов диагностики и лечения тромбофлебита вен конечностей. Основные положения Рекомендаций ранжируются в соответствии с Приказом Министерства здравоохранения РФ от 28 февраля 2019 г. № 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации”. Рекомендации подготовлены в соответствии с Методическими рекомендациями по проведению оценки научной обоснованности, включаемой в клинические рекомендации информации, ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Министерства здравоохранения Российской Федерации, 2019 г.
Таблица 1.Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2.Шкала оценки уровней достоверности доказательств (УДД)для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематический обзор РКИ с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов инструкции по применению лекарственного препарата
Актуальные инструкции по применению лекарственных препаратов расположены на официальном сайте Минздрава России http://grls.rosminzdrav.ru (http://grls.rosminzdrav.ru/Default.aspx).
Приложение А 3.1. Рекомендуемые дозы НМГ для тромбопрофилактики во время беременности и в послеродовом периоде[589]
|
#Эноксапарин натрия, мг в сутки |
#Далтепарин натрия, МЕ в сутки |
#Надропарин кальция, МЕ в сутки |
Парнапарин натрия, Бемипарин натрия |
|
40 каждые 24 часа При ожирении возможна коррекция доз [589]
|
5000
|
2850 каждые 24 часа [589] |
Нет отдельных исследований и рекомендаций, применение в соответствии с инструкцией к препарату[589] |
Примечание: дозировка приведена по Bates S. С. соавт. [589]
Приложение Б. Алгоритмы действий врача
Алгоритм действий при подозрении ТГВ
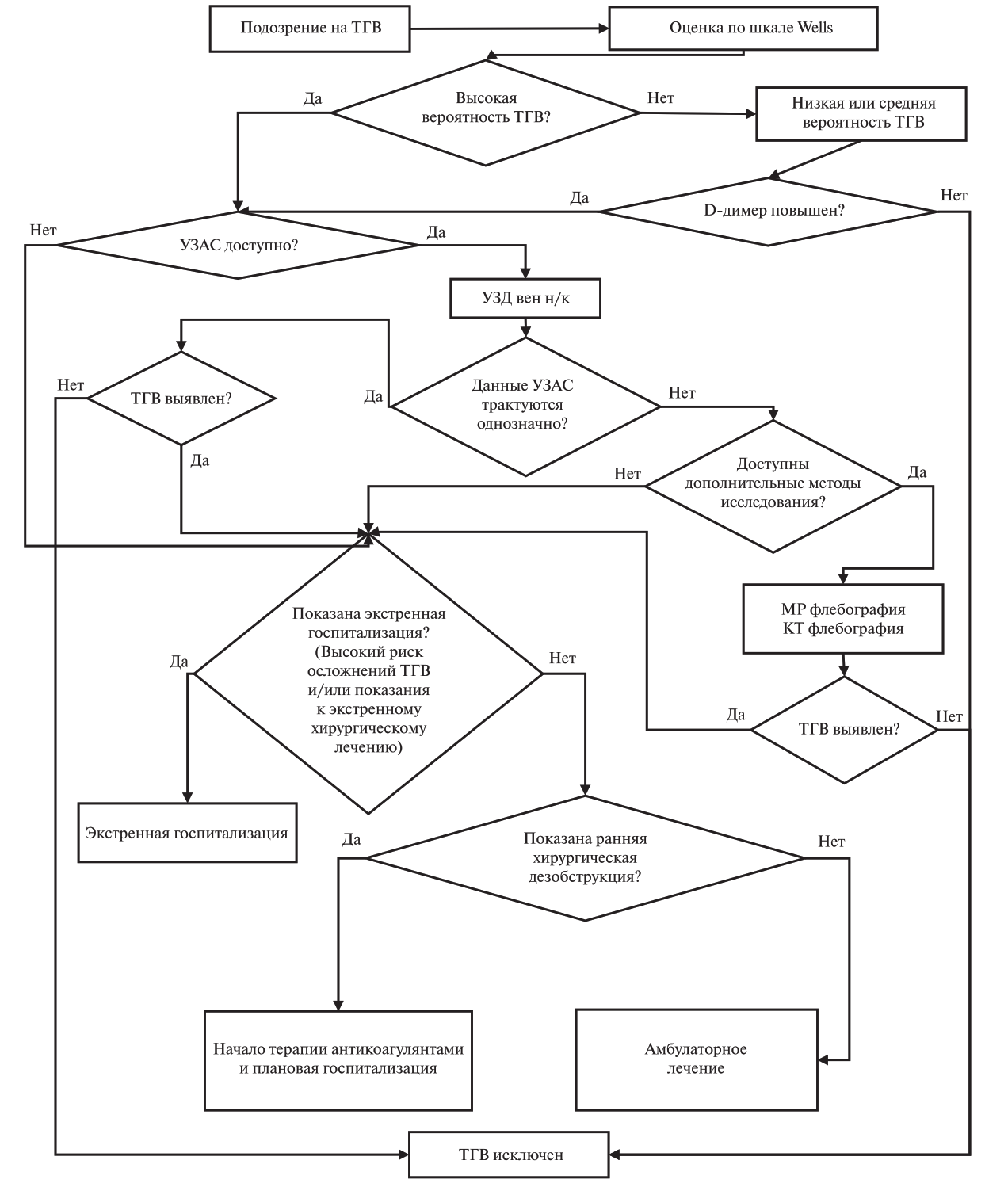
Приложение В. Информация для пациентов
Данный раздел разработан на основе клинических рекомендаций Ассоциации флебологов России и представляет собой краткое содержание основных разделов рекомендаций в форме, доступной для пациентов, а также для специалистов смежных специальностей.
Определение.
Венозный тромбоз – состояние, при котором образуется тромб в просвете вены.
Тромбы могут формироваться в любых венах организма, но чаще всего это происходит в глубоких венах нижних конечностей. При развитии венозного тромбоза нарушается отток крови по пораженной вене, что может приводить к существенным нарушениям кровообращения в конечности. Кроме того, в острой фазе заболевания существует высокий риск фрагментации тромба (отрыв его части) с образованием эмбола, что в свою очередь может привести к такому грозному осложнению как тромбоэмболия легочной артерии.
Причины возникновения.
Венозный тромбоз возникает при наличии следующих факторов:
- нарушение кровообращения, замедление скорости кровотока в венах
- повреждение стенки вены
- повышенной предрасположенности крови к образованию тромбов (гиперкоагуляции)
Риск образования венозного тромбоза путем запуска вышеописанных факторов повышается при определенных обстоятельствах, а именно: длительная иммобилизация (включая длительное неподвижное положение при длительных путешествиях), недавно перенесенное оперативное вмешательство, тромбофилия, беременность, использование оральных контрацептивов, наличие онкологических заболеваний, ожирение и др.
Клиническая картина.
Симптомы тромбоза глубоких вен зависят от уровня распространения тромботических масс, а также характера тромбоза (окклюзивный/ неокклюзивный). Чаще всего наблюдается отек всей или какой-либо части нижней/верхней конечности, цианоз (изменение цвета кожных покровов), болезненность, резкое усиление рисунка поверхностных вен.
Диагностика.
Основным методом диагностики при подозрении на наличие венозного тромбоза является ультразвуковое дуплексное сканирование вен н/к. В обязательный объем диагностики входит исследование, как глубоких вен конечностей, так и поверхностных. В некоторых случаях, для уточнения локализации тромбоза выполняется КТ/МР-венография.
ечение.
Цели лечения при венозном тромбозе:
- Остановить распространение тромботических масс.
- Запустить процесс «рассасывания» тромбов.
- Снизить риск развития возможных осложнений (ТЭЛА, ПТБ).
Основу лечения венозного тромбоза составляют препараты, снижающие свертываемость крови – антикоагулянты. Существует несколько групп антикоагулянтов, которые различаются по механизму действия, имеют определенные преимущества и недостатки.
Амбулаторное лечение при тромбозе глубоких вен возможно только при наличии условий для проведения адекватной терапии и динамического наблюдения. Продолжительность приема антикоагулянтов при тромбозе глубоких вен составляет, не менее 3-х месяцев и определяется индивидуально, учитывая характер и распространенность венозного тромбоза, а также индивидуальные риски развития кровотечения. В дополнение назначается ношение компрессионного трикотажа 2-3 класса компрессии продолжительностью от 6 месяцев до года, что позволяет уменьшить отек пораженной конечности, снизить болевой синдром.
Осложнения.
Самым грозным осложнением венозного тромбоза и первой причиной смертности при данной патологии является тромбоэмболия легочной артерии. Данное осложнение развивается вследствие попадания тромботических масс из глубоких вен конечностей в легочные артерии и, как правило, развивается в ранние сроки от появления венозного тромбоза.
Отдаленными последствиями венозного тромбоза могут служить необратимые изменения в венозной стенке, которые приводят нарушению оттока крови из пораженной конечности. Развитие данных патологических изменений приводит к появлению стойкого отёка, боли, тяжести, изменению цвета пораженной конечности и, на поздних стадиях процесса, к формированию трофических язв. Эти последствия перенесенного венозного тромбоза называются посттромботической болезнью нижних конечностей.
Своевременность обращения и диагностики венозного тромбоза, а также адекватная терапия заболевания, основанная на клинических рекомендациях, позволяют снизить количество осложнений и повысить качество жизни пациентов.
Приложения Г1 - Г20. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала Уэллса (Wells) вероятности ТГВ
Название: вероятность наличия ТГВ нижних конечностей по клиническим данным: шкала Уэллса (Wells)
Оригинальное название: Wells score, Wells Criteria for DVT
Источник: https://pubmed.ncbi.nlm.nih.gov/16403932/
Тип: шкала оценки
Назначение: оценка наличия ТГВ нижних конечностей по клиническим данным
Содержание:
|
Признак |
Количество баллов |
|
Активный рак (в настоящее время проводится специфическая терапия или проводилась в предшествующие 6 месяцев или проводится паллиативное лечение) |
+1 |
|
Паралич, парез или недавняя иммобилизация нижних конечностей с помощью гипса |
+1 |
|
Недавний постельный режим в течение 3 дней и более или большая операция под регионарной или общей анестезией за последние 12 недель |
+1 |
|
Локальная болезненность по ходу глубоких вен нижних конечностей |
+1 |
|
Отек всей нижней конечности на протяжении |
+1 |
|
Отек голени с увеличением окружности на 3 см и более по сравнению с контрлатеральной конечностью (измеряется на 10 см ниже бугристости большеберцовой кости) |
+1 |
|
Отек с ямкой на больной ноге |
+1 |
|
Расширение коллатеральных подкожных вен (не варикозное) |
+1 |
|
Ранее перенесенный ТГВ |
+1 |
|
Альтернативный диагноз столь же или более вероятен, как и ТГВ |
–2 |
|
Вероятность наличия ТГВ нижних конечностей: Маловероятен (5,5%) Вероятен (28%) |
Сумма баллов ≤1 ≥2 |
Ключ (интерпретация): система балльной оценки Wells: от –2 до 1 = низкая вероятность ТГВ или ТГВ маловероятен; от 2 до 8 = умеренная/высокая вероятность ТГВ или ТГВ вероятен
Приложение Г2. Шкала Уэллса (Wells) вероятности ТЭЛА
Название: вероятность наличия ТЭЛА по клиническим данным: шкала Уэллса (Wells)
Оригинальное название: Wells score, Wells Criteria for pulmonary embolism
Источник: https://pubmed.ncbi.nlm.nih.gov/10744147/, https://pubmed.ncbi.nlm.nih.gov/26178041/
Тип: шкала оценки
Назначение: оценка наличия ТЭЛА по клиническим данным
Содержание:
|
Показатель |
Оригинальная версия (количество баллов) |
Упрощенная версия (количество баллов) |
|
Предрасполагающие факторы |
||
|
Субъективные симптомы: Кровохарканье |
1,5 |
1 |
|
Объективные симптомы ЧСС ≥100/мин Симптомы ТГВ |
1,5 3 |
1 1 |
|
Клиническая оценка: другой диагноз менее вероятен, чем ТЭЛА |
3 |
1 |
Ключ (интерпретация): клиническая вероятность (3 уровня, оригинальная версия шкалы) — сумма баллов: низкая 0–1, умеренная 2–6, высокая ≥7;
клиническая вероятность (2 уровня, оригинальная версия) — сумма баллов: ТЭЛА маловероятна 0–4, ТЭЛА вероятна >4;
клиническая вероятность (2 уровня, упрощенная версия) — сумма баллов:
ТЭЛА маловероятна 0–1, ТЭЛА вероятна ≥2
Приложение Г3. Шкала Женева (Geneva)
Название: шкала Женева
Оригинальное название: the Geneva prognostic score
Источник: https://pubmed.ncbi.nlm.nih.gov/16461960/, https://pubmed.ncbi.nlm.nih.gov/26178041/
Тип: шкала оценки
Назначение: оценка вероятности ТЭЛА
Содержание:
|
Показатель |
Оригинальная версия (количество баллов) |
Упрощенная версия (количество баллов) |
|
|
Предрасполагающие факторы |
|||
|
Возраст >65 лет |
1 |
1 |
|
|
Ранее перенесенные ТГВ или ТЭЛА |
3 |
1 |
|
|
Хирургическая операция или перелом в течение последнего месяца |
2 |
1 |
|
|
Злокачественное новообразование (в активной стадии) |
2 |
1 |
|
|
субъективные симптомы: |
|||
|
Односторонняя боль в нижней конечности |
3 |
1 |
|
|
Кровохарканье |
2 |
1 |
|
|
объективные симптомы |
|||
|
частота сердечных сокращений ≥100/мин |
75–94/мин |
3 |
1 |
|
≥95/мин |
5 |
2 |
|
|
болезненность при пальпации глубоких вен и односторонний отек нижней конечности |
4 |
1 |
|
|
Ключ (интерпретация): |
|||
|
клиническая вероятность (3 уровня, оригинальная версия) — сумма баллов: низкая 0–3, умеренная 4–10, высокая ≥11 |
|||
|
клиническая вероятность (3 уровня, упрощенная версия) — сумма баллов: низкая 0–1, умеренная 2–4, высокая ≥5 |
|||
|
клиническая вероятность (2 уровня, оригинальная версия) — сумма баллов: ТЭЛА маловероятна 0–5, ТЭЛА вероятна ≥6 |
|||
|
клиническая вероятность (2 уровня, упрощенная версия) — сумма баллов: ТЭЛА маловероятна 0–2, ТЭЛА вероятна ≥3 |
|||
|
ТЭЛА — тромбоэмболия легочной артерии, ТГВ — тромбоз глубоких вен |
|||
Приложение Г4. Шкала Падуа (Padua)
Название: шкала Padua для оценки риска развития ТГВ и/или ТЭЛА у госпитализированных больных нехирургического профиля
Оригинальное название: the Padua Prediction Score
Источник: https://pubmed.ncbi.nlm.nih.gov/20738765/
Тип: шкала оценки
Назначение: оценка риска развития ТГВ и/или ТЭЛА у госпитализированных пациентов нехирургического профиля
Содержание:
|
Фактор риска |
Баллы |
|
Активный рак (метастазы и/или химиотерапия или радиотерапия < 6 мес назад) |
3 |
|
ТГВ или ТЭЛА в анамнезе (за исключением тромбоза поверхностных вен) |
3 |
|
Ограниченная подвижность (постельный режим с выходом в туалет ≥ 3 дней) |
3 |
|
Известная тромбофилия (дефекты антитромбина, протеина С и S, фактор V Лейден, мутация протромбина G20210A, антифосфолипидный синдром) |
3 |
|
Травма и/или операция ≤ 1 месяца назад |
2 |
|
Возраст ≥ 70 лет |
1 |
|
Сердечная и/или дыхательная недостаточность |
1 |
|
Инфаркт миокарда или ишемический инсульт |
1 |
|
Острое инфекционное и/или ревматологическое заболевание |
1 |
|
Ожирение (ИМТ ≥ 30 кг/м2) |
1 |
|
Продолжающаяся гормональная заместительная терапия или оральные контрацептивы |
1 |
Ключ (интерпретация):
риск ВТЭО низкий (фармакологическая профилактика не показана): <4 баллов
риск ВТЭО высокий (фармакологическая профилактика показана): ≥4 баллов
Приложение Г5. Шкала IMPROVE VTE
Название: шкала IMPROVE VTE для оценки риска развития ТГВ и/или ТЭЛА у госпитализированных больных нехирургического профиля
Оригинальное название: International Medical Prevention Registry on Venous Thromboembolism (IMPROVE) VTE
Источник: https://pubmed.ncbi.nlm.nih.gov/21436241/
Тип: шкала оценки
Назначение: оценка риска развития ТГВ и/или ТЭЛА у нехирургических больных в условиях стационара
Содержание:
|
Фактор риска |
Баллы |
|
ВТЭО в анамнезе |
3 |
|
Известная тромбофилия (дефицит протеина С или S, фактор V Лейден, волчаночный антикоагулянт) |
2 |
|
Парез или паралич нижних конечностей |
2 |
|
Активный рак |
2 |
|
Иммобилизация ≥7 дней (нахождение в кровати или на стуле с выходом в туалет или без него) |
1 |
|
Пребывание в отделении интенсивной терапии/неотложной кардиологии |
1 |
|
Возраст >60 лет |
1 |
Ключ (интерпретация):
|
Балл |
3-месячный ожидаемый риск ВТЭО, % |
|
0 |
0,4 |
|
1 |
0,6 |
|
2 |
1,0 |
|
3 |
1,7 |
|
4 |
2,9 |
|
5-10 |
7,2 |
Повышенным риском развития ВТЭО, являющимся показанием к назначению профилактических доз антикоагулянтов в период пребывания в терапевтическом стационаре, является наличие ≥4 баллов или 2-3 баллов параллельно с увеличение уровня Д-димера в 2 и более раза выше верхней границы нормы.
Приложение Г6. Шкала Каприни (Caprini)
Название: шкала Каприни (Caprini) для оценки риска развития венозных тромбоэмболических осложнений у пациентов хирургического профиля
Оригинальное название: Caprini risk score (CRS, Caprini Risk Assessment Model)
Источник: https://pubmed.ncbi.nlm.nih.gov/22315263/, https://www.mediasphera.ru/issues/khirurgiya-zhurnal-im-n-i-pirogova/2014/12/030023-12072014123
Тип: шкала оценки
Назначение: шкала Каприни (Caprini) используется как модель стратификации риска венозных тромбоэмболий у пациентов хирургического профиля
Содержание:
|
Фактор риска |
Баллы |
|
Возраст 41-60 лет |
1
|
|
Отек нижних конечностей |
|
|
Варикозные вены |
|
|
ИМТ>25 кг/м2 |
|
|
Малое хирургическое вмешательство |
|
|
Сепсис |
|
|
Серьезное заболевание легких |
|
|
Прием комбинированных оральных контрацептивов, гормон-заместительная терапия |
|
|
Беременность и послеродовый период |
|
|
В анамнезе: необъяснимые мертворождения, выкидыши (≥3), преждевременные роды с токсикозом или задержка внутриутробного развития |
|
|
Острый инфаркт миокарда |
|
|
Хроническая сердечная недостаточность |
|
|
Постельный режим у нехирургического пациента |
|
|
Воспалительные заболевания толстой кишки в анамнезе |
|
|
Большое хирургическое вмешательство давностью до 1 мес. в анамнезе |
|
|
Хроническая обструктивная болезнь легких |
|
|
Возраст 61-74 года |
2
|
|
Артроскопическая хирургия |
|
|
Злокачественное новообразование |
|
|
Лапароскопическое вмешательство (более 45 мин.) |
|
|
Постельный режим более 72 часов |
|
|
Иммобилизация конечности (давностью до 1 мес.) |
|
|
Катетеризация центральных вен |
|
|
Большая хирургия (длительностью более 45 мин) |
|
|
Возраст старше 75 лет |
3
|
|
Личный анамнез ВТЭО |
|
|
Семейный анамнез ВТЭО |
|
|
Мутация типа Лейден (FVL) |
|
|
Мутация протромбина (FII G20210А) |
|
|
Гипергомоцистеинемия |
|
|
Гепарин-индуцированная тромбоцитопения |
|
|
Повышенный уровень антител к кардиолипину |
|
|
Волчаночный антикоагулянт |
|
|
Другая врожденная или приобретенная тромбофилия |
|
|
Инсульт (давностью до 1 мес.) |
5 |
|
Множественная травма (давностью до 1 мес.) |
|
|
Эндопротезирование крупных суставов |
|
|
Перелом костей бедра и голени (давностью до 1 мес.) |
|
|
Травма спинного мозга/паралич (давностью до 1 мес.) |
Ключ (интерпретация): результаты представляются в виде оценки суммы полученных баллов. Низкий риск: 0-2 балла; умеренный риск: 3-4 балла; высокий риск: 5-8 баллов; очень высокий риск: 9-10 баллов; чрезвычайно высокий риск: 11 и более баллов.
Приложение Г7. Пациент-ориентированный опросник на основе шкалы Каприни (Caprini)
Название: пациент-ориентированный опросник на основе шкалы Каприни (Caprini) для оценки риска развития венозных тромбоэмболических осложнений у пациентов хирургического профиля
Оригинальное название: Patient reported Caprini risk score
Источник: https://www.mediasphera.ru/issues/flebologiya/2022/1/1199769762022011006
Тип: опросник
Назначение: опросник на основании шкалы Каприни (Caprini) используется как модель стратификации риска венозных тромбоэмболий у пациентов хирургического профиля на основании самооценки (анкетирования)
Содержание: оценка рисков производится по нескольким параметрам (возраст, двигательная активность, индекс массы тела, продолжительность хирургического вмешательства, наличие заболеваний сердечно-сосудистой системы и крови, семейного анамнеза тромбоэмболий и другое), каждому параметру присвоено определенное количество баллов (1–5). Пациент самостоятельно отвечает на вопросы и отмечает наличие факторов риска. Расчет ИМТ с возможным присвоением 1 дополнительного балла производится врачом. Финальную сумму баллов рассчитывает врач.
|
Отметьте свой ВОЗРАСТ 0-40 лет (0 БАЛЛОВ) 41-60 лет (1 БАЛЛ) 61-74 лет (2 БАЛЛА) 75 и более лет (3 БАЛЛА) Число баллов____ |
|
Добавьте по 1 БАЛЛУ при наличии у Вас каждого из перечисленных состояний В течение последнего месяца мне выполнялась операция под наркозом или регионарной анестезией (например, спинальной или эпидуральной) продолжительностью более 45 минут В течение последнего месяца у меня были или сейчас имеются варикозные вены на ногах В течение последнего месяца у меня были или сейчас имеются отеки на ногах В течение последнего месяца у меня был сердечный приступ (острый инфаркт миокарда) В течение последнего месяца у меня было или сейчас имеется серьезное инфекционное заболевание (пневмония, флегмона и пр.) Мне когда-либо ставился диагноз воспалительного заболевания кишечника (болезнь Крона, язвенный колит) Я страдаю или страдал застойной сердечной недостаточностью Я страдаю хроническим заболеванием легких (эмфизема, хронический обструктивный бронхит), за исключением бронхиальной астмы Число баллов____ |
|
Только для ЖЕНЩИН. Добавьте по 1 БАЛЛУ при наличии у Вас каждого из перечисленных состояний Я в данный момент использую гормональную контрацепцию (комбинированный оральные контрацептивы, подкожные противозачаточные импланты, контрацептивные пластыри, внутриматочные устройства с гормонами) или получаю гормон-заместительную терапию Я сейчас беременна или родила в течение предшествующего месяца Ранее у меня случалось необъяснимое мертворождение, более ТРЕХ самопроизвольных абортов (выкидышей), преждевременные роды с преэклампсией, или рождение ребенка с низким весом (задержка внутриутробного развития) Число баллов____ |
|
Добавьте по 2 БАЛЛА при наличии у Вас каждого из перечисленных состояний У меня злокачественное новообразование (рак), лейкемия (рак крови), лимфома или меланома В течение последнего месяца у меня на ноге был не снимаемый гипс или ортез, который не давал ноге полностью сгибаться В течение последнего месяца мне устанавливали или сейчас я имею центральный венозный катетер или порт системы доставки лекарственных препаратов непосредственно в сердце через шею, грудь или руку Число баллов____ |
|
Добавьте по 3 БАЛЛА при наличии у Вас каждого из перечисленных состояний Мне раньше ставили диагноз тромбоза вен на ногах, руках, животе или в легких (тромбоз глубоких вен и/или тромбоэмболия легочной артерии) Кому-то из членов моей семьи (братья и сестры, мамы и папы, бабушки и дедушки, дяди и тети, кузены) ставился диагноз венозного тромбоза или легочной эмболии Я имею положительный тест на наследственную тромбофилию (уточнить какую: __________________________________________) Число баллов____ |
|
Выберите заключения, которые относятся к Вашему текущему состоянию Я лежу в постели, не вставая из нее или не отходя от нее далее, чем на 10 метров, в течение ДВУХ и МЕНЕЕ дней (1 БАЛЛ) Я лежу в постели, не вставая из нее или не отходя от нее далее, чем на 10 метров, в течение ТРЕХ и БОЛЕЕ дней (2 БАЛЛА) Число баллов____ |
|
Добавьте по 5 БАЛЛОВ при наличии у Вас каждого из перечисленных состояний В течение последнего месяца мне выполнялась операция по замене коленного или тазобедренного сустава (эндопротезирование) В течение последнего месяца у меня был или сейчас есть перелом костей таза, бедра или голени В течение последнего месяца у меня была или сейчас есть серьезная травма (например, множественные переломы в результате падения или автокатастрофы) В течение последнего месяца у меня было или сейчас есть повреждение позвоночника с параличом части тела В течение последнего месяца у меня был или сейчас есть инсульт (тромб или кровоизлияние в мозг, транзиторная ишемическая атака) Число баллов____ |
|
Если Вам планируется выполнение ОПЕРАЦИИ, то выберите наиболее подходящую ее характеристику (уточните у своего врача) Мне планируется выполнение операции под наркозом или регионарной анестезией (например, спинальной или эпидуральной) продолжительностью МЕНЕЕ 45 минут (1 БАЛЛ) Мне планируется выполнение операции под наркозом или регионарной анестезией (например, спинальной или эпидуральной) продолжительностью БОЛЕЕ 45 минут, включая лапароскопию и артроскопию (2 БАЛЛА) Число баллов____ |
|
Рост:_____ см Вес:______ кг ИМТ:______кг/м2 (заполняется врачом) |
|
Суммарное число баллов: ______________ |
Ключ (интерпретация): интерпретация результатов опроса и определение индивидуального риска развития ВТЭО проводится по аналогии с использованием оригинальной шкалы.
Приложение Г8. Шкала Хорана (Khorana)
Название: Шкала Khorana оценки риска развития ТГВ и ТЭЛА у амбулаторных пациентов, получающих химиотерапию
Оригинальное название: Khorana Risk Score for Venous Thromboembolism in Cancer Patients
Источник: https://pubmed.ncbi.nlm.nih.gov/18216292/
Тип: шкала оценки
Назначение: шкала Khorana используется для оценки риска ВТЭО у амбулаторных пациентов, получающих химиотерапию
Содержание:
|
Фактор риска |
Баллы |
|
Локализация опухоли (первичный очаг): высокий риск (поджелудочная железа, желудок) низкий риск (легкие, лимфома, гинекология, мочевой пузырь, яичко) |
1 2 |
|
Количество тромбоцитов до начала химиотерапии ≥ 350 х 109 /л |
1 |
|
Концентрация гемоглобина <100 г/л или применение эритропоэтина |
1 |
|
Количество лейкоцитов до начала химиотерапии> 11 х 109 /л |
1 |
|
Индекс массы тела (ИМТ) ≥ 35 кг/м2 |
1 |
Ключ (интерпретация): 0 баллов – низкий риск (0,3%), 1-2 балла – умеренный риск (2,0%), ≥3 - высокий риск (6,7%).
Приложение Г9 . Шкалы для индивидуальной оценки риска рецидива ТГВ
Название: шкалы для индивидуальной оценки риска рецидива после завершения антикоагулянтной терапии первичного клинически неспровоцированного эпизода
Оригинальное название: HERDOO2 rule, the Vienna prediction model, a proposed prediction score (DASH)
Источник: https://pubmed.ncbi.nlm.nih.gov/28314711/, https://pubmed.ncbi.nlm.nih.gov/20351233/, https://pubmed.ncbi.nlm.nih.gov/22489957/
ип: шкала оценки
Назначение: представленные в таблице шкалы используются для оценки риска рецидива ВТЭО после завершения антикоагулянтной терапии
Содержание: особенности определения Д-димера: HER-DOO2: определяется до завершения терапии (на антикоагулянте), повышен при значении >250 нг/мл, Vienna prediction model: определяется сразу после завершения терапии (вне антикоагуляции), пограничное значение отсутствует, полученная величина определяет риск рецидива ВТЭО, DASH: определяется через 3-5 недель после завершения терапии, пограничное значение >500 нг/мл
|
|
HERDOO-2 |
Vienna prediction model |
DASH |
|
Факторы риска |
Гиперпигментация (+1) Отек (+1) Гиперемия (+1) Повышенный Д-димер (+1) Ожирение (+1) Возраст >65 лет (+1) |
Возраст Локализация ВТЭО (дистальный ТГВ, проксимальный ТГВ, ТЭЛА) Д-димер |
Д-димер (+2) Возраст <50 лет (+1) Мужской пол (+1) Гормональная терапия при манифестации ВТЭО (-2) |
Ключ (интерпретация):
Шкала HERDOO-2: каждый из перечисленных факторов оценивается в 1 балл. При наборе 2 и более баллов рекомендуется продление антикоагулянтной терапии.
Vienna prediction model (Венская предиктивная модель): определение индивидуального риска рецидива ВТЭО за 12 и 60 мес. по номограмме или с помощью онлайн-калькулятора разработчика шкалы (Центр медицинской статистики, информатики и интеллектуальных систем Медицинского университета Вены) https://cemsiis.meduniwien.ac.at/en/kb/science-research/software/clinical-software/recurrent-vte/#calc-params
Шкала DASH: каждый из перечисленных факторов оценивается в 1 балл. Абсолютный риск рецидива ВТЭО в течение года выражается в процентах в зависимости от суммы набранных баллов по следующему правилу: ≤1 балла: 3,1% в год; 2 балла: 6,4% в год; ≥3 балла: 12,3% в год.
Приложение Г10. Шкалы для индивидуальной оценки риска большого кровотечения на фоне АКТ
Название: шкалы для индивидуальной оценки риска большого кровотечения на фоне терапии антикоагулянтами
Оригинальное название: the ACCP Score to Assess the Bleeding Risk During Anticoagulation in Patients With VTE, the VTE-BLEED risk score, RIETE Score for Risk of Hemorrhage in Pulmonary Embolism Treatment, HAS-BLED Score for Major Bleeding Risk
Источник: https://pubmed.ncbi.nlm.nih.gov/26867832/, https://pubmed.ncbi.nlm.nih.gov/27471209/, https://pubmed.ncbi.nlm.nih.gov/18612534/, https://pubmed.ncbi.nlm.nih.gov/20299623/
Тип: шкала оценки
Назначение: представленные в таблице шкалы используются для оценки риска больших геморрагических осложнений на фоне антикоагулянтной терапии
Содержание:
|
Факторы риска |
АССР |
VTE-BLED |
RIETE |
HAS-BLED |
|
Возраст >60 лет |
|
1,5 |
|
|
|
Возраст >65 лет |
1 |
|
|
1 |
|
Возраст >75 лет |
1 |
|
1 |
|
|
Предшествующее кровотечение |
1 |
1,5 |
|
1 |
|
Предшествующее большое кровотечение |
|
|
2 |
|
|
Активный рак |
1 |
2 |
1 |
|
|
Метастатический рак |
1 |
|
|
|
|
Почечная недостаточность |
1 |
1,5 |
1,5 |
1 |
|
Печеночная недостаточность |
1 |
|
|
1 |
|
Тромбоцитопения |
1 |
|
|
|
|
Предшествующее ОНМК |
1 |
|
|
1 |
|
Сахарный диабет |
1 |
|
|
|
|
Анемия |
1 |
1,5 |
1,5 |
|
|
Терапия дезагрегантами (АТХ группа: антиагреганты кроме гепарина, В01АС) |
1 |
|
|
1 |
|
Плохой контроль за антикоагулянтами (лабильное МНО) |
1 |
|
|
1 |
|
Коморбидность |
1 |
|
|
|
|
Недавняя операция |
1 |
|
|
|
|
Частые падения |
1 |
|
|
|
|
Злоупотребление алкоголем |
1 |
|
|
1 |
|
Применение нестероидных противовоспалительных препаратов (АТХ группа: нестероидные противовоспалительные и противоревматические препараты, М01А) |
1 |
|
|
|
|
Мужской пол и неконтролируемая артериальная гипертензия |
|
1 |
|
|
|
Артериальная гипертензия в анамнезе |
|
|
|
1 |
|
Клинически значимая ТЭЛА |
|
|
1 |
|
|
Категория риска в зависимости от количества баллов: |
||||
|
Низкий риск |
0 |
<2 |
0 |
0 |
|
Умеренный риск |
1 |
|
1-4 |
1-2 |
|
Высокий риск |
≥2 |
≥2 |
>4 |
>2 |
Ключ (интерпретация): для определения категории риска кровотечения на фоне антикоагулянтной терапии производится подсчет баллов по выбранной шкале и отнесение пациента к категории низкого, умеренного или высокого риска кровотечения в соответствии с разделом таблицы «Категория риска в зависимости от количества баллов».
Приложение Г11. Шкала оценки риска развития осложнений при амбулаторном лечении ТГВ
Название: прогностическая шкала для оценки риска развития осложнений при амбулаторном лечении ТГВ
Оригинальное название: a prognostic score to identify low-risk outpatients with acute deep vein thrombosis in the lower limbs
Источник: https://pubmed.ncbi.nlm.nih.gov/25242230/
Тип: шкала оценки
Назначение: шкала используется для решения о возможности лечения ТГВ в амбулаторных условиях
Содержание:
|
Фактор риска |
Баллы |
|
Хроническая сердечная недостаточность |
1 |
|
Расчетная скорость клубочковой фильтрации 30-60 мл/мин |
1 |
|
Расчетная скорость клубочковой фильтрации <30 мл/мин |
3 |
|
Недавнее большое кровотечение |
1 |
|
Уровень тромбоцитов <100 или >450 |
1 |
|
Предшествующая иммобилизация ≥4 дня |
1 |
|
Рак без метастазов |
1 |
|
Рак с метастазами |
2 |
Ключ (интерпретация): риск развития осложнений в течение 7 дней, включая ТЭЛА, большое кровотечение, летальный исход: низкий (0,37%) при сумме баллов 1-2, высокий (3,40%) – сумма баллов ≥2.
Приложение Г12. Шкала Виллальты (Villalta)
Название: шкала Виллальты (Villalta) для оценки наличия и тяжести посттромботического синдрома (посттромботической болезни)
Оригинальное название: Villalta scale
Источник: https://pubmed.ncbi.nlm.nih.gov/26992962/
Тип: шкала оценки
Назначение: шкала Виллальты (Villalta) используется для установления факта наличия и балльной оценки тяжести посттромботического синдрома (посттромботической болезни) отдельно для каждой нижней конечности
Содержание:
|
Фактор риска |
Выраженность признака, баллов |
|||
|
Боль |
0 |
1 |
2 |
3 |
|
Судороги |
0 |
1 |
2 |
3 |
|
Тяжесть |
0 |
1 |
2 |
3 |
|
Парестезии |
0 |
1 |
2 |
3 |
|
Зуд |
0 |
1 |
2 |
3 |
|
Претибиальный отек |
0 |
1 |
2 |
3 |
|
Гиперпигментации |
0 |
1 |
2 |
3 |
|
Расширение вен |
0 |
1 |
2 |
3 |
|
Покраснение кожи |
0 |
1 |
2 |
3 |
|
Индурация кожи |
0 |
1 |
2 |
3 |
|
Язва |
15 |
|||
Ключ (интерпретация): 0 - 4 балла: нет ПТС; 5 - 9 баллов: легкий ПТС; 10 – 14 баллов: средний (средне-тяжелый) ПТС; ≥ 15 баллов или наличие язвы: тяжелый ПТС.
Приложение Г13. Количественная оценка ТГВ по Мардеру (Marder)
Название: количественная оценка тромбоза глубоких вен в системе нижней полой вены по Мардеру.
Оригинальное название: Venographic quantification of thrombosis according to Marder
Источник: https://pubmed.ncbi.nlm.nih.gov/323387/
Тип: шкала оценки
Назначение: количественная оценка тромбоза глубоких вен и оценка эффективности венозной дезобструкции в системе нижней полой вены.
Содержание:
|
Венозный сегмент |
Возможное количество баллов |
|
Общая, наружная и внутренняя подвздошные вены |
0-6 |
|
Общая бедренная вена |
0-4 |
|
Бедренная вена |
0-10 |
|
Подколенная вена |
0-4 |
|
Передние большеберцовые вены |
0-4 (2 каждая) |
|
Задние большеберцовые вены |
0-6 (3 каждая) |
|
Малоберцовые вены |
0-6 (3 каждая) |
|
Максимальное количество баллов |
40 |
Ключ: количество баллов для каждого сегмента определяется субъективной оценкой степени стеноза по дефекту контрастирования. Результат выражается суммой баллов всех тромбированных сегментов.
Приложение Г14. Количественная оценка ТГВ по Арнесену (Arnesen)
Название: количественная оценка тромбоза глубоких вен в системе нижней полой вены по Arnesen.
Оригинальное название: Venographic quantification of thrombosis according to Arnesen
Источник: https://pubmed.ncbi.nlm.nih.gov/352099/
Тип: шкала оценки
Назначение: количественная оценка тромбоза глубоких вен и оценка эффективности венозной дезобструкции в системе нижней полой вены.
Содержание:
Таблица 1. Перечень оцениваемых венозных сегментов
|
Венозный сегмент |
Возможное количество баллов |
|
Общая, наружная и внутренняя подвздошные вены |
0-5 |
|
Общая бедренная вена и бедренная вена |
|
|
Подколенная вена |
|
|
Передние большеберцовые вены |
|
|
Задние большеберцовые вены |
|
|
Малоберцовые вены |
|
|
Максимальное количество баллов |
30 |
Таблица 2. Правила определения количества баллов для каждого сегмента
|
Распространенность и характер поражения сегмента |
Баллы |
|
Сегмент полностью контрастируется |
0 |
|
Распространение тромба до 1/3 сегмента без окклюзии |
1 |
|
Распространение тромба до 2/3 сегмента без окклюзии или Распространение тромба до 1/3 сегмента с окклюзией |
2 |
|
Распространение тромба до 3/3 сегмента без окклюзии или Распространение тромба до 2/3 сегмента с окклюзией |
3 |
|
Распространение тромба до 3/3 сегмента с окклюзией |
4 |
|
Отсутствие визуализации вены из-за полной окклюзии |
5 |
Ключ: количество баллов для каждого сегмента из Таблицы 1 данного приложения определяется в соответствии с распространенностью и характером его поражения по Таблице 2 данного приложения. Результат выражается суммой баллов всех тромбированных сегментов.
Приложение Г15. количественная оценка ТГВ по междисциплинарному североамериканскому стандарту отчетности
Название: Количественная оценка тромбоза глубоких вен в системе нижней полой вены по стандартам отчетности Объединенного совета Общества сосудистой хирургии (США) и Североамериканского отделения Международного общества сердечно-сосудистых хирургов от 1988 г.
Оригинальное название: The scoring system of a subcommittee of venous disease
Источник: https://pubmed.ncbi.nlm.nih.gov/3398175/
Тип: шкала оценки
Назначение: количественная оценка тромбоза глубоких вен и оценка эффективности венозной дезобструкции в системе нижней полой вены.
Содержание:
Таблица 1. Перечень оцениваемых венозных сегментов
|
Венозный сегмент |
Возможное количество баллов |
|
Нижняя полая вена |
0-3 |
|
Общая, наружная и внутренняя подвздошные вены |
|
|
Общая бедренная вена и бедренная вена |
|
|
Глубокая бедренная вена |
|
|
Подколенная вена |
|
|
Передние большеберцовые вены, задние большеберцовые вены, малоберцовые вены, мышечные вены голени |
|
|
Большая подкожная вена |
|
|
Малая подкожная вена |
|
|
Максимальное количество баллов |
24 |
Таблица 2. Правила определения количества баллов для каждого сегмента
|
Распространенность и характер поражения сегмента |
Баллы |
|
Сегмент полностью контрастируется |
0 |
|
Распространение тромба не на весь сегмент без окклюзии |
1 |
|
Распространение тромба не на весь сегмент с окклюзией |
2 |
|
Окклюзивный тромбоз на всем протяжении сегмента |
3 |
Ключ: количество баллов для каждого сегмента из Таблицы 1 данного приложения определяется в соответствии с распространенностью и характером его поражения по Таблице 2 данного приложения. Результат выражается суммой баллов всех тромбированных сегментов.
Приложение Г16. Количественная оценка ТГВ по Бьёргель (Bjorgell)
Название: количественная оценка тромбоза глубоких вен в системе нижней полой вены по Björgell
Оригинальное название: The scoring system of Björgell
Источник: https://pubmed.ncbi.nlm.nih.gov/10088796/
Тип: шкала оценки
Назначение: количественная оценка тромбоза глубоких вен и оценка эффективности венозной дезобструкции в системе нижней полой вены.
Содержание:
Таблица 1. Перечень оцениваемых венозных сегментов
|
Венозный сегмент |
Возможное количество баллов |
|
Нижняя полая вена |
0-3 |
|
Общая подвздошная вена |
|
|
Наружная подвздошная вена |
|
|
Внутренняя подвздошная вена |
|
|
Общая бедренная вена |
|
|
Глубокая бедренная вена |
|
|
Бедренная вена |
|
|
Подколенная вена |
|
|
Передние большеберцовые вены |
|
|
Задние большеберцовые вены |
|
|
Малоберцовые вены |
|
|
Вены камбаловидной мышцы |
|
|
Вены икроножной мышцы |
|
|
Глубокие вены стопы |
|
|
Максимальное количество баллов |
42 |
Таблица 2. Правила определения количества баллов для каждого сегмента
|
Распространенность и характер поражения сегмента |
Баллы |
|
Сегмент полностью контрастируется |
0 |
|
Распространение тромба до 1/3 сегмента |
1 |
|
Распространение тромба более 1/3 и менее 2/3 сегмента |
2 |
|
Распространение тромба более 2/3 сегмента |
3 |
Ключ: количество баллов для каждого сегмента из Таблицы 1 данного приложения определяется в соответствии с распространенностью и характером его поражения по Таблице 2 данного приложения. Результат выражается суммой баллов всех тромбированных сегментов.
Приложение Г17. Количественная оценка ТГВ по Мьюиссен (Mewissen)
Название: количественная оценка тромбоза глубоких вен в системе нижней полой вены по Mewissen
Оригинальное название: нет
Источник: https://pubmed.ncbi.nlm.nih.gov/10189452/
Тип: шкала оценки
Назначение: для количественной оценки тромбоза глубоких вен и оценки эффективности венозной дезобструкции в системе нижней полой вены.
Содержание:
Таблица 1. Перечень оцениваемых венозных сегментов
|
Венозный сегмент |
Возможное количество баллов |
|
Нижняя полая вена |
0-2 |
|
Общая подвздошная вена |
|
|
Наружная подвздошная вена |
|
|
Общая бедренная вена |
|
|
Бедренная вена проксимальная 1/2 |
|
|
Бедренная вена дистальная 1/2 |
|
|
Подколенная вена |
|
|
Максимальное количество баллов |
14 |
Таблица 2. Правила определения количества баллов для каждого сегмента
|
Распространенность и характер поражения сегмента |
Баллы |
|
Сегмент полностью контрастируется |
0 |
|
Распространение тромба не на весь сегмент |
1 |
|
Окклюзия всего сегмента |
2 |
Ключ: количество баллов для каждого сегмента из Таблицы 1 данного приложения определяется в соответствии с распространенностью и характером его поражения по Таблице 2 данного приложения. Результат выражается суммой баллов всех тромбированных сегментов.
Приложение Г18. Антенатальная и постнатальная оценка факторов риска развития ВТЭО для определения категории риска и порядка лечебно-диагностических мероприятий
Название: антенатальная и постнатальная оценка факторов риска развития ВТЭО для определения категории риска и порядка лечебно-диагностических мероприятий
Оригинальное название: нет
Источник: https://www.rcog.org.uk/media/qejfhcaj/gtg-37a.pdf
Тип: шкала оценки
Назначение: оценка степени риска развития ВТЭО в баллах для определения тактики профилактики ВТЭО и стратификации в группы риска для определения порядка лечебно-диагностических мероприятий
Содержание:
|
Фактор риска |
Баллы |
|
Предшествующее ВТЭО (за исключением однократного эпизода, связанного с большим хирургическим вмешательством) |
4 |
|
СГЯ в первом триместре (профилактика только в 1 триместре) |
4 |
|
Тромбофилия высокого риска (АФС, дефицит антитромбина III, гомозиготы или сочетание гетерозигот полиморфизмов генов V и II факторов свертывания, дефицит протеинов C, S)* |
3 |
|
Предшествующее ВТЭО, спровоцированное большим хирургическим вмешательством |
3 |
|
Соматические заболевания (рак, сердечная недостаточность, СКВ, нефротический синдром, диабет I типа с нефропатией, воспалительная полиартропатия или воспалительное заболевание кишечника, серповидно-клеточная анемия, употребление внутривенных наркотиков) |
3 |
|
Любая хирургическая процедура во время беременности или послеродового периода, (за исключением наложения швов на промежность сразу после родов), например, аппендэктомия, послеродовая стерилизация |
3 |
|
Гиперемезис |
3 |
|
Перенесенный в текущую беременность ТФПВ |
2 |
|
Семейный анамнез неспровоцированного или эстроген-ассоциированного ВТЭО у родственника 1 линии |
1 |
|
Известная тромбофилия низкого риска (без ВТЭО) |
1 |
|
Возраст более 35 лет |
1 |
|
Ожирение ИМТ ≥ 30 |
1 |
|
Множественные роды ≥ 3 |
1 |
|
Курение |
1 |
|
Значительное (большое, крупное) варикозное расширение вен ног** |
1 |
|
Преэклампсия в текущую беременность |
1 |
|
Вспомогательные репродуктивные технологии / ЭКО (только для антенатальной оценки) |
1 |
|
Многоплодная беременность |
1 |
|
Кесарево сечение в плановом порядке |
1 |
|
Полостныеилиротационныещипцы |
1 |
|
Затяжные роды более 24 часов |
1 |
|
Послеродовое кровотечение >1 литра или переливание крови |
1 |
|
Преждевременные роды в текущую беременность (<37 нед) |
1 |
|
Внутриутробная гибель плода во время данной беременности |
1 |
|
Текущая системная инфекция |
1 |
|
Дегидратация и/или иммобилизация |
1 |
|
Длительные поездки (свыше 4-6 часов) |
1 |
*С учетом использования факторов риска для отнесения пациентки в группу низкого или группу не-низкого риска целесообразно объединение всех видов тромбофилических состояний высокого риска в одну группу.
** Варикозное расширение вен голени с симптомами, или с перенесенным тромбофлебитом, или с венозным отеком, или с трофическими изменениями мягких тканей.
Ключ: ≤ 2 баллов - категория низкого риска; ≥ 3 баллов – категория не-низкого риска.
Приложение Г19. Тактика антенатальной профилактики ТГВ/ВТЭО в зависимости от факторов/категории риска
Название: тактика антенатальной профилактики ТГВ/ВТЭО в зависимости от факторов/категории риска
Оригинальное название: нет
Источник: https://www.rcog.org.uk/media/qejfhcaj/gtg-37a.pdf
Тип: шкала определения тактики
Назначение: определение тактики профилактики ТГВ/ВТЭО во время беременности (антенатально) в зависимости от факторов/категории риска
|
Фактор риска |
Категория риска |
Тактика профилактики ТГВ/ВТЭО во время беременности (антенатально) |
|
Тромбофилия: дефицит антитромбина III |
Очень высокий |
Рекомендуется: - Повышенные дозы* НМГ всю беременность
|
|
Тромбофилия: АФС с эпизодами ВТЭО |
||
|
ВТЭО на фоне антикоагулянтной терапии в анамнезе |
||
|
Предшествующее ВТЭО (за исключением однократного эпизода, связанного с большим хирургическим вмешательством) |
Высокий |
Рекомендуется: - НМГ всю беременность
|
|
Применение НМГ антенатально по любым причинам |
||
|
Предшествующее ВТЭО, спровоцированное большим хирургическим вмешательством |
Высокий/средний** |
Рекомендуется: - НМГ с 28 недели Рассмотреть: - НМГ всю беременность |
|
Госпитализация в текущую беременность |
Средний |
Рассмотреть тромбопрофилактику НМГ |
|
Соматические заболевания (рак, сердечная недостаточность, СКВ, нефротический синдром, диабет I типа с нефропатией, воспалительная полиартропатия или воспалительное заболевание кишечника, серповидно-клеточная анемия, употребление внутривенных наркотиков) |
Рассмотреть: - НМГ всю беременность - НМГ с 28 недели
|
|
|
Тромбофилия высокого риска (гомозиготы или сочетание гетерозигот полиморфизмов генов V и II факторов свертывания, дефицит протеинов C, S) |
||
|
Любая хирургическая процедура во время беременности или послеродового периода, (за исключением наложения швов на промежность сразу после родов), например, аппендэктомия, послеродовая стерилизация |
||
|
Ожирение ИМТ ≥ 40 |
Низкий (учитывается как 2 фактора сразу) |
≥ 4 факторов: рекомендуются НМГ с 1 триместра 3 фактора: рекомендуются НМГ с 28 недели ≤ 2 факторов: рекомендуется подвижность и избегание обезвоживания |
|
Известная тромбофилия низкого риска (без ВТЭО и без семейного анамнеза ВТЭО) |
Низкий |
|
|
Семейный анамнез неспровоцированного или эстроген-ассоциированного ВТЭО у родственника 1 линии |
||
|
Ожирение ИМТ ≥ 30 |
||
|
Возраст более 35 лет |
||
|
Курение |
||
|
Значительное (большое, крупное) варикозное расширение вен ног |
||
|
Текущая системная инфекция |
||
|
Длительное путешествие |
||
|
Множественные роды ≥ 3 |
||
|
Многоплодная беременность |
||
|
Преэклампсия в текущую беременность |
||
|
Дегидратация и/или иммобилизация |
||
|
Вспомогательные репродуктивные технологии/ЭКО |
||
|
Гиперемезис |
Средний/низкий |
Рассмотреть тромбопрофилактику НМГ |
|
СГЯ в первом триместре (профилактика только в 1 триместре) |
Высокий/средний |
Рекомендуется: - НМГ в течение 1 триместра |
* под повышенной дозой имеется в виду доза в 50%, 75% от лечебной или лечебная доза.
** факторы риска, отнесенные в разных разделах рекомендаций RCOG к разным категориям риска, отнесены в смешанные категории (например, «высокий/средний». Тактика предложена по категории наибольшего риска.
Ключ: содержание столбца «Тактика профилактики ТГВ/ВТЭО во время беременности (антенатально)», соответствующее выявленным факторам риска и/или категории риска
Приложение Г20. Тактика постнатальной профилактики ТГВ/ВТЭО в зависимости от факторов/категории риска
Название: тактика постнатальной профилактики ТГВ/ВТЭО в зависимости от факторов/категории риска
Оригинальное название: нет
Источник: https://www.rcog.org.uk/media/qejfhcaj/gtg-37a.pdf
Тип: шкала определения тактики
Назначение: определение тактики постнатальной профилактики ТГВ/ВТЭО в зависимости от факторов/категории риска
Содержание:
|
Фактор риска |
Категория риска |
Тактика профилактики ТГВ/ВТЭО в послеродовом периоде (постнатально) |
|
ВТЭО на фоне антикоагулянтной терапии в анамнезе |
Очень высокий |
Рекомендуется: НМГ не менее 6 недель или до перехода на пероральные антикоагулянты |
|
Тромбофилия: АФС с эпизодами ВТЭО |
||
|
Тромбофилия: дефицит антитромбина |
||
|
Предшествующее ВТЭО (за исключением однократного эпизода, связанного с большим хирургическим вмешательством) |
Высокий |
Рекомендуется: НМГ не менее 6 недель |
|
Применение НМГ антенатально по любым причинам |
|
|
|
Известная тромбофилия низкого риска + семейный анамнез ВТЭО у родственника 1 линии; |
|
|
|
Предшествующее ВТЭО, спровоцированное большим хирургическим вмешательством |
Высокий/средний |
Рекомендуется: НМГ не менее 10 дней; Рассмотреть: продление до 6 недель |
|
Госпитализация (продолжительная (≥ 3 дней) госпитализация в послеродовом периоде или повторная госпитализация в послеродовом периоде) |
Средний |
Рекомендуется: НМГ не менее 10 дней; Рассмотреть: продление до 6 недель |
|
Тромбофилия высокого риска (гомозиготы или сочетание гетерозигот полиморфизмов генов V и II факторов свертывания, дефицит протеинов C, S) |
||
|
Соматические заболевания (рак, сердечная недостаточность, СКВ, нефротический синдром, диабет I типа с нефропатией, воспалительная полиартропатия или воспалительное заболевание кишечника, серповидно-клеточная анемия, употребление внутривенных наркотиков) |
||
|
Любая хирургическая процедура во время беременности или послеродового периода, (за исключением наложения швов на промежность сразу после родов), например, аппендэктомия, послеродовая стерилизация |
||
|
Ожирение ИМТ ≥ 40 |
Низкий (учитывается как 2 фактора сразу) |
≥ 3 факторов или персистирующий фактор: Рекомендуется: НМГ не менее 10 дней; Рассмотреть: продление до 6 недель;
2 фактора: Рассмотреть НМГ не менее 10 дней;
0-1 фактор: ранняя активизация, избегание обезвоживания |
|
Экстренное кесарево сечение |
||
|
Ожирение ИМТ ≥ 30 |
Низкий |
|
|
Известная тромбофилия низкого риска (без ВТЭО и без семейного анамнеза ВТЭО) |
||
|
Семейный анамнез неспровоцированного или эстроген-ассоциированного ВТЭО у родственника 1 линии |
||
|
Возраст более 35 лет |
||
|
Курение |
||
|
Значительное (большое, крупное) варикозное расширение вен ног ("gross varicose veins") |
||
|
Текущая системная инфекция |
||
|
Длительное путешествие |
||
|
Множественные роды ≥ 3 |
||
|
Многоплодная беременность |
||
|
Преэклампсия в текущую беременность |
||
|
Внутриутробная гибель плода во время данной беременности |
||
|
Преждевременные роды в текущую беременность (<37 нед) |
||
|
Дегидратация и/или иммобилизация |
||
|
Затяжные роды (>24 часов) |
||
|
Полостные или ротационные щипцы |
||
|
Плановое кесарево сечение |
||
|
Послеродовое кровотечение >1 литра или переливание крови |
Примечание: факторы риска, отнесенные в разных разделах рекомендаций RCOG к разным категориям риска, отнесены в смешанные категории (например, «высокий/средний». Тактика предложена по категории наибольшего риска.
Ключ (интерпретация): содержание столбца «Тактика профилактики ТГВ/ВТЭО в послеродовом периоде (постнатально)», соответствующее выявленным факторам риска и/или категории риска.
Содержание
- Рекомендации утратили силу
- Профилактика, диагностика и лечение тромбоза глубоких вен. Клинические рекомендации.
- Текст в pdf
- Список сокращений
- Термины и определения
- 1. Краткая информация по заболеванию или состоянию (группе заболеваний или состояний)
- 1.1. Определение заболевания или состояния (группы заболеваний или состояний)
- 1.2. Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
- 1.3. Эпидемиология заболевания или состояния (группы заболеваний или состояний)
- 1.4. Факторы риска ТГВ
- 1.5. Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
- 1.6. Классификация заболевания или состояния (группы заболеваний или состояний)
- 1.7. Клиническая картина заболевания или состояния (группы заболеваний или состояний)
- 2. Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
- 2.1. Критерии установления диагноза/состояния
- 2.2. Шкалы вероятности наличия ВТЭО
- 2.3. Жалобы и анамнез
- 2.4. Физикальное обследование
- 2.5. Лабораторные диагностические исследования
- 2.6. Инструментальные диагностические исследования
- 2.7. Иные диагностические исследования
- 2.8. Шкалы риска развития/рецидива ВТЭО и геморрагических осложнений
- 2.8.1. Шкалы риска развития/рецидива ВТЭО
- 2.8.1.1. Риск развития ВТЭО у госпитализированных нехирургических пациентов, шкала Падуа (Padua)
- 2.8.1.2. Риск развития ВТЭО у госпитализированных хирургических пациентов, шкала Каприни (Caprini)
- 2.8.1.3. Риск развития ВТЭО у амбулаторных пациентов, получающих противоопухолевое лечение, шкала Хорана (Khorana)
- 2.8.1.4. Риск рецидива ВТЭО после отмены АКТ: Венская предиктивная модель
- 2.8.1.5. Риск рецидива ВТЭО после отмены АКТ: шкала DASH
- 2.8.1.6. Риск рецидива ВТЭО после отмены АКТ, шкала HERDOO-2
- 2.8.2. Шкалы риска геморрагических осложнений
- 2.8.1. Шкалы риска развития/рецидива ВТЭО
- 2.9. Исследования на врожденные и приобретенные тромбофилии
- 2.9.1. Общая информация о тромбофилиях
- 2.9.2. Распространенность тромбофилий и риск ВТЭО
- 2.9.3. Наиболее значимые тромбофилические состояния
- 2.9.3.1. Наследственный дефицит естественных антикоагулянтов (антитромбина III, протеин C, протеин S)
- 2.9.3.2. Вариант гена фактора V Лейден G1691A
- 2.9.3.3. Вариант гена протромбина G20210A
- 2.9.3.4. Другие наследственные ассоциации
- 2.9.3.5. Антифосфолипидный синдром
- 2.9.3.6. Пароксизмальная ночная гемоглобинурия
- 2.9.4. В каких случаях выполнять тестирование на тромбофилии
- 2.9.5. Когда (по срокам) выполнять тестирование на тромбофилии
- 2.10. Онкопоиск
- 2.11. Диагностика тромбоза глубоких вен в системе верхней полой вены
- 2.12. Верификация ТЭЛА
- 3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
- 3.1. Общие положения и тактика лечения ТГВ
- 3.2. Медикаментозная (антикоагулянтная) терапия
- 3.2.1. Цели медикаментозной (антикоагулянтной) терапии
- 3.2.2. Фазы антикоагулянтной терапии
- 3.2.3. Тактика лечения и длительность антикоагулянтной терапии
- 3.2.3.1. Общие положения, по индивидуальной оценке, баланса между риском рецидива ВТЭО и риском кровотечения.
- 3.2.3.2. Оценка риска рецидива ВТЭО после завершения антикоагулянтной терапии
- 3.2.3.3. Оценка риска геморрагических осложнений при продолжении антикоагулянтной терапии
- 3.2.3.4. Градация степени тяжести геморрагических осложнений
- 3.2.3.5. Баланс пользы и риска при начальной и длительной антикоагулянтной терапии
- 3.2.3.6. Баланс пользы и риска при продленной терапии
- 3.2.3.7. Тактика лечения и длительность антикоагулянтной терапии в зависимости от индивидуального баланса пользы и риска
- 3.2.4. Лекарственные препараты для антикоагулянтной (антитромботической) терапии при ТГВ (общие положения)
- 3.2.5. Лекарственные препараты для начальной и длительной антикоагулянтной (антитромботической) терапии
- 3.2.5.1. Рекомендуемые лекарственные препараты для начальной и длительной терапии
- 3.2.5.2. Сравнение лекарственных препаратов для начальной и длительной терапии
- 3.2.5.3. Начальная и длительная терапия - режим применения антитромботических препаратов
- 3.2.5.4. Гепарин натрия
- 3.2.5.5. Гепарины низкомолекулярные
- 3.2.5.6. Фондапаринукс натрия
- 3.2.5.7. Прямые ингибиторы фактора Xa
- 3.2.5.8. Прямые ингибиторы тромбина
- 3.2.5.9. Антагонисты витамина К
- 3.2.6. Лекарственные препараты для продленной антикоагулянтной терапии
- 3.2.6.1. Рекомендуемые лекарственные препараты для продленной антитромботической терапии
- 3.2.6.2. Сравнение лекарственных препаратов для продленной антитромботической терапии
- 3.2.6.3. Продленная терапия - режим применения антитромботических препаратов
- 3.2.6.4. Нефракционированный гепарин
- 3.2.6.5. Гепарины низкомолекулярные
- 3.2.6.6. Прямые ингибиторы фактора Xa
- 3.2.6.7. Антагонисты витамина К
- 3.2.6.8. Салициловая кислота и ее производные
- 3.2.6.9. Сулодексид
- 3.3. Хирургические и эндоваскулярные вмешательства при ТГВ - общие положения
- 3.4. Хирургическая и эндоваскулярная дезобструкция венозного русла
- 3.4.1. Цель дезобструкции глубоких вен
- 3.4.2. Показания к дезобструкции венозного русла
- 3.4.3. Стратегия раннего удаления тромба
- 3.4.4. Способы эндоваскулярной дезобструкции венозного русла
- 3.4.5. Особенности различных методов эндоваскулярной дезобструкции венозного русла
- 3.4.6. Открытая тромбэктомия
- 3.4.7. Антикоагулянтная терапия при дезобструкции венозного русла
- 3.4.8. Стентирование после дезобструкции венозного русла
- 3.5. Хирургическая и эндоваскулярная профилактика ТЭЛА
- 3.6. Диагностика и лечение рецидива ТГВ
- 3.7. Осложнения антикоагулянтной терапии
- 3.8. Особые ситуации, влияющие на тактику обследования и лечения
- 3.8.1. Особенности диагностики, профилактики и лечения ТГВ во время беременности и в послеродовом периоде
- 3.8.1.1. Формулировка диагноза
- 3.8.1.2. Особенности обследования на тромбофилию
- 3.8.1.3. Оценка риска развития ВТЭО, порядок лечебно-диагностических мероприятий, показания к госпитализации и особенности инструментального обследования
- 3.8.1.4. Особенности терапии ТГВ во время беременности и в послеродовом периоде
- 3.8.2. Инвазивные вмешательства на фоне антикоагулянтной терапии
- 3.8.3. Нейроаксиальная анестезия у пациентов, получающих АКТ
- 3.8.4. Тактика лечения пациентов онкологического профиля с ТГВ/ТЭЛА
- 3.8.5. Тромбоз глубоких вен у отдельных групп пациентов
- 3.8.5.1. Лечение ТГВ у пациентов травматолого-ортопедического профиля
- 3.8.5.2. Тактика лечения ТГВ у пациентов неврологического профиля
- 3.8.5.3. Тактика лечения ТГВ у пациентов с почечной недостаточностью
- 3.8.5.4. Тактика лечения ТГВ у пациентов с ожирением
- 3.8.5.5. Тактика лечения ТГВ у пациентов с тромбофилиями
- 3.8.1. Особенности диагностики, профилактики и лечения ТГВ во время беременности и в послеродовом периоде
- 3.9. Тромбоз глубоких вен верхних конечностей
- 3.10. Катетер-ассоциированный тромбоз глубоких вен
- 3.11. Эластичная компрессия
- 4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации, в том числе основанных на использовании природных лечебных факторов
- 5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- 5.1. Диспансерное наблюдение
- 5.2. Первичная профилактика ВТЭО (профилактика первого эпизода)
- 5.2.1. Оценка степени риска развития ВТЭО
- 5.2.2. Средства профилактики ВТЭО
- 5.2.3. Профилактика ТГВ при длительных авиаперелетах
- 5.2.4. Профилактика у пациентов онкологического профиля
- 5.2.5. Профилактика ВТЭО у пациентов травматолого-ортопедического профиля
- 5.2.5.1. Плановое эндопротезирование тазобедренного или коленного сустава
- 5.2.5.2. Переломы таза, шейки бедренной кости и проксимального отдела бедра
- 5.2.5.3. Операции на коленном суставе, за исключением эндопротезирования
- 5.2.5.4. Ортопедические операции на дистальных отделах нижней конечности (лодыжки, голеностопный сустав, стопа)
- 5.2.5.5. Ортопедические операции на верхней конечности
- 5.2.5.7. Тяжелые травмы (множественные и сочетанные, включая черепно-мозговую, спинного мозга, позвоночника, таза/нижних конечностей)
- 5.2.5.8. Онкоортопедия
- 5.2.6. Профилактика ВТЭО у больных хирургического профиля
- 5.2.7. Профилактика ВТЭО у пациентов терапевтического профиля
- 5.2.8. Профилактика ВТЭО у пациентов с ОНМК
- 5.2.9. Профилактика ВТЭО в ОРИТ
- 5.2.10. Профилактика ВТЭО во время беременности и в послеродовом периоде
- 6. Организация оказания медицинской помощи
- 7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
- Критерии оценки качества медицинской помощи
- Список литературы
- Приложения А1, А2 (состав рабочей группы, методология)
- Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов инструкции по применению лекарственного препарата
- Приложение Б. Алгоритмы действий врача
- Приложение В. Информация для пациентов
- Приложения Г1 - Г20. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
- Приложение Г1. Шкала Уэллса (Wells) вероятности ТГВ
- Приложение Г2. Шкала Уэллса (Wells) вероятности ТЭЛА
- Приложение Г3. Шкала Женева (Geneva)
- Приложение Г4. Шкала Падуа (Padua)
- Приложение Г5. Шкала IMPROVE VTE
- Приложение Г6. Шкала Каприни (Caprini)
- Приложение Г7. Пациент-ориентированный опросник на основе шкалы Каприни (Caprini)
- Приложение Г8. Шкала Хорана (Khorana)
- Приложение Г9 . Шкалы для индивидуальной оценки риска рецидива ТГВ
- Приложение Г10. Шкалы для индивидуальной оценки риска большого кровотечения на фоне АКТ
- Приложение Г11. Шкала оценки риска развития осложнений при амбулаторном лечении ТГВ
- Приложение Г12. Шкала Виллальты (Villalta)
- Приложение Г13. Количественная оценка ТГВ по Мардеру (Marder)
- Приложение Г14. Количественная оценка ТГВ по Арнесену (Arnesen)
- Приложение Г15. количественная оценка ТГВ по междисциплинарному североамериканскому стандарту отчетности
- Приложение Г16. Количественная оценка ТГВ по Бьёргель (Bjorgell)
- Приложение Г17. Количественная оценка ТГВ по Мьюиссен (Mewissen)
- Приложение Г18. Антенатальная и постнатальная оценка факторов риска развития ВТЭО для определения категории риска и порядка лечебно-диагностических мероприятий
- Приложение Г19. Тактика антенатальной профилактики ТГВ/ВТЭО в зависимости от факторов/категории риска
- Приложение Г20. Тактика постнатальной профилактики ТГВ/ВТЭО в зависимости от факторов/категории риска